油梨枝干溃疡病新病原菌鉴定及生物学特性
2022-12-22刘远征李艳霞马蔚红王甲水
张 贺,刘远征,何 昊,李艳霞,马蔚红,王甲水
(1 中国热带农业科学院海口实验站,海口,571101;2 湖南文理学院,湖南常德,415000)
油梨PerseaamericanaMill.,又称鳄梨、牛油果、樟梨、酪梨,是樟科鳄梨属常绿乔木,原产于墨西哥、中美洲湿润地区[1]。我国自1918年引进种植,现海南、云南、广西、广东、福建、四川及台湾等热带亚热带地区均有种植[2]。油梨营养价值较高,富含不饱和脂肪酸、维生素、矿质元素等,在营养保健、抗衰老、美容护肤等方面均有应用价值。油梨还具有经济效益高、市场潜力大、种植管理简单等优势[3]。近年来,我国油梨种植规模迅速扩大。
目前,已报道的油梨茎部病害主要有由新壳梭孢属(Neofusicoccumsp.)、小穴壳属(Dothiorellasp.)引起的油梨枝干溃疡病[4],拟盘多毛孢属真菌(Pestalotiopsissp.)引起的梢枯病[5],南方灵芝Ganodermaaustrale(Fr.) Pat.引起的油梨茎腐病等[6]。国内已报道的油梨真菌病害还有樟疫霉菌Phytophththoracinnamomi、焦菌属(Ustulinasp.)、蜜环菌Armillariellamellea、假蜜环菌Armillariatabescens和丝核菌(Rhizoctoniasp.)等病菌引起的油梨根腐病等[7-8]。当前,尚未见由假可可毛色二孢Lasiodiplodiapseudotheobromae引起油梨枝干溃疡病的相关报道。本研究从海南省儋州市油梨种植园油梨树上发现大量呈溃疡、坏死症状的枝条,严重影响树体树势,通过采集发病枝条、病原菌组织分离纯化、种类鉴定、致病力测定及生物学特性分析等研究,以期为油梨枝干溃疡病的病原诊断、流行规律分析、致病机理挖掘以及病害防治提供参考。
1 材料与方法
1.1 材料
2020年10月,在海南省儋州市油梨种植园发病油梨树上采集病枝,用于病原菌分离。供试油梨品种为中国热带农业科学院海口实验站油梨种质资源圃内种植的4年生油梨植株,分别为“巴康”“祖坦诺”“桂研10号”“哈斯”“桂垦大2号”“富尔特”等 6个品种。
供试培养基:PDA、PCA、CMA、OMA、CA、V8、PSA参考《植病研究方法》[9]配制。真菌DNA提取试剂盒购自美国OMEGA Bio-tek公司,Premix TaqTM、Goldview和DL2000 DNA Marker购自日本TaKaRa Bio公司。设备包括研究级万能数码荧光正置显微镜Imager A2,德国卡尔蔡司股份公司产;PCR仪Tpersonal 48,德国耶拿分析仪器股份公司产;电泳仪DYY-8C,北京六一生物科技有限公司产;凝胶成像系统Azure C150,美国Azure Biosystems产。
1.2 方法
1.2.1 病原菌分离与纯化 采用组织分离法[10],用灭菌解刨刀从发病枝条病健交界处切取5 mm×5 mm的组织块,放入次氯酸钠溶液中消毒1 min,用灭菌超纯水连续冲洗3次,放在灭菌滤纸片上干燥。将组织块放入PDA平板中培养3 d,挑取菌落尖端的菌丝进行纯化。分离菌株培养3周左右产生分生孢子,采用单孢分离法进一步纯化。从14个生长完全一致的分离菌株中选择1株用于后续实验,编号为DZ01。
1.2.2 柯赫氏法则回接试验 挑取菌株DZ01菌落边缘的菌丝活化培养3 d,用直径5 mm打孔器在菌落边缘打孔获取菌饼,用于接种实验。从儋州市试验场红洋队油梨园采集生长健康、大小一致的“哈斯”油梨当年生枝条,剪成长度20 cm的枝段,70%酒精消毒10 s,无菌水冲洗3次后备用。在备用枝条叶间部位针刺4次造成菱形伤口,将菌饼接种至伤口部位,以伤口接种无菌PDA作为对照。接种后的枝条放入铺有湿纱布的塑料框中,保鲜膜密封保湿;置于光照培养箱中,28 ℃,12 h光照/12 h黑暗,相对湿度90%培养。每个处理接种枝条10条,重复3次。每天观察发病情况,当油梨枝条出现典型发病症状时,采用1.2.1方法从发病枝条中再次分离病原菌。
1.2.3 菌株鉴定 形态学鉴定:将菌株DZ01接种到PDA平板上,28 ℃培养36 h,观察菌落形态。继续培养14~21 d,菌落中产生分生孢子器,在正置光学显微镜下观察分生孢子形态特征,测量分生孢子长宽,根据形态特征对菌株DZ01进行初步鉴定。
分子鉴定:将菌株DZ01接种到铺有玻璃纸的PDA平板上培养7 d,用灭菌手术刀刮取菌丝,使用OMEGA真菌DNA提取试剂盒提取真菌基因组DNA,采用ITS、EF1-α的引物序列(见表1)进行PCR扩增。PCR产物经纯化、回收后,送北京擎科生物技术有限公司测序,将获得的序列提交至NCBI进行BLAST比对,并提交序列至GenBank数据库,获得序列登录号;在GenBank数据库中下载同源性高的序列。使用SequenceMatrix软件进行ITS和EF1-α序列片段的拼接,再使用MEGA 6.0[11]软件以邻接法构建系统发育进化树,重复检验1 000次。
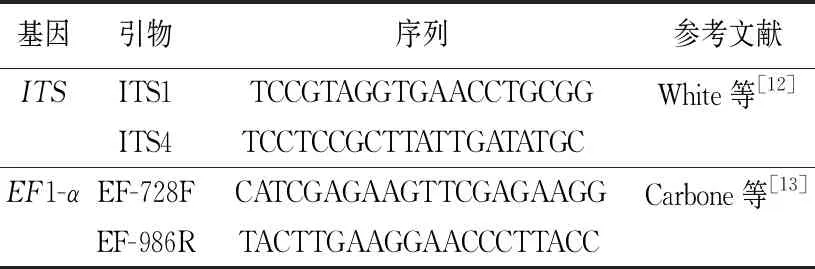
表1 多基因序列引物
1.2.4 不同油梨品种的抗性测定 采用离体接种法评价“巴康”“祖坦诺”“桂研10号”“哈斯”“桂垦大2号”“富尔特”等6个油梨品种对枝干溃疡病的抗性。使用病原菌菌株DZ01分别接种不同品种枝条,接种方法同1.2.2,接种后每天测量病斑大小,记录并统计数据。
1.2.5 病原菌生物学特性测定 不同培养基的影响:选用PDA、PCA、CMA、OMA、CA、V8、PSA等培养基平板,将活化培养2 d的病原菌菌饼(直径5 mm)接种到平板中央,28 ℃培养箱中培养36 h,每处理重复4次,使用十字交叉法测量菌落直径。
不同pH值的影响:将灭菌PDA培养基冷却至50 ℃左右,使用过滤除菌的1 mol/L HCl溶液和1 mol/L NaOH溶液调节培养基pH值至2~11,将活化培养2 d的病原菌菌饼接种到平板中央,28 ℃培养箱培养36 h,每处理重复4次,使用十字交叉法测量菌落直径。
不同碳源的影响:以Czapek培养基为基础培养基,分别用葡萄糖、乳糖、麦芽糖、甘露糖、山梨醇、可溶性淀粉30 g作为碳源替换蔗糖,配制不同碳源培养基,将活化培养2 d的病原菌菌饼接种到平板中央,28 ℃培养箱培养36 h,每处理重复4次,使用十字交叉法测量菌落直径。
不同氮源的影响:以Czapek培养基为基础培养基,分别用硝酸钾、硝酸铵、酵母粉、甘氨酸3 g作为氮源替硝酸钾,配制不同氮源培养基,将活化培养2 d的病原菌菌饼接种到平板中央,28 ℃培养箱培养36 h,每处理重复4次,使用十字交叉法测量菌落直径。
不同光照的影响:将活化培养2 d的病原菌菌饼接种到PDA平板中央,分别设置24 h光照、24 h黑暗和12 h光照+12 h黑暗处理,28 ℃培养箱培养36 h,每处理重复4次,使用十字交叉法测量菌落直径。
1.3 数据处理
采用OriginPro 9.1软件对数据进行统计分析,使用SAS 8.1软件的Duncan’s新复极差法进行差异显著性检验。
2 结果与分析
2.1 油梨枝干溃疡病症状
油梨枝条发病初期呈水浸状病斑,后期病斑暗褐色或黑褐色;病斑椭圆形或不规则形,侵染初期病斑较小,随侵染时间延长不断扩大,部分病斑组织连接成片,表面凹陷,表皮开裂,皮层内韧皮组织溃疡;严重时整个枝条枯死,导致树势衰弱,甚至整株死亡。此外,病原菌还可侵染枝条皮孔,导致皮孔开裂,在枝条表皮形成颗粒状突起(见图1)。
2.2 病菌回接
接种分离菌株DZ01 1 d后,枝条表面出现水渍状椭圆形病斑;接种3 d后,油梨枝条病斑黑褐色,表面出现凹陷,呈典型的溃疡症状;而对照无症状(见图1)。枝条发病部位病健交界处分离获得的病原菌菌株与接种菌株DZ01菌落形态特征相同,从而确定菌株DZ01是引起油梨枝干溃疡病的病原菌。

图1 油梨枝干溃疡病症状及菌株DZ01接种油梨枝条的致病性
2.3 病原菌鉴定
2.3.1 形态鉴定 接种菌株DZ01于PDA平板上,28 ℃培养36 h即可长满直径9 mm的PDA平板。菌落初期白色,绒毛状,气生菌丝发达,边缘整齐;培养7 d后,菌落出现黑色素沉淀,灰色至灰黑色;培养15~21 d时,菌丝体表面产生灰黑色的分生孢子器,近球形或球形,单生或聚生,具孔口,孔口开裂时溢出黑色或无色液体。分生孢子无色透明,椭圆形,顶端和基部圆形,中间最宽,壁厚;老熟时变成含1个分隔的深褐色分生孢子(见图2)。分生孢子大小为(18.0~26.4) μm×(12.3~14.1) μm(n=50),平均23.0 μm×13.5 μm,分生孢子长宽比为1.7。参照Phillips等[14]的分类和描述,该菌株DZ01初步鉴定为毛色二孢属真菌(Lasiodiplodiasp.)
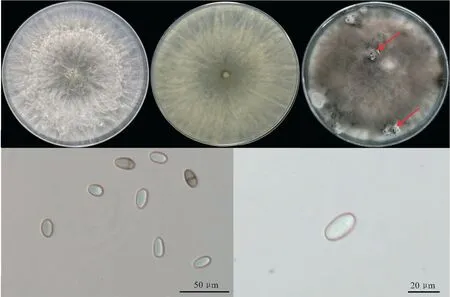
注:箭头示分生孢子器。
2.3.2 分子鉴定 测序后获得菌株DZ01的ITS序列为523 bp(登录号:MZ452371.1),EF1-α序列为307 bp(登录号:MZ467414.1),将上述序列在NCBI上进行BLAST比对。结果显示,该病原菌的ITS序列与Lasiodiplodiapseudotheobromae(登录号:MK529970.1)的同源性达99.81%,EF1-α序列与L.pseudotheobromae(登录号:MK562455.1)的同源性达99.32%。将2种基因的序列拼接,并在GenBank数据库中下载相关基因序列(见表2),联合构建系统发育树,结果表明,分离菌株DZ01与L.pseudotheobromae聚在一起,形成1个明显的分枝,而与Lasiodiplodia属的其他种亲缘关系较远(见图3)。结合形态学鉴定结果,确定油梨枝干溃疡病病原菌为可可毛色二孢Lasiodiplodiapseudotheobromae。

表2 不同病菌相关基因序列登录号

图3 油梨枝干溃疡病病原菌ITS-EF1-α的多基因系统发育树
2.4 不同油梨品种的抗性
菌株DZ01离体接种6个油梨品种发现,供试油梨品种均能感病,接种3 d时病斑长度6.8~26.9 mm。其中“富尔特”最感病,病斑扩展迅速,接种3 d时病斑长度达到26.9 mm,显著高于其他品种;“哈斯”“巴康”“桂垦大2号”“桂研10号”中等感病,接种3 d时病斑长度8.5~14.8 mm;“祖坦诺”最耐病,病斑长度显著低于其他品种,为6.8 mm(见表3)。
2.5 不同光照条件的影响
不同光照条件下,DZ01菌株的菌丝生长一致,菌落直径差异不显著,表明不同光照条件对病原菌菌丝生长无显著性影响(见表3)。

表3 不同油梨品种对枝干溃疡病病原菌抗性比较及不同光照下该病原菌菌落生长比较
2.6 不同培养基、pH值、碳源或氮源的影响
不同培养条件对油梨枝干溃疡病病原菌菌落生长的影响不同。该病原菌在PCA培养基中生长迅速,菌落直径最大,PCA为最适培养基;OMA培养基上菌落直径最小。不同pH值对菌株DZ01菌丝生长的影响差异显著(p<0.05)。pH值3~10该病原菌均可生长,pH值2、11病原菌不生长;pH值3~4时,病原菌菌落直径逐渐增大;当pH值4~11时,病原菌的菌落直径则逐渐变小。该病原菌的最适pH值为4,适合在偏酸条件下生长。病原菌在供试碳源和氮源的Czapek上均可生长,但利用程度不同。以蔗糖为碳源的培养基上,病原菌菌落直径最大,蔗糖为最佳碳源。病原菌在以酵母粉为氮源的培养基上菌丝生长最快,酵母粉为最适氮源(见表4)。

表4 不同培养基、pH值、碳源或氮源对油梨枝干溃疡病病原菌菌落生长的影响
3 结论与讨论
对海南省儋州市油梨园枝干溃疡病病原菌进行分离鉴定和致病性分析表明,该病害是由Lasiodiplodiapseudotheobromae侵染引起的,这是该病原菌导致油梨枝干溃疡病的首次发现。研究表明,多种病原菌可侵染油梨引起枝干溃疡病,包括Neofusicoccumaustrale、N.luteum、N.parvum、N.nonquaesitum、Fusicoccumaesculi、Dothiorellaiberica、Phytophthoracitricola等[15-17]。这些病原菌可侵染油梨主干、分枝及当年生枝条,形成深褐色坏死病斑。本研究发现,L.pseudotheobromae主要为害油梨分枝和当年生枝条。
L.pseudotheobromae寄主范围较广,是一类重要的植物内生菌和病原真菌。Correia等报道L.pseudotheobromae可引起葡萄枝干溃疡病[18],导致主干和枝条产生坏死性褐色斑点、皮部开裂等症状,与本研究的病害症状表现相似。此外,该病原菌侵染也可导致苹果枝干溃疡病[19]、马占相思枝干溃疡病[20]、朴树枝干溃疡病[21]等。品种抗性试验结果表明,“富尔特”“哈斯”等油梨品种对枝干溃疡病的抗性较弱,对于种植“富尔特”“哈斯”等品种的园区,需高度重视,做好防控。而“祖坦诺”对枝干溃疡病抗性较强,可作为候选抗性品种进一步评估。
生物学特性研究表明,油梨枝干溃疡病病原菌的最适培养基为PCA;适宜pH值范围较广,pH值4时菌丝生长最快;最适碳源为蔗糖,最适氮源为酵母粉;不同光照条件对菌丝生长速率无显著性影响。本研究对于油梨枝干溃疡病病原菌的鉴定和防治具有指导意义,也为进一步开展病原诊断、病原菌发病规律探究以及药剂筛选等研究奠定了基础。
