银杏BBX 家族生物信息学鉴定及表达分析
2022-12-20王立芹曹振玉何长流王小青李路文杨美玲
王立芹,曹振玉,何长流,王小青,李路文,杨美玲
(1.临沂市森林湿地保护中心,山东 临沂 276001;2.临沂科技职业学院,山东 临沂 276025)
银杏(Ginkgo biloba)为银杏科银杏属落叶乔木,几亿年前就已出现在地球上,是第四纪冰川运动后遗留下来的裸子植物中最古老的孑遗植物,和它同纲的其他植物几乎都已灭绝,因此银杏又有“活化石”的美称。它具有一系列迷人的特征,包括大基因组、对非生物和生物胁迫的出色抗性以及雌雄异株繁殖等,使其成为生物学研究的理想模型物种[1]。
锌指蛋白是一类具有手指状结构域的转录因子[2],对基因调控起重要的作用,并在促进植物发育、增强植物抗逆性等方面发挥重要功能[3]。根据成员结构和功能特征可将锌指转录因子进一步分为几个亚家族。近年来,BBX 蛋白因其多种功能而备受关注[4]。植物中的BBX 蛋白在N 端由1 个或2 个保守的B-box结构域组成,有时在C 端有一个 CCT(CONSTANS、CO 样和 TOC1)结构域。其中,B-box 基序在蛋白质-蛋白质相互作用和转录调控中发挥重要作用,而CCT 结构域参与核转运和转录调控[5-7]。在拟南芥中,已鉴定出 32 种BBX 蛋白,根据B-box 结构域和CCT结构域的差异可将这32 种BBX 蛋白分为5 个亚组[6]。
随着研究的深入,有越来越多的证据表明,植物 BBX 蛋白在开花诱导、光形态发生、避荫反应、类胡萝卜素生物合成和生物和非生物应激反应等多种生理和生化过程中发挥着关键作用[8]。CONSTANS(CO)/AtBBX1是拟南芥中研究的首个BBX基因,是通过触发开花基因座T(FT)基因的表达来控制开花时间的中心协调因子[9];研究还发现BBX4、BBX7和BBX32 基因也可调节开花时间。另外,已有数十个BBX基因被确定为早期光形态发生的调节因子[7];BBX4、BBX21、BBX22和BBX23被证实可正调控植物光形态发生,而BBX19、BBX20、BBX24等可对拟南芥光形态发生进行负调控[10]。一些BBX基因也通过介导细胞伸长显示出它们在避荫反应中的功能[11]。BBX 蛋白还参与非生物应激反应和激素信号网络。例如,BBX18 和BBX23 是热形态发生的正向调节因子,它们的缺陷突变将导致热响应性下胚轴伸长受限[12]。BBX24 在拟南芥中最初是作为一种耐盐蛋白(STO)被分离出来的,研究发现该蛋白增加了酵母细胞的耐盐活性,当其在拟南芥中过表达时,可明显促进高盐度条件下根的生长[13]。BBX基因在植物激素信号转导中的功能也有报道。AtBBX18(AtDBB1a)是赤霉素(GA)信号通路中的正调节剂[12]。有趣的是,BBX蛋白在果实发育过程中也发挥了重要作用。MdBBX22(MdCOL11)参与MdHY5介导的信号转导并调节苹果皮中花青素的积累[14],SlBBX20 蛋白通过直接激活PHYTOENE SYNTHASE 1 的表达促进了番茄叶绿体的发育和类胡萝卜素的积累[8]。
目前,拟南芥、番茄、梨和苹果中关于BBX 家族的研究报道较多,但有关银杏中BBX基因的相关研究尚未见报道。2021 年,Liu 等[1]公布了银杏基因组序列。这为BBX基因在银杏中的功能研究提供了条件。该研究根据基于隐马尔可夫模型(HMM)的图谱(B-box 型锌指结构域,PF00643),使用SMART和Pfam 数据库筛选和验证了银杏全基因组注释蛋白质,从中鉴定出12 个GbBBX基因,并对GbBBX 蛋白成员的保守结构域、基因结构、系统发育关系和组织表达谱进行了分析,以期为银杏中BBX基因的进一步功能表征提供依据,同时也为进一步揭示银杏生长发育机理提供了坚实的分子基础。
1 材料与方法
1.1 银杏GbBBX 转录因子的鉴定
为了识别BBX 转录因子家族,从Pfam 数据库下载了B-box 型锌指结构域(PF00643)的隐马尔可夫模型(HMM)谱。银杏的参考基因组在GigaDB数据库中下载[15]。使用截止E 值≤0.01 的HMMER SEARCH3.0 和SMART 数据库确认BBX 家族成员之间的保守域。使用ExPaSy 在线工具计算理论pI 和Mw 值。采用SWISS-MODEL 在线工具进行蛋白质建模,采用softberry 在线软件预测基因的推定亚细胞定位(http://www.softberry.com)。
1.2 系统发育分析
GbBBX基因的蛋白序列来自银杏参考基因组(http://gigadb.org/dataset/100613),SlBBX基因的序列来自番茄参考基因组SL4.0(https://solgenomics.net/organ ism/Solanum_lycopersicum/genome),而AtBBXs的蛋白序列来自拟南芥参考基因组 (https://www.arabidopsis.org/)。采 用MEGA-X 程 序 构 建GbBBX、SlBBX 和AtBBX 蛋白的无根邻接系统发育树,引导测试重复1 000 次。
1.3 保守基序、基因结构和启动子区域顺式作用元件分析
使用MEME 在线工具估计保守域,并使用DNAMAN进行比对。采用Gene Structure Display Server预测GbBBX的基因结构。选择GbBBX基因CDS区2 000 bp 的上游序列作为启动子区域,并使用PlantGBRE 网络工具预测每个基因中的顺式元件。采用Tbtools 绘图[15]。
1.4 表达模式分析
转录组原始数据是从 GigaDB 数据库中下载,每百万外显子模型的每千碱基片段数(FPKM)值代表相应的基因表达量[16]。表达量热图通过R 语言pheatmap 包完成。为了深入了解GbBBX基因家族在银杏植物整个发育阶段的潜在功能,从银杏基因组在线数据库选择了来自浙江省天目山的银杏胚(雌树)、雄蕊(雄树)和幼苗(茎和叶混合样)3 个部位的表达量数据,并筛选GBBBX家族基因用于表达谱分析。
2 结果与分析
2.1 银杏BBX 转录因子筛选及理化性质分析
根据基于隐马尔可夫模型(HMM)的图谱(B-box型锌指结构域,PF00643),使用SMART 和Pfam 数据库筛选和验证了全基因组注释蛋白质。在银杏基因组中共鉴定出12 个GbBBX基因。基于它们的染色体位置区域排序,12 个GbBBX基因在基因亚家族中被命名为GbBBX1至GbBBX12。根据注释的基因组中GbBBX基因家族的物理位置信息,发现12 个GbBBX基因广泛分布在第2、3、9 号染色体以外的其他染色体中;其中,GbBBX1和GbBBX2基因位于1 号染色体上,GbBBX4、GbBBX5、GbBBX6基因位于5 号染色体,其它成员分别位于不同的染色体上(表1)。GbBBX 蛋白的分子量(Mw)在 29.595 59 kDa (GbBBX4编码) 和 81.740 51 kDa (GbBBX10编码) 之间变化。GbBBX 的理论等电点(PI)介于5.05(GbBBX4编码)和8.07(GbBBX10编码)之间,且大部分为弱酸性蛋白。亚细胞定位预测结果表明,GbBBX2、GbBBX4、GbBBX7、GbBBX8、GbBBX9和GbBBX12编 码 的 蛋白质主要定位于细胞核中,而GbBBX1、GbBBX3、GbBBX5、GbBBX6、GbBBX10和GbBBX11编 码 的 蛋白质定位于细胞核外结构,如叶绿体和线粒体等部位。
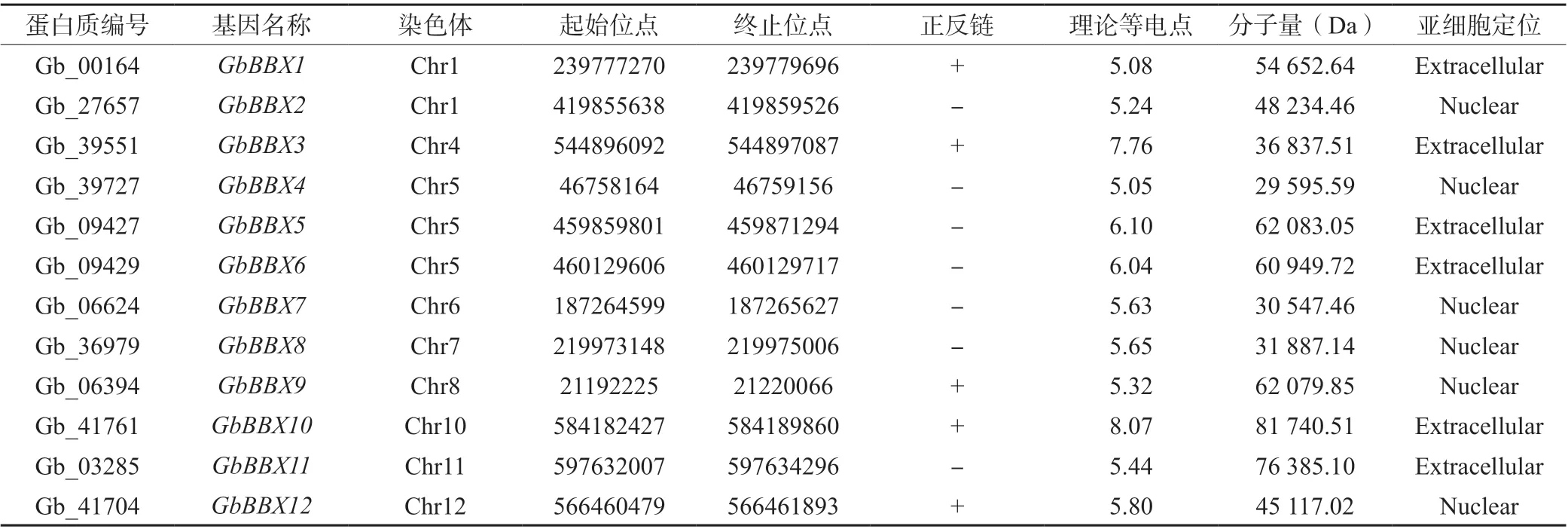
表1 GbBBX 基因家族信息
2.2 GbBBX 蛋白家族的保守结构域
如图1 所示,银杏中B-box 锌指结构域的保守序列主要以2 种形式存在,分别为B-box1(C-X2-CX7-8-C-X2-D-X-A-X-L-C-X2-C-D-X3-H-X2-N-X4-H,以蓝色表示)和B-box2[C-X2-C-X8-C-X7-C-X2-CX4-H(N)-X6-8-H 的,以绿色表示]。蛋白质序列比对结果显示,2 个B-box 结构域具有高度相似的保守序列。例如,构成锌指的半胱氨酸(C)和天冬氨酸(D)残基在B-box 结构域中高度保守。然而,通过对GbBBX 家族成员保守结构域的分析可知,由于B-box1 结构域中的保守氨基酸残基(Asn、Leu、His和 Arg)保守基序符号被反转,因此B-box1 结构域基序比B-box2 结构域的基序更加保守。此外,BBX家族还具有高度保守的CCT 结构域(R-X5-R-Y-X2-KX3-R-X3-K-X2-R-Y-X2-R-K-X2-A-X2-R -X-R-X2-G-RF-X-K,图1 中以红色表示)。12 个GbBBX 蛋白中,GbBBX3、GbBBX4、GbBBX7、GbBBX8这4 个基因编码的蛋白质仅含有一个B-box2 结构域,而其余8 个基因编码的蛋白质包含了完整的2 个B-box 结构域和1 个CCT 保守结构域。
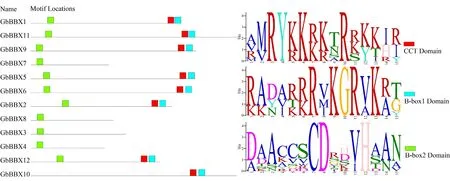
图1 GbBBX 蛋白家族的结构域
2.3 银杏BBX 转录因子基因结构分析
由图2 可知,GbBBX基因家族的外显子数量在1~5 个之间。其中,GbBBX5、GbBBX6、GbBBX9和GbBBX10这4 个基因有5 个外显子,即银杏BBX基因家族中33.3%的基因有5 个外显子;GbBBX1、GbBBX4、GbBBX7、GbBBX8和GbBBX11这5 个基因有3 个外显子,占比41.7%;GbBBX2和GbBBX12这2 个基因有2 个外显子,占比16.7%;GbBBX3基因只有1 个外显子,占比8.3%。此外,GbBBX基因家族各成员基因长度具有明显的差异,其中最长的基因为GbBBX9,而最短的基因为GbBBX4。
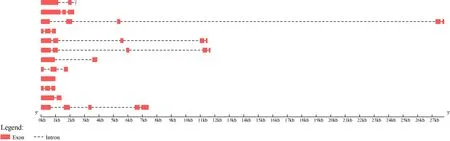
图2 GbBBXs 的基因结构分析
2.4 不同物种BBX 转录因子的系统进化分析
在进化分类中,GbBBX5、GbBBX6、GbBBX9和 GbBBX10 蛋白被发现是同源的,它们都包含2 个保守的B-box 结构域和1 个CCT 保守结构域;而GbBBX1、GbBBX11、GbBBX2、 和GbBBX12 蛋 白同源性较高,同样包含2 个保守的B-box 结构域和1个CCT 保守结构域;GbBBX4 和GbBBX8 蛋白同源性较高,他们只有单一的1 个B-box 结构域;特殊的是,GbBBX3 和GbBBX7 与其他GBBBX 成员的同源性较低,他们也只有单一的1 个B-box 结构域。
为了研究GbBBX基因家族的系统发育关系,基于银杏中的GbBBX 蛋白序列、拟南芥中的AtBBX 蛋白序列和番茄中的SlBBX 蛋白序列构建了邻接(NJ)系统发育树。如图3 所示,所有BBX 蛋白被分为5个进化枝,其中每个进化枝均包含了来自3 个物种的BBX 蛋白,且各物种在各分支的蛋白数量相似;各进化枝都对应于它们指定的结构域,而一些具有相似结构域的 GbBBX 蛋白被聚集成不同的进化枝,例如GbBBX3 和GbBBX7 被分别聚集在进化枝II 和进化枝III 中;大部分的GbBBX 蛋白被聚集在进化枝I 中,而拟南芥和番茄的BBX 蛋白聚集在其他4 个进化枝中,说明在整个物种进化当中,银杏的同源性与模式植物拟南芥和果实模式植物番茄同源关系较远。但特别的是,番茄的SlBBX26 被聚集在进化枝I 当中,说明虽然物种间同源关系较远,但是BBX 蛋白仍存在非常保守的结构域,由此推测,GbBBX 可能在银杏的生长发育过程中扮演着番茄SlBBX26 类似的功能。
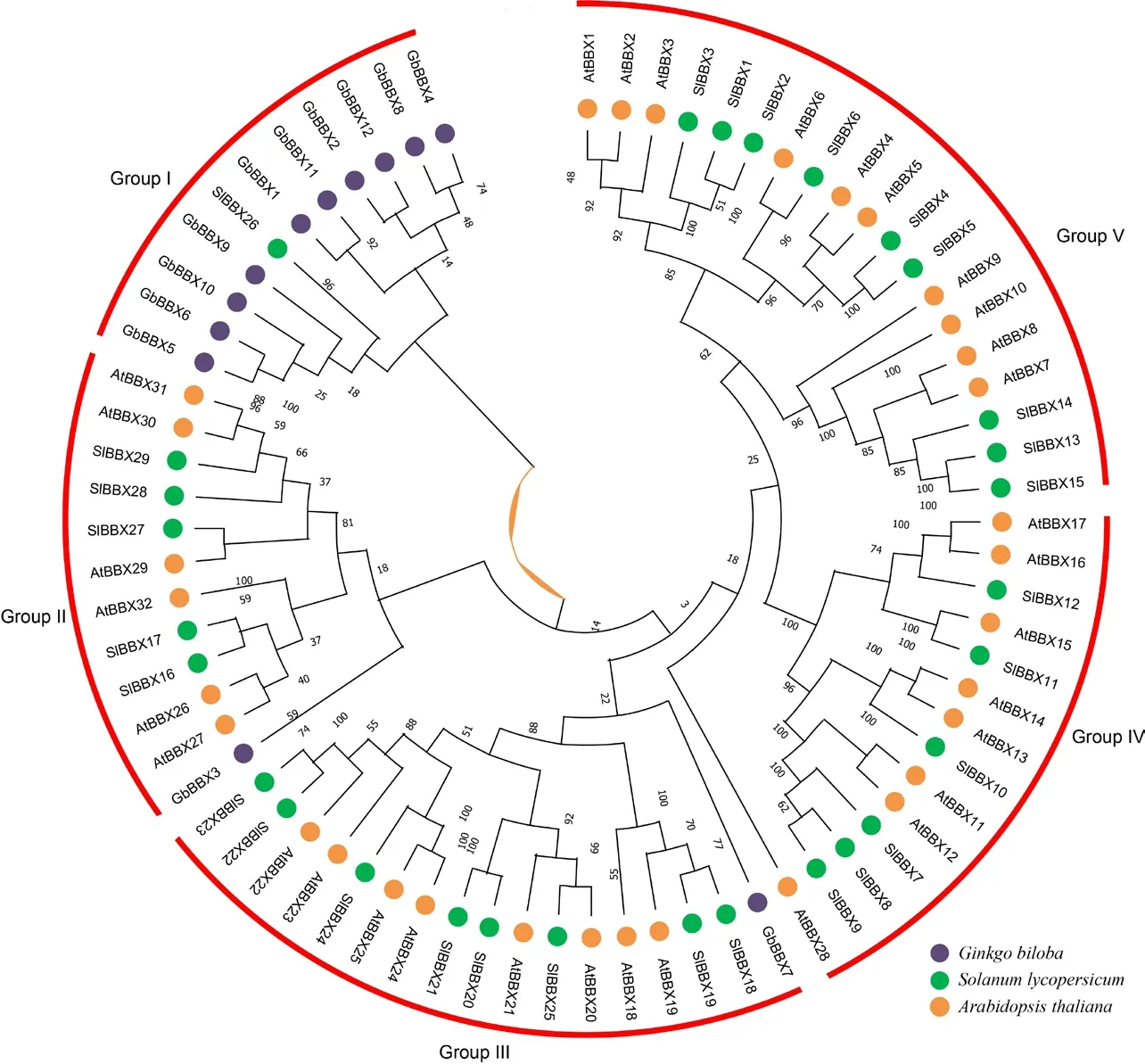
图3 银杏、番茄和拟南芥中BBX 蛋白的系统发育进化树
2.5 银杏BBX 转录因子启动子区域顺式作用元件分析
选择编码区上游的 2 000 个碱基对(bp)作为GbBBX中的启动子序列,以预测顺式调控元件。在GbBBX基因家族的启动子区域中总共鉴定出32 类顺式元件类型(图4)。少数GbBBX基因具有与细胞发育相关的顺式元件,例如参与胚乳表达的顺式调节元GbBBX1 GbBBX11 GbBBX9 GbBBX7 GbBBX5 GbBBX6 GbBBX2 GbBBX8 GbBBX3 GbBBX4 GbBBX12 GbBBX10件、栅栏叶肉细胞分化的元素、与分生组织表达相关的顺式调节元件、玉米醇溶蛋白代谢调节的顺式调节元件等。此外,许多GbBBX基因含有与应激反应途径相关的顺式元件,包括对光的反应、厌氧诱导、防御、缺氧特异性诱导有关的增强子、低温反应、干旱诱导、昼夜节律控制、防御和应激反应等。另外,GbBBX基因启动子区域中还存在部分典型的激素相关顺式调节元件,包括脱落酸反应元件、水杨酸和赤霉素以及生长素反应的元件。特别的是,在GbBBX家族基因启动子区域中,参与光反应的顺式作用元件最多,包括ACE、AE-box、Box 4、chs-CMA1a、GATA-motif、G-Box、GT1-motif、I-box、MRE、Sp1、TCT-motif(表2)。
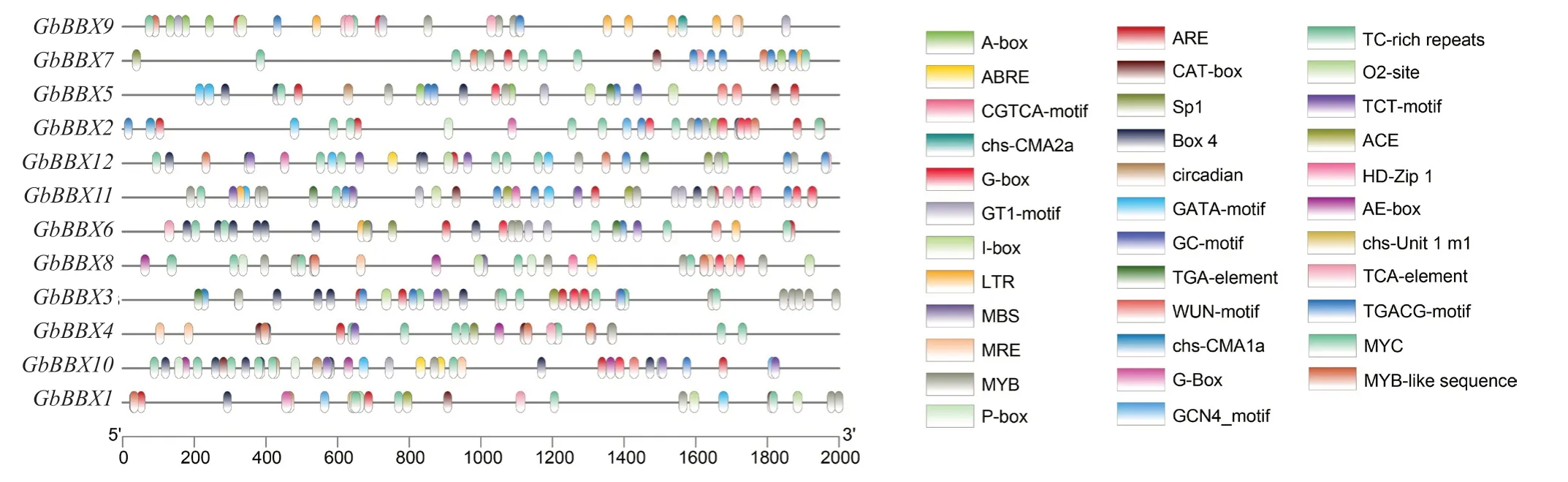
图4 预测 GbBBX 基因家族的顺式作用元件
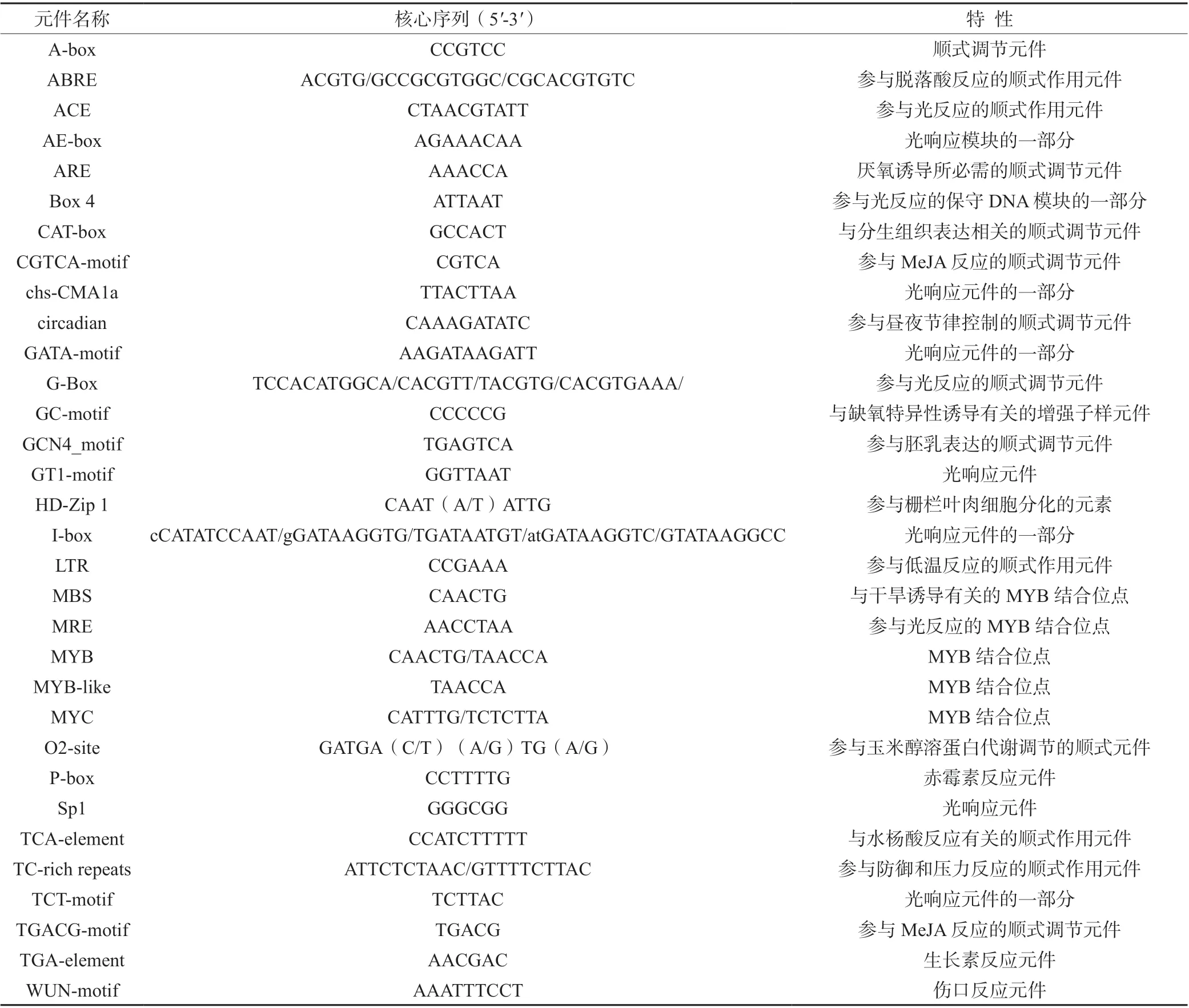
表2 银杏GbBBX 基因家族启动子保守顺式作用元件
2.6 银杏BBX 转录因子表达模式分析
如图 5 所示,大多数GbBBX基因在不同部位中表现出表达差异性,可将12 个GbBBX的表达模式分为3 组。其中,GbBBX2、GbBBX3和GbBBX8这3 个基因在胚中的表达量相对较高;而GbBBX5、GbBBX6、GbBBX9、GbBBX11和GbBBX12这5 个 基因在幼苗中的表达量较高,在其他组织类型中不表达或低表达;GbBBX1、GbBBX4、GbBBX7和GbBBX10这4 个基因在银杏雄蕊和幼苗中均有高量的表达。这些结果表明,GbBBX基因在银杏植株的生长发育过程中具有多种功能。
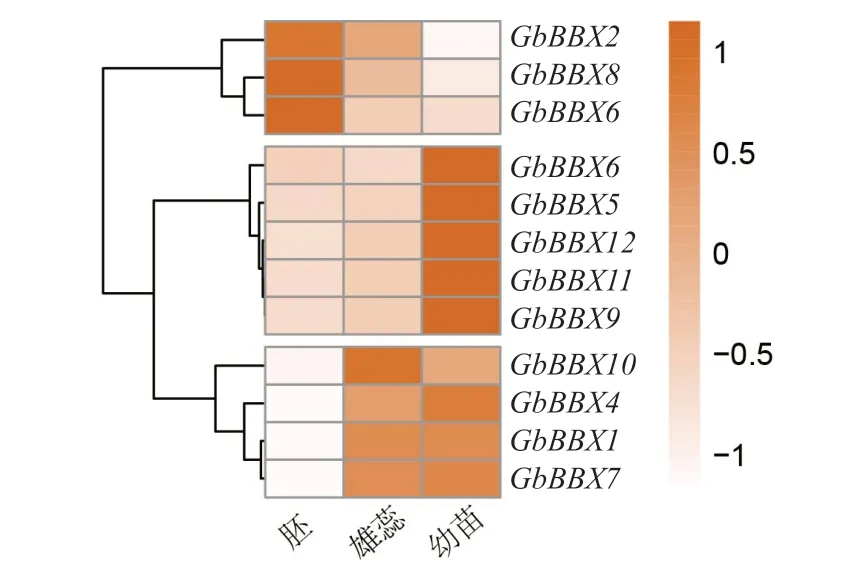
图5 银杏不同部位的GbBBX 基因的表达模式
3 讨 论
B-box(BBX)转录因子是锌指蛋白家族的一个亚家族,具有多种生物学功能,近年来引起了学者的广泛关注[7]。随着二代测序技术的不断完善,大多数物种的参考基因组测序完成,越来越多的BBX 转录因子家族被鉴定出来。例如,拟南芥中包含32 个BBX 成员[6]、番茄中包含29 个BBX 成员[17]、辣椒中包含23 个BBX 成员[18]。该研究结果显示,银杏中鉴定出12 个GbBBX 蛋白。GbBBX基因在银杏的12条染色体上分布不均匀,并且相对于拟南芥和番茄来说成员数量较少。推测这可能是因为进化过程中物种特异性的重复或缺失导致了不同物种间BBX 转录因子家族数量存在差异。
在银杏中,根据结构域的数量和类型将12 个成员分为2 类,包括4 个具有单一B-box 结构域的基因和8 个具有2 个B-box 结构域和1 个CCT 结构域的基因。B-box 保守基序在蛋白质相互作用和转录调控中起关键作用,而CCT 结构域主要参与核转运和转录调控[19]。此外,外显子-内含子结构也影响基因的功能。GbBBX家族的外显子数量从 1 个到 5 个不等,整个家族中仅有1 个基因没有内含子。通过聚类分析构建的系统发育树将银杏、番茄和拟南芥的BBX 蛋白分为5 个进化枝。由于高度保守的外显子-内含子特征,相同进化枝中的BBX 蛋白可能具有相似的功能。功能多样性的另一个原因是启动子区域中不同的顺式调节元件[20]。启动子区域的大量顺式元件与光反应有关,包括Box4、G-Box、GT1-motif 等。许多BBX 蛋白在光信号通路中发挥关键作用,例如,AtBBX20 是光信号转导的正调节因子[21]。此外,GbBBX基因启动子区域中还存在与激素相关的顺式调节元件,如ABRE参与对脱落酸的反应,TCA-element 参与水杨酸反应,CGTCA-motif 和TGACG-motif 是参与茉莉酸甲酯反应所必需的顺式作用元件。启动子区域中多样化的结构域、结构和顺式调节元件可能导致GbBBX转录因子家族的多种功能。
多项研究表明,BBX基因广泛参与植物的生长发育过程。例如,拟南芥中的B-box 蛋白STH2 是光形态发生的正调节因子,在转录激活中起直接作用[21]。沉默PpBBX16可减少梨(Pyrus pyrifolia)中花青素的积累[22]。拟南芥中含有B-box 结构域的AtBBX19转录调节因子参与了光形态发生[10]。COP1 介导的AtBBX22基因降解促进了拟南芥幼苗的发育[23]。拟南芥的AtBBX21基因可以与COP1 相互作用来调节植株的避荫反应,并促进长下胚轴的形成[4]。然而,迄今为止,BBX 家族基因在银杏中的具体作用仍不清楚。该研究以来自浙江省天目山的银杏胚(雌树)、雄蕊(雄树)和幼苗(茎和叶混合样)的转录组数据进行GbBBX基因表达量的分析。所有12 个GbBBX基因都参与了银杏生长发育过程的调控,并且在各组织中组成型表达。这说明GbBBX基因可能在银杏雄树雌树的生长发育过程、新陈代谢和响应外界胁迫等方面扮演重要的角色。但是具体的调控机制和功能需要进一步的分子生物学试验来验证。该研究为筛选参与银杏生长发育的转录因子提供了有力的参考,为进一步表征GbBBX的功能奠定了坚实的基础。
