症状性颈内动脉狭窄与Willis环变异的关系研究
2022-12-20杜利娟王山林
杜利娟,王山林
(北京市密云区中医医院放射科 北京 101500)
颈内动脉是动脉粥样硬化的常见发病部位,颈内动脉重度狭窄常引起颅内血管血流动力学改变,大脑血流量减少,进而发展为缺血性脑血管病[1]。颈内动脉重度狭窄患者的临床表现存在很大差异,一些患者无任何异常,而另一些患者则出现大面积脑梗死,主要取决于颅内侧支循环[2],其中Willis环是大脑侧支循环中最重要的途径,Willis环变异影响其代偿潜能[3]。既往学者多利用TCD、MRA、DSA等影像方法评估颈内动脉狭窄患者的Willis环代偿作用,而CTA研究相对较少[4]。本文旨在通过CTA观察颈内动脉重度狭窄患者Willis环形态,探讨症状性颈内动脉狭窄与Willis环变异的关系。
1 资料与方法
1.1 一般资料
选取2016年1月—2020年12月于北京市密云区中医医院经CT血管造影(CTA)发现单侧颈内动脉起始部狭窄≥70%的患者83例。根据患者有无脑缺血症状分为症状组(45例)、无症状组(38例体检人群)。症状组中男25例,女20例;年龄45~71岁,平均(62.15±8.21) 岁;临床表现主要为头晕、头疼、肢体无力、言语不利、视物不清等。无症状组中男21例,女17例;年龄42~69岁,平均(59.72±9.36)岁。两组患者的年龄、性别比例、吸烟史、饮酒史、高血压、糖尿病等临床资料比较差异无统计学意义(P>0.05),具有可比性。
纳入标准:①患者符合NASCET标准[5],单侧颈内动脉起始部狭窄≥70%;②所有病例均经头颅CT或MRI证实,影像清晰,临床资料完整。排除标准:烟雾病、脑动脉炎、心源性脑梗死及自身免疫性疾病等非动脉粥样硬化性缺血性脑血管病患者。
1.2 方法
1.2.1 头颈CTA检查
使用GE LightSpeed 64排螺旋CT。患者取仰卧位,叮嘱患者头部制动,严禁吞咽动作。扫描定位像后,使用双筒高压注射器经肘前正中静脉注入100 mL碘海醇(350 mgI/mL),流率为5.0 mL/s,随后以相同流率注射50 mL 0.9%氯化钠溶液。扫描范围从主动脉弓至颅顶。采用智能触发技术进行扫描,CT触发阈值为100 HU。扫描参数:管电压120 kV,管电流350 mAs,层厚0.625 mm,矩阵512×512,螺距0.531:1。扫描结束后,将图像传到ADW4.6工作站,利用后处理软件对原始图像进行最大密度投影(MIP)、容积再现(VR)、多平面重组(MPR)等三维重建。后重建完成后,将所有数据传到PACS系统。
1.2.2 图像分析
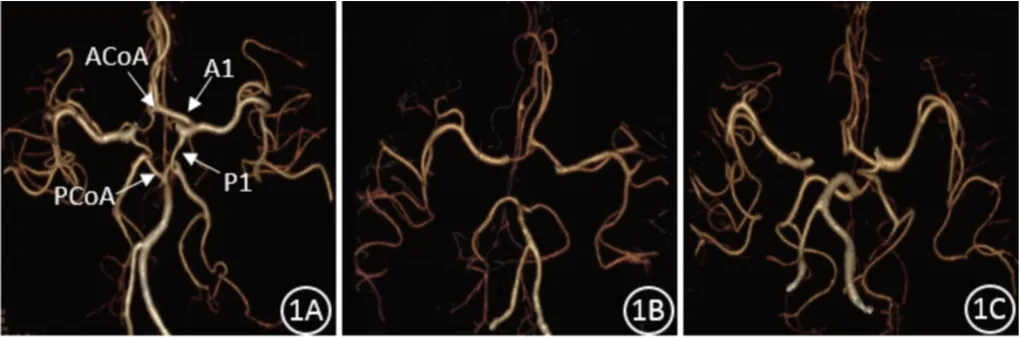
在PACS系统中调取上述病例的图像,由2名熟悉脑血管影像的高年资医师阅片。在头颈CTA图像上重点观察双侧大脑前动脉A1段、前交通动脉(ACoA)、双侧大脑后动脉P1段及后交通动脉(PCoA)。规定CTA图像上血管充盈良好且管径≥1 mm为发育正常,管径<1 mm为发育不良,血管未见显影为缺如,将发育不良和缺如判定为变异[6]。根据Willis环组成血管的发育情况,分为四型[7]:Ⅰ型(完整型):Willis环的各部分组成血管都发育正常、完整存在;Ⅱ型(前循环型):前循环完整,后循环至少一支血管发生变异;Ⅲ型(后循环型):后循环完整,前循环至少一支血管发生变异;Ⅳ型(不完整型):前后循环均显示不完整。见图1。两位医师有分歧的病例,协商达成一致。
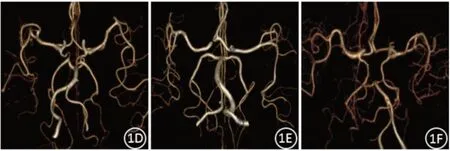
图1 Willis环分型
1.3 观察指标
观察患者Willis环分型及组成血管(A1、P1、ACoA、PCoA)的变异情况。
1.4 统计学方法
采用SPSS 20.0统计软件分析数据。符合正态分布的计量资料以均数±标准差()表示,行t检验;计数资料以频数(n)、百分率(%)表示,行χ2检验,P<0.05为差异有统计学意义。
2 结果
2.1 两组患者Willis环分型比较
症状组Ⅰ型Willis环仅2例,明显少于无症状组的13例;症状组Willis环变异率为95.5%(43/45),高于无症状组的65.8%(25/38),差异有统计学意义(χ2=10.400,P<0.05)。症状组Ⅳ型Willis环的比例最高,占60.0%,明显高于无症状组的5.3%;无症状组Ⅱ型Willis环的比例最高,占50.0%,明显高于症状组的22.2%。症状组前循环完整12例(26.7%),后循环完整8例(17.8%);无症状组前循环完整32例(84.2%),后循环完整17例(44.7%);症状组前循环及后循环完整比例均低于无症状组,差异有统计学意义(χ2=27.388,P<0.05;χ2=7.114,P<0.05)。见表1。

表1 两组患者Willis环分型比较[n(%)]
2.2 两组患者Willis环组成血管变异情况比较
症状组患者A1段变异率高于无症状组,差异有统计学意义(P<0.05);两组患者P1段、ACoA及PCoA变异率的差异无统计学意义(P>0.05)。见表2。
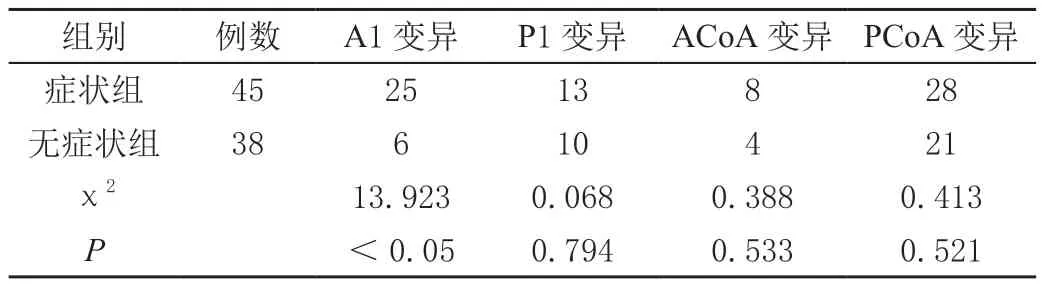
表2 两组患者Willis环组成血管变异情况比较 单位:例
2.3 两组患者Willis环变异与临床表现比较
无症状组患者Willis环变异率低,Willis环完整性好,侧支代偿丰富,临床上无脑梗死或仅出现腔隙性脑梗死。症状组患者Willis环变异率高,侧支代偿能力差,脑梗死范围较大,脑缺血症状明显,其中Ⅳ型Willis环患者临床症状最重,严重者出现大面积脑梗死。见图2~图4。
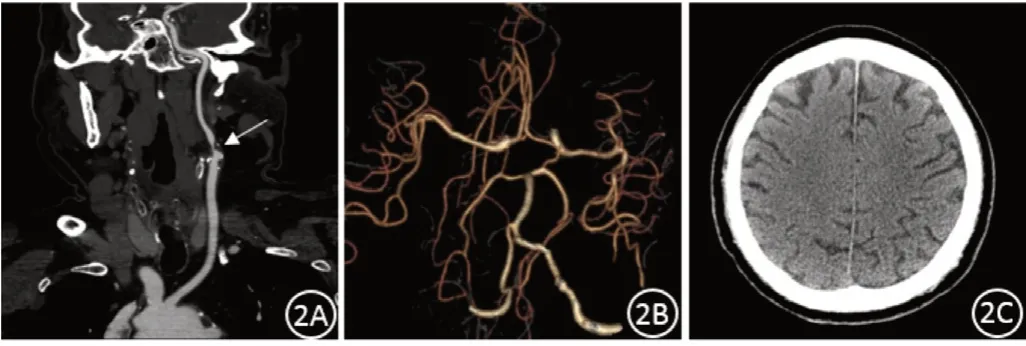
图2 单侧颈内动脉重度狭窄,Willis环完整,未见脑梗死
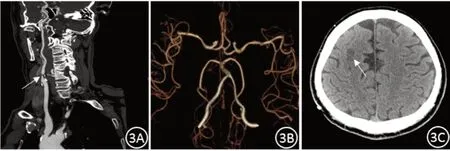
图3 单侧颈内动脉重度狭窄,Willis前循环完整,腔隙性脑梗死
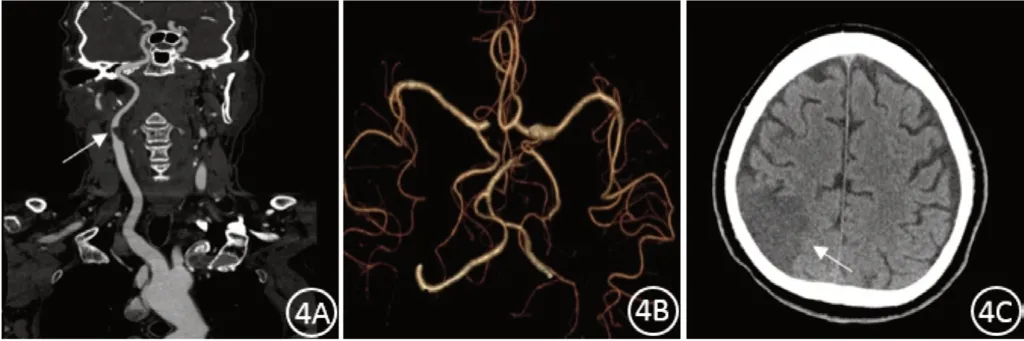
图4 单侧颈内动脉重度狭窄,Willis环不完整,大面积脑梗死
3 讨论
颈内动脉粥样硬化性狭窄是缺血性脑卒中发生的关键因素,随着颈动脉狭窄程度的加重,脑卒中的发病率增加。当颈内动脉狭窄超过70%,患者脑卒中的发生率增加10%~18%[8]。颈内动脉重度狭窄患者是否出现脑梗死、脑梗死范围的大小主要与侧支代偿有关。颅内侧支循环主要包括Willis环、眼动脉侧支、一级软脑膜侧支及新生血管,其中Willis环是最重要的侧支循环[9]。目前已有TCD、CTA、MRA、DSA等多种影像检查用于诊断头颈动脉病变,与其他影像方法相比,CTA具有无创、快速、空间分辨率高、检查费用相对较低等优点,可以多角度、多平面对血管进行观察,而且与DSA的一致性较高[10],已经成为评估侧支循环的重要手段,临床应用广泛。
Willis环变异广泛存在,文献报道,完整型Willis环的比率为4.6%~72.2%[11],这种差异考虑与研究人群、检查方法及样本选择的不同有关。本研究83例患者中,Willis环完整者共15例,占18.1%,与陈立芳等[12]报道结果相仿。本研究症状组I型Willis环仅占4.5%,无症状组Ⅰ型Willis环占34.2%,症状组完整型Willis环比率明显低于无症状组。症状性颈内动脉狭窄患者Willis环的不完整性与缺血性卒中风险增加相关[4]。文献报道[13],与具有完整型Willis环者相比,Willis环任何部分存在变异者缺血性脑卒中的发病率增高1.4倍。在颈内动脉重度狭窄情况下,患者脑内动脉灌注压明显下降,血流动力学发生异常,初级侧支循环系统最先通过Willis环将血流立即分流到缺血区域,增加缺血区脑血流量,减少脑梗死。Willis环作为一级侧支循环,其代偿能力与组成血管的完整性有关。Willis环完整者使血流重新分配,维持一定的脑血流量,防止脑组织缺血,但当Willis环发生变异,其侧支代偿能力降低,无法实现脑血流再分配,从而诱发了脑缺血性病变。本研究中,症状组Willis变异率明显高于无症状组,前、后循环变异率均高于无症状组。说明Willis环变异是颈内动脉重度狭窄患者发生缺血性脑梗死的重要原因。
本研究统计了颈内动脉重度狭窄患者Willis环组成血管变异情况,包括A1段、P1段、ACoA及PCoA。症状组患者A1段变异率明显高于无症状组,前循环完整比例低于无症状组,提示前循环发育不完整患者更易发生缺血性脑梗死。单侧颈内动脉发生严重狭窄时,主要启动前循环进行侧支代偿[14],如果前循环和后循环都不完整,则前循环卒中风险更高[15]。前交通动脉连接两侧大脑前动脉A1,作为前循环的侧支通路。当一侧大脑前动脉A1段缺如或发育不良,对侧颈内动脉无法通过前交通动脉发挥代偿作用,导致脑供血不足,脑梗死的发生率增高。
本文局限性如下:①本研究基于CTA评估颈内动脉狭窄患者Willis侧支循环,缺乏DSA参考;②样本量相对较小,无法避免入组偏倚。
综上所述,颈内动脉重度狭窄患者是否出现脑缺血症状与Willis环变异关系密切。完整型Willis环侧支循环丰富,对缺血性脑梗死能够起到一定保护作用;Willis环发生变异时,侧支代偿能力降低,易发生脑梗死。因此,对于颈内动脉狭窄伴Willis环变异患者,应尽早进行治疗,降低缺血性脑血管病的发病风险,提高临床预后。
