双能量CT虚拟单能量成像在鉴别脊柱良恶性压缩性骨折中应用价值⋆
2022-12-19徐驰杰孔玲玲赵承勇邓小毅
徐驰杰 孔玲玲 赵承勇邓小毅,* 孙 旭 朱 斌
1.江苏大学附属澳洋医院影像科(江苏 张家港 215600)
2.南京大学附属鼓楼医院脊椎外科(江苏 南京 210008)
3.南京大学附属鼓楼医院影像科(江苏 南京 210008)
脊柱溶骨型转移瘤肿瘤细胞浸润骨髓,椎体正常结构被肿瘤组织取代,导致椎体塌陷形成脊柱恶性压缩性骨折,而脊柱良性压缩性骨折常由于骨质疏松或外伤引起骨小梁断裂、血管损伤而导致压缩性骨折,椎体内骨髓成分一般正常。当患者原发肿瘤或外伤等病史不详的情况下,两者在传统影像学表现上存在一定重叠,容易造成“异病同影”现象[1]。临床实践中,对于急性良恶性压缩性骨折的早期诊断仍存在一定困难,多依靠结合患者临床资料、CT或MRI才能进行鉴别诊断。常规CT能显示病变椎体形态学特征,但形态学特征的类似并不能反映两者真实本质,其对于椎体内细微骨质改变、骨髓情况及椎体内理化成分均不能很好地评估。
相较于常规CT,双能量CT能够在获得病灶椎体形态学特征的同时更好地区分椎体内异常组织成分。它能在一次扫描检查中提供高、低不同能量数据并将单参数成像转变为多参数成像[2-4],通过虚拟单能量下CT值、单能量曲线及斜率对物质进行定量及定性综合分析,从而为疾病的诊断评估提供新的理论依据,帮助放射科医生提高诊断准确性。既往文献已报道[5-7],双能量CT可以通过多参数定量分析提高良恶性肿瘤的诊断准确性且帮助鉴别诊断。目前,利用双能量CT虚拟单能量成像鉴别脊柱良恶性压缩性骨折相关报道仍较少。本研究拟通过对51例脊柱压缩性骨折患者的双能量CT图像数据进行定性及定量综合分析,探讨双能量CT虚拟单能量成像在脊柱良恶性压缩性骨折中的鉴别诊断价值。
1 资料与方法
1.1 一般资料经我院伦理委员会批准,所有患者均签署了知情同意书。收集我院2018年3月至2019年8月期间60例脊柱压缩性骨折患者进行双能量CT脊柱扫描。
纳入标准:经手术、病理穿刺活检或临床随访确诊的脊柱良恶性压缩骨折患者;患者能顺利完成双能量CT脊柱扫描;患者均未接受影响骨骼代谢或抗肿瘤药物治疗。排除标准:脊柱原发肿瘤、脊柱结核或其他骨骼代谢性疾病患者;严重脊柱压缩骨折(高度小于4mm)或接受手术治疗的患者;脊柱成骨型转移瘤患者。经我院伦理委员会批准,所有患者签署知情同意书。排除5例严重压缩性骨折患者、3例脊柱成骨型转移瘤患者、1例已接受手术患者。
最终纳入51例患者,男性21例,女性30例,年龄31~87岁,平均年龄61.3±12.2岁。所有患者均由手术、病例穿刺活检或临床随访最终证实。其中脊柱良性压缩性骨折患者30例,包括创伤压缩性骨折18例、骨质疏松性压缩性骨折12例;脊柱溶骨型转移瘤所致恶性压缩性骨折患者21例,包括肺癌6例、肝癌3例、乳腺癌3例、前列腺癌2例、结肠癌1例、阴囊癌1例、胰腺癌1例、肾癌1例、颌下肌上皮癌1例、颈部低分化癌1例、原发灶不明1例。
1.2 检查方法采用西门子双源计算机断层扫描CT扫描仪(Somatom Definition Flash dual-source CT)。A球管管电压:100KV,有效电流:250mAs;B球管管电压:140KV,有效电流:483mAs;实时自动毫安秒技术。准直器宽度40×0.6mm,螺距1.2,球管旋转时间0.5s/周。自动重建层厚0.75mm,重建间隔0.5mm。
1.3 图像分析将图像数据调入“Syngovia”工作站,选择“Monoenergetic”进行虚拟单能量图像重建。由一名高年资放射科医师(从事骨骼肌肉放射学诊断工作10年以上)对所有压缩性骨折椎体进行CT值测量并绘制单能量曲线。测量时以椎体病灶中心最大层面作为感兴趣区(region of interest,ROI),避开碎骨片、明显钙化及坏死区。ROI选取面积为0.5cm²。本研究选择获取两组病灶在虚拟单能量40Kev~120Kev(间隔为20Kev)下对应的CT值、虚拟单能量曲线斜率,即选择40Kev、60Kev、80Kev、100Kev、120Kev能级下的测得值。虚拟单能量曲线斜率(本研究选取40Kev~100Kev作曲线斜率计算点),即斜率K=CT值(40Kev)-CT值(100Kev)/60[6]。
1.4 统计学分析利用SPSS 19.0软件进行统计学分析。虚拟单能量下CT值及单能量曲线斜率用均值±标准差(±s)表示,作独立样本t检验分析脊柱溶骨型转移瘤所致恶性压缩性骨折与良性压缩性骨折CT值之间差异性。检验水准取α=0.05,P<0.05为差异存在统计学意义。作受试者工作特征(receiver operating characteristic,ROC)曲线计算曲线下面积(area under curve,AUC)及相应敏感性、特异性,评价虚拟单能量成像对脊柱良恶性压缩性骨折的鉴别诊断效能。
2 结 果
51例患者共计87个脊柱压缩性骨折椎体被纳入分析,其中脊柱溶骨型转移瘤所致压缩性骨折椎体50个、脊柱良性压缩性骨折椎体37个。
2.1 虚拟单能量曲线形态及斜率分析脊柱溶骨型转移瘤所致恶性压缩性骨折与良性压缩性骨折虚拟单能量曲线斜率均随着Kev值的增加而减低(见图1-3)。脊柱良、恶性压缩性骨折虚拟单能量曲线斜率(K)分别为3.8±1.6、1.9±1.8,两者差异存在显著统计学差异(P<0.001),见表1。ROC曲线显示,虚拟单能量曲线斜率K=2.20时测得AUC值最高(0.792),相应敏感性、特异性分别为89%、34%(见图5、表2)。
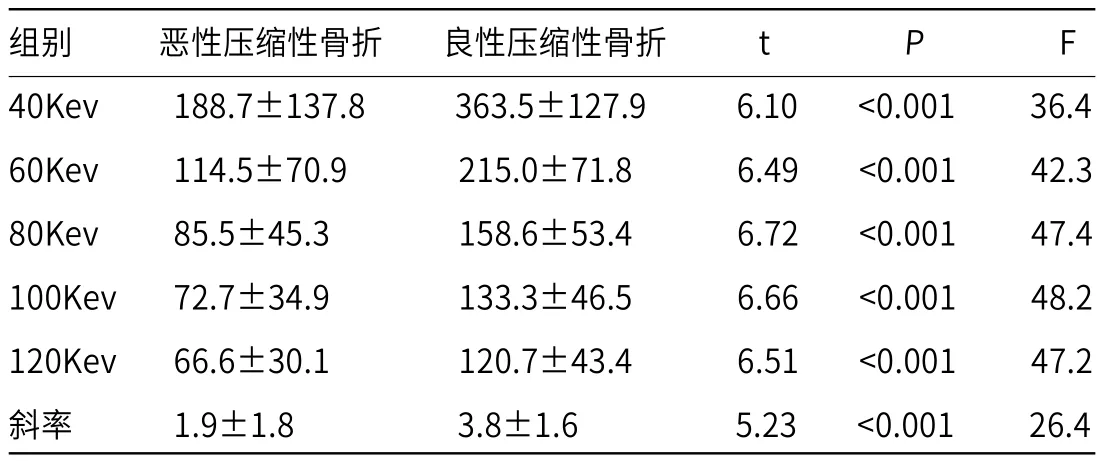
表1 脊柱溶骨型转移瘤所致恶性压缩性骨折与良性压缩性骨折在虚拟单能量下CT值及单能量曲线斜率差异性分析
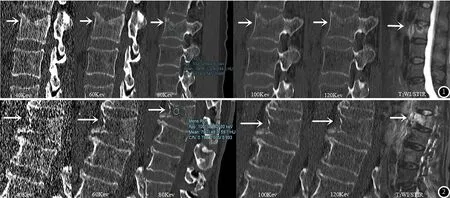
图1 腰2椎体急性压缩性骨折。女性,64岁,腰背部疼痛不适。L2椎体在虚拟单能量不同能级下(40Kev、60Kev、80Kev、100Kev、120Kev)显示图;MRI T2WI/STIR序列显示L2椎体急性压缩性骨折。图2 腰1椎体溶骨型转移瘤。男性,76岁,原发性肝癌。L1椎体在虚拟单能量不同能级下(40、60、80、100、120Kev)显示图;MRI T2WI/STIR序列显示L1椎体溶骨型转移瘤。
2.2 虚拟单能量不同能级下CT值分析脊柱溶骨型转移瘤所致恶性压缩性骨折与良性压缩性骨折虚拟单能量CT值均随着Kev值的增加而减低(见图4),且在同一能级下脊柱恶性压缩性骨折CT值均低于良性压缩性骨折,差异有显著统计学差异(P<0.001),见表2。ROC曲线显示,虚拟单能量在120Kev时测得AUC值最高(0.882),相应敏感性、特异性分别为95%、76%(见图5、表2)。
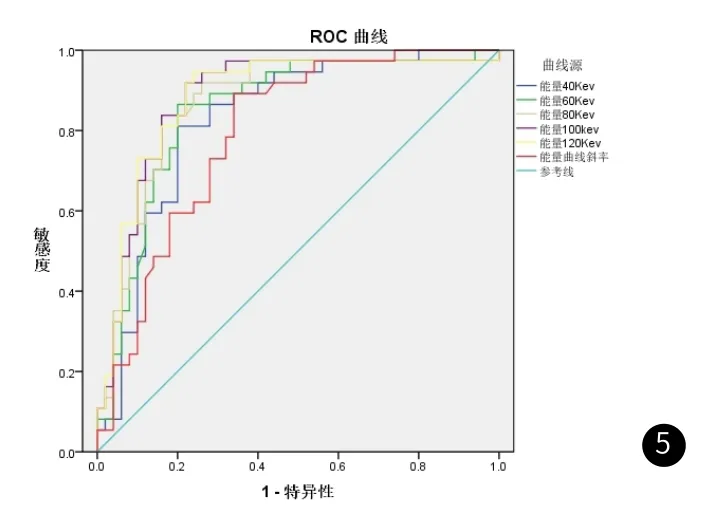
图5 虚拟单能量不同能级鉴别诊断脊柱溶骨型转移瘤所致恶性压缩性骨折与良性压缩性骨折的ROC曲线。
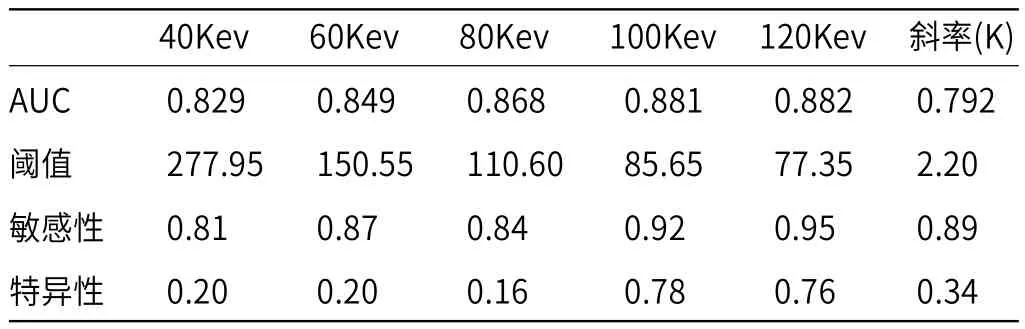
表2 ROC曲线鉴别脊柱溶骨型转移瘤所致恶性压缩性骨折与良性压缩性骨折的AUC、阈值及相应敏感性、特异性
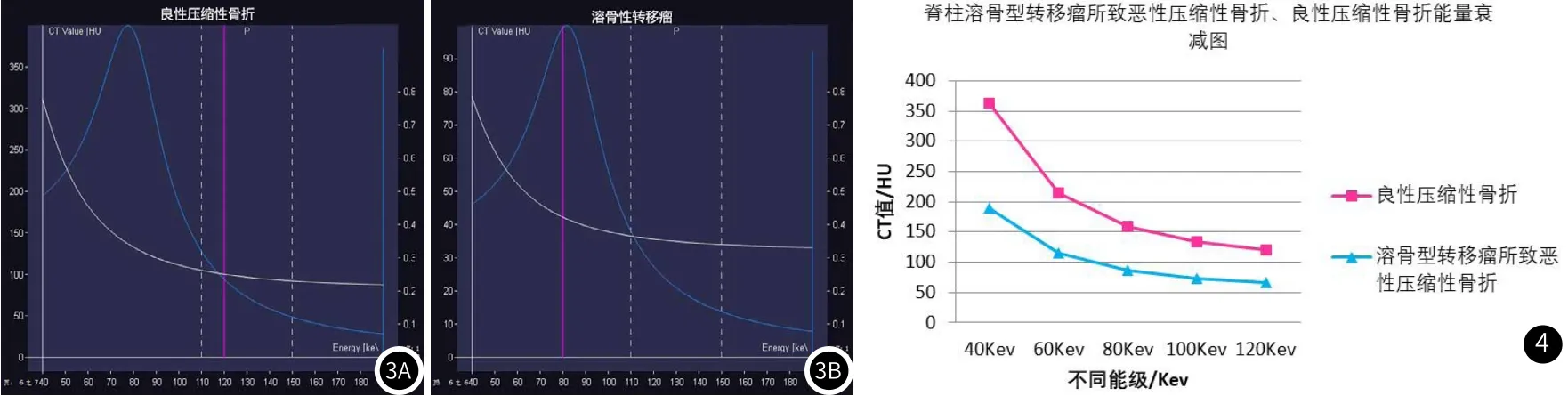
图3 虚拟单能量曲线示意图。图3A:L2椎体良性压缩性骨折的虚拟单能量曲线;图3B:L1椎体溶骨型转移瘤所致恶性压缩性骨折的虚拟单能量曲线。图4 脊柱溶骨型转移瘤所致恶性压缩性骨折与良性压缩性骨折的能量衰减图。
3 讨 论
双能量CT在骨骼肌肉影像学诊断中的应用越来越广泛,既往多篇文献报道其在优化图像质量、减少射束硬化伪影及辐射剂量方面的具有独特优势[8-11]。最新研究发现,双能量CT作为功能成像在肿瘤良恶性鉴别中亦具有较好的应用价值。相较于常规CT,双能量CT能在显示形态学特征的同时通过虚拟单能量下CT值、单能量曲线形态及斜率进行多参数定量分析,提高了病变的检出率且帮助鉴别病变良恶性。Yue D[12]等对35例肺癌患者成骨型转移瘤进行回顾性分析,证实了双能量CT能提高不明显成骨型转移瘤的检出率。Zheng S[13]等对102例患者110个椎体低密度病灶进行回顾性分析,发现双能量CT对溶骨型转移瘤及许莫氏结节的鉴别诊断具有较高的准确性。
双能量CT能利用不同物质对X线能量衰减程度不同进行虚拟单能量成像,绘制不同物质特征性能量曲线从而对不同组织成分进行定量分析及组织成分鉴别。本研究发现,在40Kev~120kev范围内,脊柱溶骨型转移瘤所致恶性压缩性骨折与良性压缩性骨折的单能量曲线斜率均随着Kev值的增加而降低,脊柱良性压缩性骨折斜率明显高于脊柱恶性压缩性骨折且低能量区间内脊柱良性压缩性骨折的虚拟单能量曲线坡度更为陡直,衰减程度更大。当斜率阈值K=2.20时,双能量CT对脊柱良恶性压缩性骨折的鉴别诊断敏感性为89%。与能谱技术原理相一致,我们的研究结果与先前研究[14-16]相一致,同样证明了不同物质对应不同组织成分且都具有自己独特的虚拟单能量曲线特征。在双能量CT成像虚拟单能量图像上,虚拟单能量曲线形态趋向接近或重合往往提示物质组织成分相似,利用虚拟单能量曲线形态及斜率进行分析,可以帮助放射科医师更好地对脊柱良恶性压缩性骨折进行鉴别诊断。
此外,CT值反应物质材料密度之间的差异性,脊柱良恶性压缩性骨折在双能量CT虚拟单能量下物质CT值亦显示不同物质之间密度特征。本研究显示虚拟单能量不同能级下CT值显示脊柱溶骨型转移瘤所致恶性压缩性骨折在不同单能级上CT值均低于与良性压缩性骨折,ROC曲线显示在120Kev能级时对两者的鉴别诊断效能最优。上述研究结果与Dong Y[17]等研究相一致。在120Kev单能级图像,以CT值等于77.35HU作为脊柱良恶性压缩性骨折阈值时,相应敏感性、特异性分别为95%、76%。我们认为,这是由于脊柱良恶性压缩性骨折发病机制不同可引起病灶椎体内组织成分不同所导致。脊柱溶骨型转移瘤所致恶性压缩性骨折主要侵犯骨髓,正常骨组织被肿瘤组织替代,血管通透性增加,导致椎体内骨含量降低、含水量增加,而脊柱良性压缩性骨折主要引起椎体骨小梁中断、血管损伤,导致椎体内含水量增加而骨含量并未降低。
本研究存在以下局限性:第一、纳入研究病例样本数较少,需要更大样本量和多中心研究进一步证实;第二、脊柱溶骨型转移瘤所致压缩性骨折患者中部分病例仍缺乏病理证实[18],主要通过影像或临床随访确诊;第三、不同病理类型肿瘤导致的脊柱恶性压缩性骨折、外伤或骨质疏松导致的脊柱良性压缩性骨折未进一步分类研究。
综上所述,双能量CT虚拟单能量成像显示脊柱良恶性压缩性骨折在虚拟单能量不同能级下CT值及单能量曲线斜率之间存在显著差异。双能量CT能够在显示常规CT形态学特征的同时提供更全面的信息,帮助放射科医生更好地鉴别脊柱良恶性压缩性骨折,为两者的鉴别评估提供新的辅助手段及影像依据。
