缺氧环境下miR-143-5p/HIF-1α信号轴调控人牙髓干细胞促血管生成潜能的机制研究
2022-12-19孟紫君庞彩凤刘春萍黄春艳陈文霞
孟紫君,何 璇,庞彩凤,刘春萍,黄春艳,陈文霞
牙髓是高度血管化的组织,被坚硬的无让性牙本质包围,血管、神经、淋巴管仅通过狭窄的根尖孔与根尖周组织相连,这种独特的解剖结构使牙髓在受到损伤后易发生缺血缺氧甚至感染坏死[1]。传统的根管治疗会导致牙齿变脆,增加根折的风险。人牙髓干细胞是一类具有高度自我更新和多向分化潜能的干细胞,能够再生受损的细胞和牙髓-牙本质复合体,基于干细胞移植的组织工程技术是牙髓疾病理想的治疗方式[2]。组织工程技术的成功依赖于良好血管网络的建立,这对维持牙髓组织的活力和功能至关重要。而如何提高干细胞的血管生成潜能,以有效再生功能性牙髓组织是临床上尚未解决的难题。有研究表明,缺氧环境能够提高干细胞的促血管生成潜能,主要是通过上调缺氧诱导因子-1α(HIF-1α),从而激活HIF-1α/血管内皮生长因子(VEGF)途径来调节VEGF的表达和分泌[3],但具体的转录后调控机制尚未明确。miRNA是一类长度为17~24个核苷酸的单链非编码RNA,通过和靶基因mRNA碱基配对引导沉默复合体降解mRNA或阻碍其翻译过程,从而调节基因表达[4]。miR-143-5p作为干细胞功能和分化的重要调节因子,参与调控干细胞向牙本质分化和缺氧环境下的血管生成[5-6]。基因数据库分析和双荧光素酶报告实验表明,HIF-1α为miR-143-5p靶基因之一[7],但低氧环境下miR-143-5p对人牙髓干细胞促血管生成潜能的调控作用尚不清楚。本研究以人牙髓干细胞作为体外实验对象,观察miR-143-5p对氯化钴诱导化学缺氧人牙髓干细胞生物学活性和促血管生成潜能的影响,并探讨miR-143-5p/HIF-1α信号轴在其中的作用。
1 材料和方法
1.1主要试剂和仪器 胎牛血清、DMEM高糖培养基、胰蛋白酶(Gibco,美国);青霉素链霉素混合液(索莱宝,中国);氯化钴六水合物(Sigma,美国);过表达miR-143-5p慢病毒(miR-143-5p mimics)载体、过表达阴性对照(mimics-NC)载体、沉默miR-143-5p慢病毒(miR-143-5p inhibitor)载体、沉默阴性对照(inhibitor-NC)载体(吉凯基因,中国);PCR试剂盒(Takara,中国);鼠抗人β-actin单克隆抗体、兔抗人HIF-1α多克隆抗体(Elabscience,中国);山羊抗鼠二抗、山羊抗兔二抗(Invitrogen,美国);CCK-8试剂盒(Dojindo,中国);BCA试剂盒(碧云天,中国);ELISA试剂盒(Elabscience,中国)。
1.2实验方法
1.2.1人牙髓干细胞体外分离与培养:采用组织块培养法培养人牙髓干细胞。经广西医科大学伦理委员会批准,临床收集15~25岁因正畸需要拔除的健康前磨牙,受试者及家属均知情同意。在无菌环境下劈开牙齿,取出牙髓组织。用眼科剪将牙髓剪成约1 mm×1 mm×1 mm大小的组织块,均匀的铺在培养瓶底部,然后加入高糖DMEM培养基(含20%胎牛血清,1%青链霉素),置于37 ℃、5% CO2饱和湿度条件下培养。每3 d换液1次,至细胞生长至80%融合时用0.25%胰酶消化,以1∶3传代。取生长状态良好的第3~5代人牙髓干细胞用于后续实验。
1.2.2流式细胞仪检测人牙髓干细胞表面标志物:人牙髓干细胞生长至80%~90%融合后,用胰蛋白酶消化,PBS洗涤3次后,将细胞浓度调整为3×106/ml;两支流式样品管各取100 μl的细胞悬液,在阳性管内依次加入20 μl的CD45、CD29、CD34、CD90抗体,阴性管内加入80 μl的PBS溶液,冰上避光孵育30 min。PBS洗脱未结合的抗体,上流式细胞仪检测。
1.2.3氯化钴构建体外细胞化学缺氧模型:配制含不同浓度氯化钴的DMEM培养液处理人牙髓干细胞24 h或48 h,根据氯化钴终末浓度将实验组分为50、100、200 μmol/L组,对照组氯化钴终末浓度为0 μmol/L。利用氯化钴的化学特性,模拟体外细胞缺氧环境。
1.2.4CCK-8法检测人牙髓干细胞增殖能力:将人牙髓干细胞以3000个每孔接种于96孔板中,待细胞贴壁后,弃上清,根据上述分组加入100 μl含不同浓度氯化钴的培养液,分别培养24 h和48 h。向各孔中加入10 μl的CCK-8溶液,在培养箱中继续孵育2 h。酶标仪检测各组在450 nm处的吸光度值。
1.2.5Transwell小室实验检测人牙髓干细胞迁移能力:取生长状态良好的人牙髓干细胞,胰蛋白酶消化后,用无血清DMEM培养液重悬细胞,往上室每孔加入200 μl(1×105/ml)单细胞悬液,根据上述分组在下室加入700 μl含不同浓度氯化钴的完全培养基,37 ℃、5% CO2培养箱中培养24 h。取出Transwell小室,4%多聚甲醛室温下固定20 min。用棉签擦去小室微孔膜上层细胞,0.1%结晶紫染色30 min。双蒸水漂洗,显微镜下观察并记录迁移细胞数量。
1.2.6人牙髓干细胞miR-143-5p及血管生成相关基因mRNA表达水平检测:Trizol法提取细胞总RNA,检测总RNA的纯度和浓度。使用逆转录试剂盒将提取的总RNA逆转录为cDNA。以cDNA为模板进行实时荧光定量PCR(qRT-PCR)扩增反应。miR-143-5p内参为U6,HIF-1α、VEGF内参为β-actin。采用2-ΔΔCt法分析目的基因表达情况。引物序列见表1。
1.2.7Western Blot检测氯化钴对人牙髓干细胞表达HIF-1α的影响:将细胞充分裂解,提取总蛋白。BCA法测定蛋白浓度后,SDS-PAGE电泳分离,将蛋白转移至PVDF膜,封闭液封闭15 min,TBST洗涤5次,每次5 min。加入一抗HIF-1α(1∶1000)、β-actin(1∶2000)在4 ℃条件下孵育过夜,TBST洗涤5次。分别加入山羊抗兔(1∶5000)和山羊抗鼠二抗溶液(1∶10000)室温下孵育1 h;洗膜,ECL显色,暗室曝光。ImageJ分析蛋白条带灰度值。
1.2.8ELISA检测氯化钴对人牙髓干细胞表达VEGF的影响:实验组和对照组人牙髓干细胞分别培养24 h和48 h后,取上清液,用ELISA试剂盒检测培养上清液中VEGF的浓度。ELISA检测方法严格按照试剂盒说明书的操作步骤进行。
1.2.9构建慢病毒载体过表达或沉默人牙髓干细胞miR-143-5p:将人牙髓干细胞接种于6孔板中,待细胞生长至30%~50%融合时,按照吉凯基因慢病毒转染操作说明书分别转染miR-143-5p mimics、mimics-NC、miR-143-5p inhibitor、inhibitor-NC载体至人牙髓干细胞。12 h后更换新鲜培养基,置于37 ℃、5% CO2培养箱中继续培养72 h。倒置荧光显微镜观察慢病毒载体转染效率,qRT-PCR检测人牙髓干细胞miR-143-5p与成血管生成相关基因mRNA表达水平。
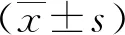
2 结果
2.1人牙髓干细胞的分离培养 倒置显微镜下观察,原代培养3~7 d后人牙髓干细胞从组织块边缘爬出,呈长梭形、纺锤样形态,有少量细胞突起。见图1a。14~20 d后人牙髓干细胞基本长满瓶底,以胰蛋白酶消化传代。传代的细胞密度显著增加,表现为集落样克隆增长,呈放射状或旋涡状排列。见图1b。

表1 miR-143-5p及血管生成相关基因引物序列
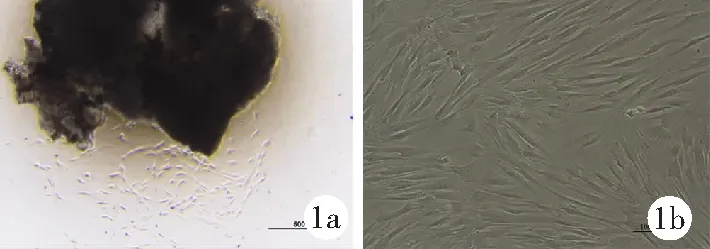
图1 人牙髓干细胞的原代培养
1a.人牙髓干细胞原代培养第5天(×40);1b.第3代人牙髓干细胞(×100)
2.2人牙髓干细胞表面标志物鉴定 流式细胞仪检测培养细胞的表面标志物,其中CD29(100.00%)和CD90(98.50%)呈阳性表达;造血干细胞表面标志物CD34(0.43%)和CD45(0.15%)呈阴性表达;符合间充质干细胞的表面抗原特征,表明培养的细胞为人牙髓干细胞。见图2。

图2 流式细胞术检测人牙髓干细胞表面标志物
2.3不同浓度氯化钴处理对人牙髓干细胞增殖能力的影响 CCK-8细胞增殖实验结果显示,在培养24 h和48 h后,50 μmol/L组和100 μmol/L组细胞增殖活性明显高于对照组(P<0.01)。200 μmol/L组与对照组比较差异无统计学意义(P>0.05)。见图3。
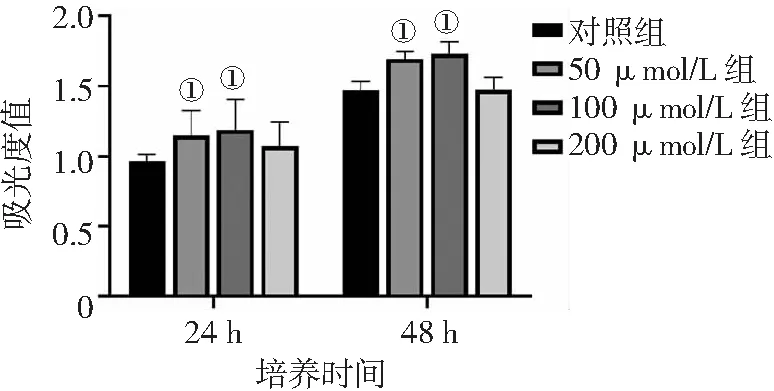
图3 不同浓度氯化钴对人牙髓干细胞增殖的影响
2.4不同浓度氯化钴处理对人牙髓干细胞迁移能力的影响 Transwell小室实验检测细胞迁移结果显示,50 μmol/L组、100 μmol/L组和200 μmol/L组细胞迁移能力均高于对照组,且100 μmol/L组和200 μmol/L组高于50 μmol/L组(P<0.01)。见图4。
图4 不同浓度氯化钴对人牙髓干细胞迁移能力的影响(×100)
2.5miR-143-5p及HIF-1α、VEGF mRNA在缺氧诱导人牙髓干细胞的表达 qRT-PCR检测结果显示,在缺氧环境下培养48 h后,50 μmol/L组、100 μmol/L组和200 μmol/L组miR-143-5p表达量较对照组明显降低,并随氯化钴浓度的升高而降低(P<0.01)。相反,50 μmol/L组、100 μmol/L组和200 μmol/L组HIF-1α mRNA表达水平较对照组显著升高,且200 μmol/L组较100 μmol/L组显著升高(P<0.01)。100 μmol/L组和200 μmol/L组VEGF mRNA表达水平较对照组明显升高(P<0.05)。见图5。
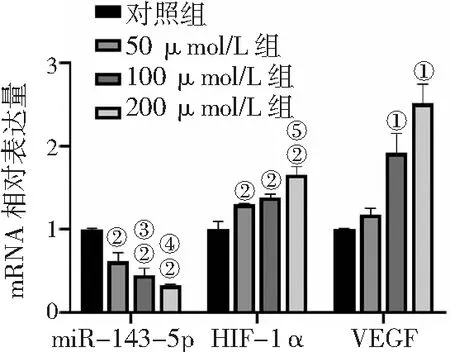
图5 不同浓度氯化钴处理对人牙髓干细胞miR-143-5p及成血管生成相关基因表达的影响
2.6不同浓度氯化钴处理对人牙髓干细胞HIF-1α、VEGF蛋白表达的影响 在氯化钴诱导48 h后,人牙髓干细胞中HIF-1α蛋白水平随氯化钴浓度的增加逐渐升高,100 μmol/L组和200 μmol/L组HIF-1α蛋白表达水平较对照组明显升高(P<0.01)。见图6a、6b。ELISA检测结果显示,培养24 h和48 h后,100 μmol/L组和200 μmol/L组细胞培养上清液中VEGF水平显著高于对照组(P<0.05,P<0.01),并随时间的延长和氯化钴浓度的增加而增加。见图6c。

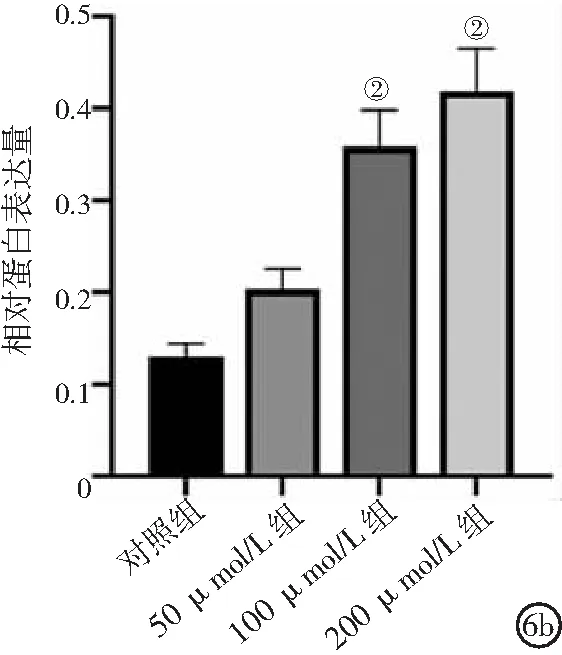
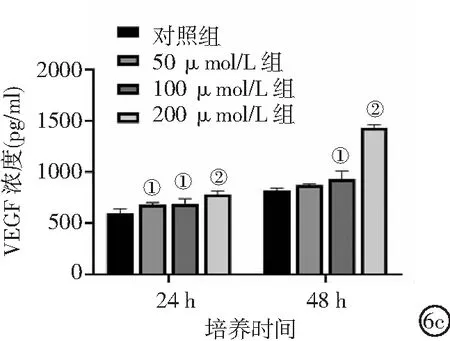
图6 不同浓度氯化钴处理对人牙髓干细胞HIF-1α、VEGF蛋白表达水平的影响
2.7miR-143-5p对人牙髓干细胞HIF-1α、VEGF mRNA表达的影响 用慢病毒载体过表达或沉默人牙髓干细胞中miR-143-5p,并检测HIF-1α、VEGF mRNA水平。荧光显微镜观察与qRT-PCR结果显示,转染miR-143-5p mimics人牙髓干细胞miR-143-5p表达较转染mimics-NC明显升高(P<0.01),表明慢病毒载体介导的miR-143-5p转染有较高的转染效率。与转染mimics-NC比较,转染miR-143-5p mimics人牙髓干细胞HIF-1α、VEGF mRNA表达水平明显降低(P<0.05,P<0.01);与转染inhibitor-NC比较,转染miR-143-5p inhibitor人牙髓干细胞HIF-1α和VEGF mRNA表达水平明显升高(P<0.01)。表明miR-143-5p能够负向调控HIF-1α/VEGF水平,促进人牙髓干细胞的旁分泌血管生成活性。见图7。
3 讨论
由于牙髓腔解剖结构的特殊性,缺氧是牙髓内常见的环境应激因素,由生物或机械刺激引起的牙髓炎症可使组织间液压力增加导致细胞缺氧[8]。研究表明,缺氧可以诱发牙源性干细胞增殖、血管生成和矿化等反应[9-11]。氯化钴作为一种化学物质,其中的二价钴离子能够有效抑制细胞内HIF-1α的降解,被广泛应用于细胞缺氧模型的研究[12]。本实验研究结果发现,在氯化钴诱导的化学缺氧环境下,50 μmol/L和100 μmol/L的氯化钴能够促进人牙髓干细胞的增殖,而50 μmol/L、100 μmol/L与200 μmol/L的氯化钴能使细胞迁移能力明显增强,表明适宜的缺氧刺激能够显著提高人牙髓干细胞的生物学活性,这对于干细胞迁移到损伤部位参与牙髓组织修复再生具有重要意义。
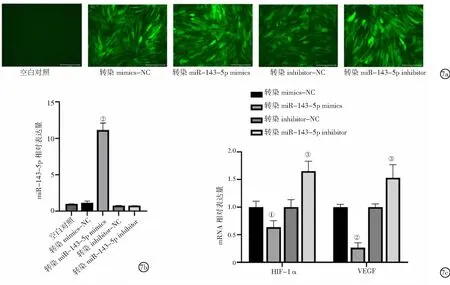
图7 miR-143-5p在缺氧环境下对人牙髓干细胞HIF-1α、VEGF mRNA表达的影响
缺氧被认为是刺激牙髓内血管生成的重要因素。细胞在缺氧时能够适应缺氧环境并触发血管生成反应,与细胞内升高的HIF-1α表达相关[13]。HIF-1α是细胞适应缺氧的关键蛋白质转录调节因子,在常氧条件下HIF-1α被脯氨酸羟化酶羟基化,进一步通过泛素化途径降解;缺氧状态下脯氨酸羟化酶被抑制,使HIF-1α累积,进入细胞核后启动并参与细胞代谢、红细胞生成和血管生成(如VEGF)等下游基因的转录,共同调节细胞对缺氧的适应性反应[14]。本研究结果发现,随着氯化钴浓度的增加,HIF-1α和VEGF mRNA与蛋白表达水平逐渐升高,特别是在200 μmol/L氯化钴缺氧诱导条件下,二者的表达与对照组比较差异更加显著。众所周知VEGF是最重要的促血管生成活性生长因子,能有效诱导内皮细胞增殖、迁移、存活及分化为新生血管[15]。证实了缺氧环境下人牙髓干细胞的旁分泌促血管生成活性显著增强。
miRNA是一类内生的、高度保守的小分子非编码RNA,具有细胞和组织特异性,在调控基因表达、细胞周期、生物体发育时序等方面起重要作用。此外,miRNA还参与了干细胞生物学过程,涉及细胞周期、干性维持和分化调节[16]。而miR-143-5p由于能够调控数百个基因表达而受到广泛关注。研究表明,miR-143-5p参与调控干细胞向内皮分化和通过旁分泌作用的方式促进内皮细胞血管生成,如长链非编码RNA TUG1通过调节miR-143/FGF1轴促进脂肪来源干细胞的内皮分化[17];GENG等[18]研究发现,心肌梗死患者冠状动脉血清来源的外泌体能通过miRNA-143/IGF-IR途径促进人脐静脉内皮细胞血管生成。此外,miR-143-5p通过负向调控靶基因HIF-1α表达水平促进肿瘤的血管生成,从而加快肿瘤的侵袭和转移[7]。但缺氧环境下人牙髓干细胞是否表达miR-143-5p,以及miR-143-5p是否通过HIF-1α/VEGF轴调节缺氧环境下人牙髓干细胞的促血管生成潜能尚不清楚。
本研究首先通过qRT-PCR证实了miR-143-5p在缺氧环境下人牙髓干细胞中表达下调,说明缺氧能够引起miR-143-5p表达的变化。然后探讨缺氧环境下人牙髓干细胞中miR-143-5p是否通过调控HIF-1α表达水平促进了细胞的旁分泌促血管生成活性。本研究发现,缺氧环境下miR-143-5p随氯化钴浓度的增加其表达逐渐下调,而HIF-1α、VEGF mRNA表达水平则在氯化钴诱导后逐渐增高,二者呈反向变化关系。进一步慢病毒载体转染实验结果显示,过表达miR-143-5p能显著降低人牙髓干细胞中HIF-1α和VEGF mRNA表达水平,而抑制人牙髓干细胞miR-143-5p的表达后,HIF-1α和VEGF mRNA表达则明显升高。表明缺氧环境下miR-143-5p通过负向调控HIF-1α mRNA的表达来促进人牙髓干细胞分泌VEGF的能力,从而提高缺氧环境下人牙髓干细胞的促血管生成潜能。
综上所述,氯化钴诱导的缺氧环境促进了人牙髓干细胞的增殖、迁移和促血管生成潜能等生物学特性,而miR-143-5p/HIF-1α信号轴可能参与了缺氧环境下对人牙髓干细胞旁分泌促血管生成活性的调节。本实验为缺氧环境下人牙髓干细胞促血管生成潜能的分子机制相关研究提供了参考,但详细机制尚需通过进一步体外内皮细胞血管形成实验和体内动物实验来验证。
