NLR家族Pyrin域蛋白3炎症小体对糖尿病大鼠牙槽骨缺损愈合的作用及其机制研究
2022-12-17郑毅赵彤
郑毅,赵彤
(1.天津医科大学口腔医院 牙体牙髓科,天津 300070;2.天津医科大学第二医院口腔科,天津 300021)
牙槽骨缺损是指上下颌骨边缘镶嵌牙根处因牙周炎、创伤或肿瘤等因素导致该处骨组织受损。牙槽骨受损严重时,牙周组织支持力量减弱,牙齿松动甚至脱落,因此牙槽骨缺损的修复对口腔疾病患者至关重要。临床上无机材料、复合材料和自体牙骨移植材料常被用来修复牙槽骨缺损[1]。廖武堂[2]研究结构显示,Bio-Oss 骨粉结合猪小肠黏膜下层也可促进牙槽骨组织的再生,有效修复牙槽骨缺损。但很多牙槽骨缺损患者同时合并糖尿病,在高糖环境下,骨代谢紊乱[3],牙槽骨缺损难以愈合,因此糖尿病患者的牙槽骨缺损修复是口腔科面临的难点之一。目前,尚未有针对糖尿病患者牙槽骨缺损修复的有效方法。
NLR家族Pyrin域蛋白3(NOD-like receptor 3,NLRP3)在糖尿病病程中扮演着重要角色。既往研究显示,抑制NLRP3 炎症小体可以加速糖尿病模型小鼠足部溃疡伤口的愈合[4],但目前暂未见研究报道NLRP3 炎症小体的活性与糖尿病大鼠牙槽骨缺损愈合的关系。因此本实验探究抑制NLRP3 炎症小体糖尿病大鼠牙槽骨缺损愈合情况,以期为临床寻找治疗方案提供理论基础。
1 材料与方法
1.1 材料
1.1.1 实验动物4 月龄健康SD 雄性大鼠30只,体重(220±20)g,购自上海斯莱克实验动物有限责任公司,实验动物生产许可证号:SCXK(沪)2017-0005,实验动物使用许可证号:SYXK(沪)2019-0003。适应性饲养3 d,正常饮食、饮水。
1.1.2 主要试剂链脲佐菌素(上海源叶生物科技有限公司),NLRP3、Caspase-1、白细胞介素1β(Interleukin,IL-1β)、β-actin 兔抗大鼠一抗、HPR 标记羊抗兔IgG 二抗(美国Abcam 公司),护骨因子(osteoprotegerin,OPG)酶联免疫吸附试验(enzyme linked immunosorbent assay,ELISA)试剂盒、碱性磷酸酶(alkaline phosphatase,ALP)ELISA 试剂盒(上海瑞番生物科技有限公司),抗酒石酸酸性磷酸酶(tartrate resistant acid phosphatase,TARP)染色试剂盒(上海一研生物科技有限公司),Hifair®V nCov Multiplex One Step RT-qPCR Probe Kit试剂盒、Trieasy™Total RNA Extraction Reagent TRIeasy™总RNA 提取试剂盒(上海翌圣生物科技有限公司),NLRP3 炎症小体抑制剂(YQ128)、动物组织蛋白抽提试剂盒(北京百奥莱博科技有限公司),高糖饲料(上海锐赛生物技术有限公司)。
1.1.3 主要仪器血糖仪BGM501(上海寰熙医疗器械有限公司),多样品组织研磨仪CEBO-24(上海测博生物科技发展中心),全自动酶标仪318C+(上海沛欧分析仪器有限公司),Qubit 荧光定量仪、SimpliAmp PCR 仪(美国赛默飞世尔科技有限公司),80i 显微镜(日本Nikon 公司),一体式凝胶成像系统WD-9413D、转印电泳仪DYCZ-40K(北京六一生物科技有限公司)。
1.2 方法
1.2.1 糖尿病模型大鼠的复制高糖饲料饲养4 周后,大鼠腹腔注射0.1 mmol/L 柠檬酸-柠檬酸钠稀释的链脲佐菌素60 mg/kg。72 h 后用一次性测血糖针刺破大鼠尾尖取血(测量前12 h 禁食),用血糖仪检测血糖,血糖≥16.7 mmol/L 为糖尿病模型复制成功[5]。
将复制成功的糖尿病模型大鼠用2%戊巴比妥钠腹腔注射麻醉,仰卧固定在手术台上,分离口腔上颌两侧第一磨牙腭侧的牙龈与粘骨膜,用球钻缓慢由近中向远中磨除部分牙槽骨骨质,形成大小约2.0 mm×2.0 mm×1.0mm 的缺口,磨除的同时注意用生理盐水冲洗冷却,缝合牙龈。
<1),且各件产品是否为不合格品相互独立.
1.2.2 实验分组及给药将30 只大鼠随机分为对照组、模型组、炎症小体抑制组,每组10 只。模型复制成功后,炎症小体抑制组大鼠立即尾静脉注射20 mg/kg NLRP3 抑制剂(YQ128),1 次/d,连续给药28 d。对照组和模型组大鼠尾静脉注射等体积生理盐水,1 次/d,连续注射28 d。
1.2.3 空腹血糖检测给药结束后大鼠禁食12 h,用一次性测血糖针刺大鼠尾部取血,血糖仪测量各组大鼠空腹血糖。
1.2.4 骨代谢指标检测测量血糖后,大鼠尾静脉采血,1 000 r/min 离心10 min,取上清液采用ELISA检测OPG 和ALP 含量,严格按照试剂盒说明书进行操作,用酶标仪读数,将光密度值代入标准曲线计算相应孔位浓度。
1.2.5 牙槽骨缺损区苏木精-伊红(hematoxylineosin,HE)染色及Lane-Sandhu 评分采血后,处死各组大鼠,取左侧上颌骨复制缺损处的骨组织于多聚甲醛中固定24 h,然后置于100 g/L 乙二胺四乙酸溶液中脱钙处理10周,每2 天换脱钙液1 次。脱钙后取出骨组织,常规脱水,石蜡包埋,蜡块切片约4 μm厚,进行HE 染色,显微镜下观察牙槽骨愈合情况。根据Lane-Sandhu 评分标准[6]评价再生情况,包括:①骨形成。无骨形成计0分,骨形成占骨缺损>0%~25%计1分,骨形成占骨缺损>25%~50%计2分,骨形成占骨缺损>50%~75%计3分,骨形成占骨缺损>75%~100%计4 分。②骨连接。骨折线清晰计0分,骨折线部分存在计1分,骨折线消失计2 分。③骨塑形。未见塑形计0分,髓腔形成计为2分,皮质骨形成计4 分。
1.2.6 TARP 染色观察破骨细胞数参照WU等[7]检测方法,取1.2.5 中石蜡切片,加入蒸馏水水化脱蜡,采用TARP 染色试剂盒染色,盖好盖玻片,放入烘箱内烘干,用显微镜观察破骨细胞,每张切片随机选取6 个视野进行破骨细胞计数(不规则长条形,胞浆呈红色),计算平均值。
1.2.7 实时荧光定量聚合酶链反应(quantitative realtime polymerase chain reaction,qRT-PCR)检测NLRP3、Caspase-1、IL-1β mRNA的表达取大鼠右侧上颌骨复制缺损处的骨组织,剔除牙周软组织后放入盛有液氮的研钵中,研磨成粉末,取100 mg粉末于离心管中,加入裂解液,室温下裂解5 min后离心,严格按照试剂盒说明书进行操作。取5 μL提取好的mRNA,按照试剂盒添加其余组分,加无菌无酶水补至30 μL,放入qRT-PCR 仪中。50℃、10min将mRNA逆转录为cDNA,PCR 反应条件:95℃预变性5 min,95℃变性15 s,60℃退火30s,共45 个循环。β-actin 作为内参,根据Ct 值计算2-ΔΔCt。引物设计见表1。

表1 qRT-PCR引物序列
1.2.8 Western blotting 检测NLRP3、Caspase-1、IL-1β 蛋白的表达取1.2.7 中研磨好的骨组织粉末,在冰上加入蛋白提取试剂盒中的裂解液,于涡旋仪上混匀后离心,按照试剂盒说明书进行操作,采用BCA 法测定蛋白浓度,SDS-PAGE 进行凝胶电泳,电泳结束后,浸泡于转膜液中将蛋白转移到PVDF 转膜纸上,放入3%脱脂奶粉封闭液中封闭1 h,加入一抗室温下孵育过夜,洗膜,加入二抗孵育1 h,在凝胶成像系统中曝光观察,以β-actin 作为内参计算灰度值。
1.3 统计学方法
数据分析采用SPSS 21.00 统计软件。计量资料以均数±标准差()表示,比较用方差分析,进一步两两比较用LSD-t检验。P<0.05 为差异有统计学意义。
2 结果
2.1 各组大鼠空腹血糖的比较
对照组、模型组、炎症小体抑制组大鼠空腹血糖分别为(5.27±1.08)mmol/L、(18.74±4.17)mmol/L 和(18.08±3.98)mmol/L,经方差分析,差异有统计学意义(F=5.008,P=0.014),与对照组比较,模型组与炎症小体抑制组空腹血糖均上升(P<0.05)。
2.2 各组大鼠骨代谢指标比较
对照组、模型组、炎症小体抑制组大鼠OPG、ALP 比较,经方差分析,差异有统计学意义(F=4.278和1.202,P=0.024 和0.316),模型组OPG、ALP 低于对照组和炎症小体抑制组(P<0.05)。见表2。
表2 各组大鼠OPG和ALP含量比较(n=10,)
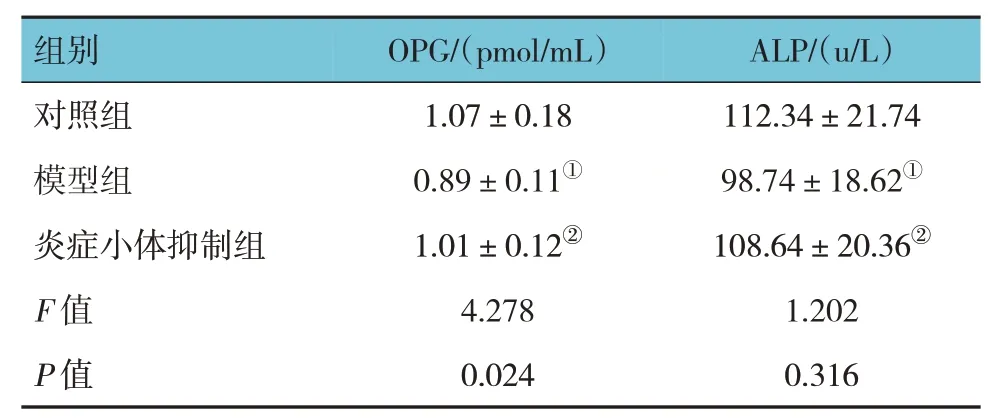
表2 各组大鼠OPG和ALP含量比较(n=10,)
注:①与对照组比较,P <0.05;②与模型组比较,P <0.05。
2.3 各组大鼠牙槽骨HE 染色及Lane-Sandhu 评分比较
HE 染色结果显示,模型组大鼠牙槽骨缺损严重,可见大量炎症浸润细胞,炎症小体抑制组牙槽骨缺损程度低,炎症浸润细胞较少。见图1。
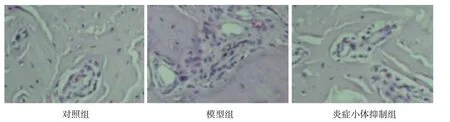
图1 各组大鼠上颌骨组织(HE染色×400)
对照组、模型组、炎症小体抑制组大鼠Lane-Sandhu 评分分别为(6.45±0.97)分、(3.98±0.61)分和(5.02±0.85)分,经方差分析,差异有统计学意义(F=22.666,P=0.000),模型组Lane-Sandhu 评分低于对照组和炎症小体抑制组(P<0.05)。
2.4 各组大鼠破骨细胞数比较
TARP 染色结果显示,对照组、模型组、炎症小体抑制组大鼠破骨细胞数分别为(1.01±0.03)个/HP、(11.24±2.21)个/HP 和(8.01±1.68)个/HP,经方差分析,差异有统计学意义(F=106.447,P=0.000),模型组破骨细胞数高于对照组和炎症小体抑制组(P<0.05)。见图2。
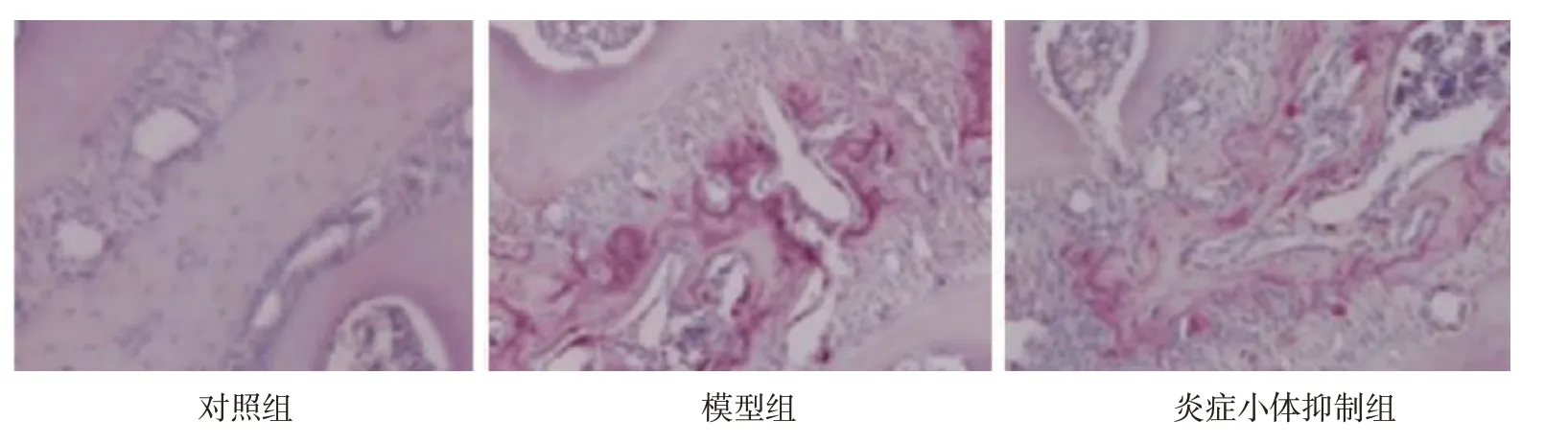
图2 各组大鼠上颌骨组织(TARP染色×200)
2.5 各组大鼠上颌骨组织NLRP3、Caspase-1、IL-1β mRNA相对表达量比较
对照组、模型组、炎症小体抑制组大鼠上颌骨组织NLRP3、Caspase-1、IL-1β mRNA 相对表达量比较,经方差分析,差异均有统计学意义(F=13.175、18.414 和23.672,P=0.001、0.000 和0.000),模型组大鼠上颌骨组织NLRP3、Caspase-1、IL-1β mRNA 相对表达量高于对照组和炎症小体抑制组(P<0.05)。见表3。
表3 各组大鼠上颌骨组织NLRP3、Caspase-1、IL-1β mRNA相对表达量比较(n=10,)

表3 各组大鼠上颌骨组织NLRP3、Caspase-1、IL-1β mRNA相对表达量比较(n=10,)
注:①与对照组比较,P <0.05;②与模型组比较,P <0.05。
2.6 各组大鼠上颌骨组织NLRP3、Caspase-1、IL-1β蛋白相对表达量比较
对照组、模型组、炎症小体抑制组大鼠上颌骨组织NLRP3、Caspase-1、IL-1β 蛋白相对表达量比较,经方差分析,差异有统计学意义(F=14.121、12.333 和10.932,P=0.001、0.000 和0.002),模型组大鼠上颌骨组织NLRP3、Caspase-1、IL-1β 蛋白相对表达量高于对照组和炎症小体抑制组(P<0.05)。见表4和图3。
表4 各组大鼠上颌骨组织NLRP3、Caspase-1、IL-1β蛋白相对表达量比较(n=10,)
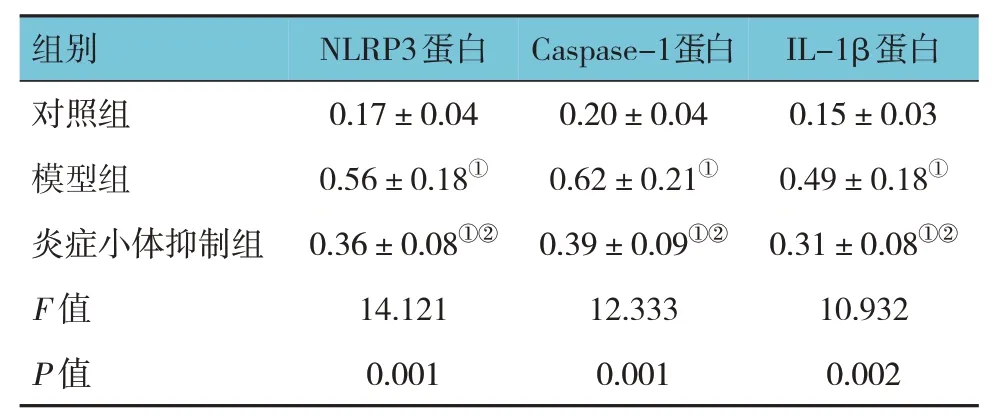
表4 各组大鼠上颌骨组织NLRP3、Caspase-1、IL-1β蛋白相对表达量比较(n=10,)
注:①与对照组比较,P <0.05;②与模型组比较,P <0.05。

图3 各组大鼠上颌骨组织NLRP3、Caspase-1、IL-1β蛋白的表达
3 讨论
牙槽骨位于上下颌骨边缘处镶嵌牙龈的位置,是上下颌骨的牙槽突出部分。一般情况下,随着年龄的增长及牙齿的不断咀嚼挤压会导致牙槽骨不断吸收,高度下降;另外,在牙周炎等一些病理或外力的作用下,也会导致牙槽骨的缺损[8]。纳米羟基磷灰石、类骨质羟磷灰石等材料已经广泛应用于人工修复牙槽骨缺损中[9]。但临床治疗中发现,牙槽骨缺损糖尿病患者接受治疗后,高血糖导致骨愈合缓慢甚至出现不愈合,造成人工修复失败,患者面临失牙风险。有研究显示,炎症因子在糖尿病大鼠骨折愈合中发挥重要作用[10],NLRP3 炎症小体是各种炎症反应的重要部分[11],因此探究抑制NLRP3 炎症小体对糖尿病大鼠牙槽骨缺损愈合的影响具有重要的临床意义。
牙槽骨缺损愈合过程也就是局部骨重建的过程,即破骨细胞释放酸液溶解旧骨,成骨细胞分泌骨胶原形成新骨,两种作用保持动态的平衡[12],但糖尿病会引起患者机体骨代谢紊乱[13],破骨细胞被激活,成骨细胞受到抑制,导致骨愈合受阻,牙槽骨缺损难以愈合。OPG 和ALP 是典型的骨形成标志[14-15],OPG 又被称为破骨细胞分化因子。有研究显示,抑制OPG 的活性会降低破骨细胞的分化程度[16]。ALP 则广泛分布在机体各个组织中,成骨细胞的增殖分化会分泌ALP。本研究结果显示,NLRP3 炎症小体抑制组大鼠血清OPG 与ALP 出现不同程度的升高,说明抑制NLRP3 炎症小体可以促进成骨细胞的增殖与分化,抑制破骨细胞活性。通过HE 染色发现,模型组大鼠牙槽骨缺损严重,且炎症浸润细胞较多,但NLRP3 炎症小体抑制组牙槽骨缺损程度降低,并且炎症浸润细胞较少。并且与模型组比较,炎症小体抑制组骨再生Lane-Sandhu 评分升高,提示该组骨形成程度较高。TARP 特异性地分布在破骨细胞中,因此TARP 染色是检测骨组织中破骨细胞的常见方法,染色后破骨细胞呈红色。本研究结果表明,相比模型组,炎症小体抑制组破骨细胞数减少。既往研究显示,激活NLRP3 炎症小体活性后,关节组织中的破骨细胞数量上升[17]。
炎症参与糖尿病病程,并且影响骨代谢过程。李石岩等[18]研究发现,抑制NLRP3 活性可以促进骨缺损的修复。NOD样受体(NOD-like receptor,NLRs)参与机体固有免疫,NLRP3 是NLRs 的主要成员之一,在糖尿病状态下其表达上调。NLRP3 可以识别刺激信号并活化形成NLRP3 炎症小体。NLRP炎症小体会进一步刺激下游Caspase-1,活化的Caspase-1 刺激pro-IL-1β,形成炎症因子IL-1β。本研究结果显示,与对照组相比,模型组NLRP3、Caspase-1、IL-1β mRNA 和蛋白相对表达量升高,NLRP3 炎症小体被抑制后,NLRP3、Caspase-1、IL-1β mRNA 和蛋白相对表达量降低。
因此,抑制NLRP3 炎症小体可以抑制NLRP3/IL-1β 通路活化,促进成骨细胞的增殖与分化,抑制破骨细胞活性,从而促进糖尿病大鼠牙槽骨缺损的愈合。
