低聚原花青素通过介导Wnt/β-catenin信号通路对糖尿病肾病大鼠肾功能的保护作用研究*
2022-12-17高利超甘林望耿磊刘建吴蔚桦欧三桃
高利超,甘林望,耿磊,刘建,吴蔚桦,欧三桃
(西南医科大学附属医院 肾病内科,四川 泸州 646000)
随着我国生活水平提高,糖尿病发病率越来越高。糖尿病肾病(diabetic nephropathy,DN)是糖尿病最常见的并发症,DN 最终可发展为终末期肾病,导致不良预后[1-2]。积极防治DN,抑制病情进展,是避免肾衰竭,延长患者生命的主要手段。氧化应激是DN 致病机制中的重要部分,低聚原花青素是天然的抗氧化剂,具有降糖降脂、调节免疫的作用。刘尚军等[3]研究表明,原花青素能有效减轻自发性高血压大鼠肾纤维化程度,发挥肾保护功效。
近年来研究证实,Wnt 信号通路参与急性肾损伤、肾脏肿瘤等多种肾脏病变,并通过调节肾小球固有细胞的增殖与凋亡,参与肾脏疾病的发生、发展,与DN 也存在密切联系[4-6]。为研究低聚原花青素治疗DN 的具体作用机制,探究其是否能通过Wnt/β-catenin 信号通路发挥肾脏保护功效,西南医科大学附属医院开展如下研究。
1 材料与方法
1.1 实验动物
60 只SD 雄性大鼠购自上海海利生物技术股份有限公司,体重300~320 g。大鼠自由饮食、饮水,在25℃、湿度50%的环境中喂养,12 h 昼/夜循环照明。实验动物生产许可证号:SCXK(沪)2021-0005,实验动物使用许可证号:SYXK(川)2021-0014。
1.2 主要试剂与仪器
低聚原花青素(西安通泽生物科技有限公司),链脲佐菌素(美国Sigma公司),SOD、MDA检测试剂盒(南京建成生物工程研究所),SABC 免疫组织化学试剂盒(武汉博士德生物工程有限公司),兔抗鼠Wnt4多克隆抗体、兔抗鼠β-catenin 多克隆抗体(北京博奥森生物技术有限公司),TRIzol 试剂(上海生工生物工程股份有限公司),光学显微镜及全自动生化分析仪(日本Olympus 公司),One Touch Ⅱ型血糖仪(美国强生公司),PCR扩增仪(杭州领航基因科技有限公司),-80℃冰箱(美国Thermo Scientific forma公司),低温高速离心机(美国Bckman公司)。
1.3 分组及处理
1.3.1 实验分组选择60 只SD 雄性大鼠随机分为正常对照组(NC 组)、DN 模型组(DN 组)、DN 模型+低剂量低聚原花青素组(低剂量组)、DN 模型+中剂量低聚原花青素组(中剂量组)、DN 模型+高剂量低聚原花青素组(高剂量组),每组12只。
1.3.2 处理方法①采用单次腹腔注射链脲佐菌素复制DN 模型,具体操作:将链脲佐菌素溶解于pH 4.5 柠檬酸钠,按照55 mg/kg 的比例,腹腔注射复制DN 模型。24 h 后采集大鼠尾静脉血,血糖仪监测血糖,若血糖>16.7 mmol/L则模型复制成功。②模型复制成功后,低、中、高剂量组分别给予50 mg/kg、100 mg/kg、150 mg/kg 低聚原花青素灌胃,NC 组和DN 组给予等体积蒸馏水灌胃。连续灌胃16 周。
1.4 留取标本
分别于实验4周、8周、12周、16周末收集大鼠24 h尿量,检测24 h尿蛋白定量。16周末大鼠行腹腔麻醉,取4 mL血液,用于检测血糖、血清肌酐(serum creatinine,Scr)、血尿素氮(blood urea nitrogen,BUN)。
固定大鼠,打开胸腔,充分暴露心脏,将注射器插入左心室,连接输液器,使PBS 溶液顺利进入心脏,用眼科剪在右心耳处剪一个小口,使血液流出,持续输入PBS液,待肾脏变白后取出左肾,去除包膜,用滤纸擦拭干,称取重量,计算肾重指数(肾脏重量/体重),取出部分肾组织,按照组织块重量与预冷匀浆体积比1∶9,冰水浴制成10%组织匀浆,2 000 r/min 离心15min,收集上清液用于检测肾组织内超氧化物歧化酶(superoxide dismutase,SOD)活性、丙二醛(Malondialdehyde,MDA)含量。取出部分肾脏组织固定于10% 甲醛,待行病理检查、Westernblotting及实时荧光定量聚合酶链反应(quantitative real-time polymerase chain reaction,qRT-PCR)。
1.5 指标检测
1.5.1 24 h 尿蛋白定量采用双缩脲法检测24 h尿蛋白定量。
1.5.2 血糖、Scr、BUN水平采用全自动生化分析仪检测血糖、Scr、BUN 水平。
1.5.3 肾组织SOD活性及MDA含量采用黄嘌呤氧化酶法检测SOD活性,硫代巴比妥酸法检测MDA含量。
1.5.4 苏木精-伊红(hematoxylin-eosin,HE)及过碘酸希夫(periodic acid-Schiff,PAS)染色观察肾组织病理形态①用10%中性甲醛固定大鼠肾脏组织24 h,将肾组织修剪为2 mm厚的组织块,乙醇脱水,二甲苯透明处理,浸泡后石蜡包埋。②HE 染色:脱蜡至水,经二甲苯处理30 min,100%乙醇、95%乙醇分别处理5 min,苏木精液染色10 min,1%盐酸乙醇处理4 s,1%氨水返蓝,伊红染色3 min,显微镜下观察。③PAS 染色:梯度乙醇脱蜡至水,高碘酸氧化液室温处理20 min,无色品红染色15 min,苏木精染细胞核15 min,1%盐酸乙醇分化数秒,95%乙醇、100%乙醇分别脱水5 min,二甲苯3 次透明。
1.5.5 Western blotting 检测肾组织Wnt4、β-catenin蛋白的表达取部分肾组织,采用玻璃匀浆器制备组织匀浆,通过SDS-PAGE 凝胶电泳对其进行分离,分别加入50 μL 兔抗鼠Wnt4 多克隆抗体(1∶200)、β-catenin 多克隆抗体(1∶100),采用ELC 增强型发光液检测Wnt4、β-catenin 蛋白的表达,以β-actin 为内参,计算各组蛋白相对表达量。
1.5.6 qRT-PCR 检测肾组织Wnt4、β-catenin mRNA 的表达①提取总RNA:取实验大鼠肾组织,加入Trizol 试剂,提取总RNA,取5 μL RNA 溶液,稀释100倍,用紫外分光光度计检测各样品OD值,按照1 个OD260 值相当于40 μg/mL RNA 计算RNA 浓度,总RNA 浓度=OD260 值×40 μg/mL×100,RNA 纯度以A260/280 表示,其值在1.8~2.2 为纯度符合要求。②RNA 逆转录:逆转录体系在冰上完成,取10 μL RNA,随机引物(0.2 μg/mL)1 μl,加去DEPC 水至12 μL,均匀后离心3 s,65℃孵育5 min,冷却30 s,加入5×Buffer 4 μL,3 μL dNTP(10 mmol/L),1 μL RNA 酶抑制剂(20 u/μL),1 μL 逆转录酶(20 u/μL),最后体积为20 μL,混匀离心,25℃孵育10 min,42℃孵育1 h,72℃孵育15 min。③qRT-PCR:以逆转录所得cDNA 为模板,在聚合酶催化下进行PCR扩增,引物设计及合成均由上海生工生物工程技术有限公司完成,引物序列见表1。PCR 反应体系共20 μL,包括FastStat universsl SYYBR green master 10 μL,正反向引物各0.5 μL,CDNA 溶液2.0 μL,DNase/Rnase free ddH2O 7.0 μL。④扩增条件:94℃预变性10 min,94℃变性15 s,60℃延伸1 min,共45 个循环。⑤采用2-ΔΔCt法计算mRNA 相对表达量。

表1 qRT-PCR引物序列
1.6 统计学方法
数据分析采用SPSS 19.0 统计软件。计量资料以均数±标准差()表示,比较用单因素方差分析或重复测量设计的方差分析,进一步两两比较用LSD-t检验。P <0.05 为差异有统计学意义。
2 结果
2.1 各组大鼠血糖、Scr、BUN比较
各组大鼠血糖、Scr 及BUN 水平比较,经方差分析,差异有统计学意义(P<0.05)。进一步两两比较结果:DN 组血糖、Scr、BUN 水平较NC 组升高(P<0.05);低、中、高剂量组血糖、Scr、BUN水平较DN 组下降(P<0.05)。见表1。
表2 各组大鼠血糖、Scr、BUN比较(n=12,)
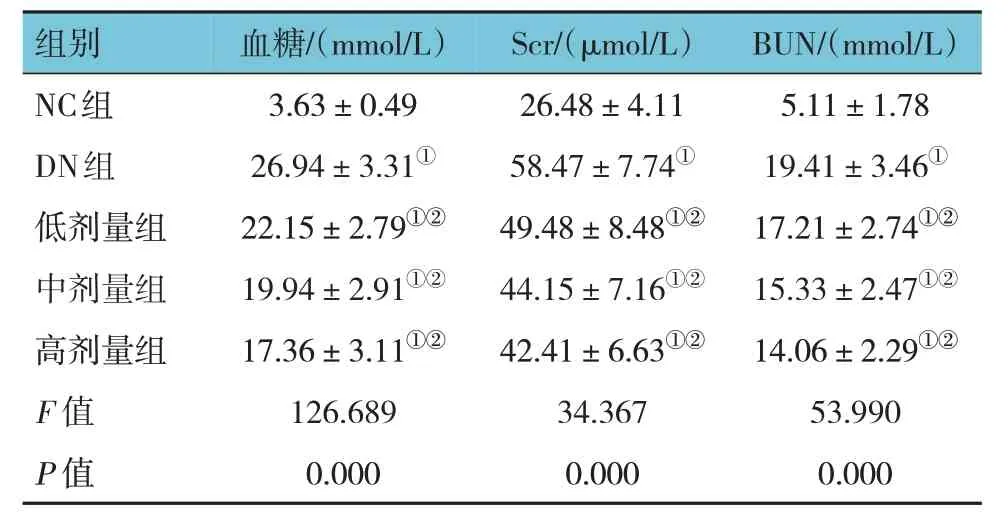
表2 各组大鼠血糖、Scr、BUN比较(n=12,)
注:①与NC组比较,P <0.05;②与DN组比较,P <0.05。
2.2 各组大鼠不同时间点24 h尿蛋白定量的变化
各组大鼠灌胃4 周、8 周、12 周、16 周的24 h尿蛋白定量比较,采用重复测量设计的方差分析,结果:①不同时间点24 h 尿蛋白定量有差异(F=102.38,P=0.000)。②各组24 h 尿蛋白定量有差异(F=86.58,P=0.000)。③各组24 h 尿蛋白定量变化趋势有差异(F=174.64,P=0.000)。见表3。
表3 各组大鼠不同时间点24 h尿蛋白定量比较(n=12,mg/24 h,)
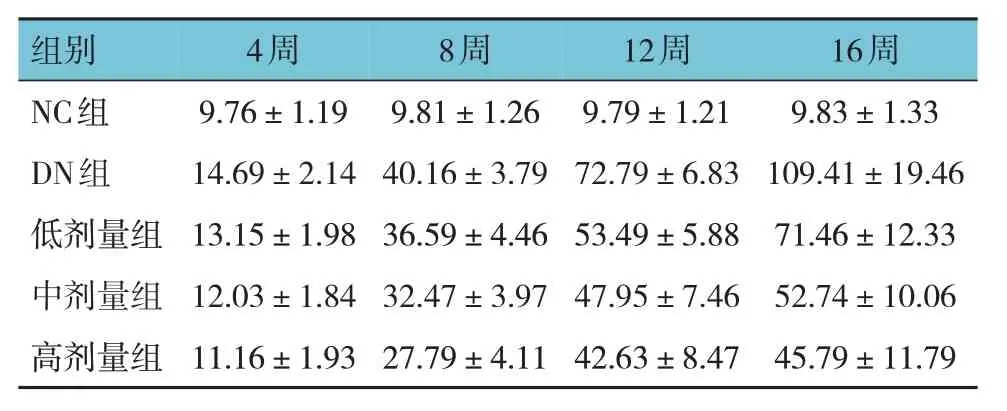
表3 各组大鼠不同时间点24 h尿蛋白定量比较(n=12,mg/24 h,)
2.3 各组大鼠肾组织病理变化
肾切片HE 染色和PAS 染色光镜检查结果显示,NC 组可见正常肾小球及肾小管,肾小管上皮细胞排列整齐。DN 组大鼠肾组织部分肾小管萎缩、小管间质区基质增加,间质内见大量炎症细胞浸润,肾间质纤维化、部分肾小管上皮细胞空泡变性、脱落。低、中、高剂量组以上病理改变均较DN 组减弱,且各剂量组呈剂量依赖性减弱。见图1。
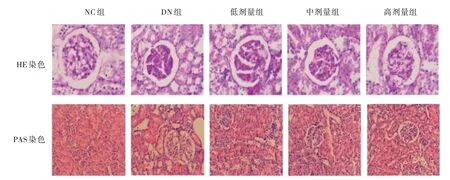
图1 各组大鼠肾组织病理改变(×200)
2.4 各组大鼠左肾指数比较
NC 组、DN 组及低、中、高剂量组左肾指数分别 为(0.22±0.07)、(0.46±0.11)、(0.37±0.09)、(0.33±0.07)、(0.29±0.06),经方差分析,差异有统计学意义(F=14.605,P=0.000)。进一步两两比较结果:DN 组左肾指数较NC 组升高(P<0.05);低、中、高剂量组左肾指数较DN 组降低(P<0.05)。
2.5 各组大鼠肾组织SOD活性及MDA含量比较
各组大鼠SOD 活性比较,经方差分析,差异无统计学意义(P>0.05)。各组大鼠MDA 含量比较,经方差分析,差异有统计学意义(P<0.05)。进一步两两比较结果:与NC 组比较,DN 组MDA 含量升高(P<0.05),与DN 组比较,不同剂量组MDA 含量降低(P<0.05)。见表4。
表4 各组大鼠肾组织SOD活性及MDA含量比较(n=12,)

表4 各组大鼠肾组织SOD活性及MDA含量比较(n=12,)
注:①与NC组比较,P <0.05;②与DN组比较,P <0.05。
2.6 各组大鼠肾组织Wnt4、β-catenin mRNA 和蛋白表达
各组大鼠肾组织Wnt4、β-catenin mRNA 和蛋白相对表达量比较,经方差分析,差异有统计学意义(P<0.05)。进一步两两比较结果:DN 组大鼠肾组织Wnt4、β-catenin mRNA 和蛋白相对表达量高于NC 组(P<0.05),不同剂量组Wnt4、β-catenin mRNA 和蛋白相对表达量低于DN 组(P<0.05)。见 表5 和图2。
表5 各组大鼠肾组织Wnt4、β-catenin mRNA和蛋白相对表达量比较(n=12,)

表5 各组大鼠肾组织Wnt4、β-catenin mRNA和蛋白相对表达量比较(n=12,)
注:①与NC组比较,P <0.05;②与DN组比较,P <0.05。

图2 各组大鼠肾组织Wnt4、β-catenin蛋白的表达
3 讨论
肾脏是糖尿病最常累及的器官,DN 最终将发展为终末期肾病,影响患者预后。低聚原花青素是一种天然抗氧化剂,清除体内自由基的效能远高于维生素C 及维生素E[7-9]。有研究结果表明,原花青素能有效清除机体自由基,减轻心肌缺血再灌注损伤,同时还能抗动脉粥样硬化[8,10]。为研究低聚原花青素治疗DN 的作用,本研究通过复制链脲佐菌素模型DN 大鼠模型,并分别以50 mg/kg、100 mg/kg、150 mg/kg 低聚原花青素对DN 大鼠进行灌胃处理,结果发现,与NC 组比较,DN 组大鼠血糖、Scr、BUN 水平显著上升,而经不同剂量低聚原花青素干预后,以上指标水平均有所下降,且下降趋势呈剂量依赖性。本研究中各组大鼠不同时间点24 h 尿蛋白定量结果表明,NC 组各时间点24 h尿蛋白定量无明显变化,而DN 组大鼠24 h 尿蛋白定量随时间的推移呈上升趋势,且各时间点尿蛋白定量水平均明显高于NC 组。但经各剂量低聚原花青素干预后,DN 模型大鼠各时间点尿蛋白定量均明显下降,且下降幅度呈剂量依赖性。
DN最主要的病理改变有肾小管间质纤维化、肾小球硬化等,本实验中大鼠肾组织切片染色结果提示,DN 组大鼠肾组织内肾小管萎缩、小管间质区基质增生、纤维化等改变明显。而经不同剂量低聚原花青素处理后的大鼠肾组织以上改变均减轻,且减轻程度呈剂量依赖性。检测各组大鼠左肾指数也发现,DN 组肾指数明显升高,提示大鼠肾组织组成成分发生了改变,而经不同剂量低聚原花青素处理后,大鼠左肾指数有所下降,且下降程度呈剂量依赖性。以上研究结果表明,经低聚原花青素处理后,DN大鼠肾组织纤维化、肾小管硬化等病理改变减轻,24 h尿蛋白定量异常在一定程度上得到纠正,说明低聚原花青素能有效改善大鼠DN肾脏结构和临床表现。
SOD 是一类含有金属的氧化还原酶,能催化超氧化物,其活性与机体自由氧清除能力呈正相关,是机体最重要的细胞防御系统[11-13]。MDA 是组织细胞膜脂质过氧化作用的产物之一,能有效反映组织内抗氧化能力[14-15]。本研究检测各组大鼠肾脏组织匀浆上清液SOD 活性及MDA 含量发现,DN 组SOD 活性明显降低,MDA 含量明显上升,提示DN大鼠肾脏组织的抗氧化及自由基清除能力减弱。但经不同浓度低聚原花青素处理后,大鼠SOD 活性增强,MDA 含量下降,说明低聚原花青素能有效增强自由基清除能力,发挥抗氧化功能。
DN 的致病机制复杂,除氧化应激外,Wnt 信号通路也可能通过调节肾小球固有细胞的增殖与凋亡,参与肾脏疾病的发生、发展[16-19]。本研究结果也表明,DN 大鼠肾组织Wnt4、β-catenin mRNA 和蛋白相对表达量较NC 组明显升高,提示DN 大鼠肾组织内Wnt4/β-catenin 信号通路被激活,而经不同浓度低聚原花青素干预后,大鼠肾组织Wnt4、βcatenin mRNA 和蛋白相对表达量降低,提示低聚原花青素可能通过抑制Wnt4/β-catenin 信号通路,抑制DN 病情发展,减轻肾组织病理改变。
综上所述,低聚原花青素能有效降低DN 大鼠24 h 尿蛋白定量,减轻肾脏病理损害。低聚原花青素可能通过抗氧化作用及抑制Wnt4/β-catenin 信号通路,发挥肾脏保护功效,并有望成为DN 的治疗药物。
