佛手蒸制前后对大鼠燥性指标及血液代谢的影响 Δ
2022-12-13聶沁馨张秋霞汪金玉伍沛君贺亚丽林鸿彬广州中医药大学中药学院广州50006广州实验室药物与疫苗研究部广州50005
聶沁馨 ,张秋霞 ,汪金玉 ,伍沛君 ,贺亚丽 ,林鸿彬 (.广州中医药大学中药学院,广州 50006;.广州实验室药物与疫苗研究部,广州 50005)
佛手为芸香科植物佛手Citrus medica L. var. sarco‐dactylis Swingle的干燥果实,具有疏肝理气、和胃止痛、燥湿化痰的功效,用于治疗肝胃气滞、胸胁胀痛、胃脘痞满、食少呕吐、咳嗽痰多等疾病。《本草便读》记载:“佛手,理气快膈,惟肝脾气滞者宜之,阴血不足者,亦嫌其燥耳”[1],明确指出佛手具有燥性。燥是中药的固有性能之一,具有治疗作用与副作用。其治疗作用指用于治疗湿证;其副作用指根据“燥性伤阴”的中医理论,认为燥性干涩,最易伤人津液,临床表现为口干口渴、大便秘结、小便短少等症状[2―3]。在岭南地区,临床使用的佛手饮片多为蒸制后的制佛手,《广东省中药炮制规范》(1984年版)记载佛手的炮制作用为“蒸后降低辛燥之性”[4]。
科属亲缘关系相近的植物,常含有结构类型相似的次生代谢产物。因此,研究佛手的燥性,可考虑通过参照其同科属燥性中药枳壳来开展。枳壳源自芸香科柑橘属植物,现代研究报道枳壳生品具有较强的燥性,会对机体的津液造成一定损伤,研究常选用饮水量、排尿量、肾水通道蛋白3(aquaporin 3,AQP3)含量等作为枳壳的燥性评价指标[5―6]。代谢组学技术在中药炮制相关科研中已有较为广泛的应用,如通过代谢组学研究何首乌“九蒸九晒”炮制后肝毒性降低的机制[7]、揭示柴胡醋制后增强保肝作用的内在原因[8]。研究蒸制对佛手药效的影响,可以先对比考察佛手蒸制前后对机体代谢物的影响,因为机体的许多生命活动,如能量传递、细胞信号释放、细胞间通信等都会受到代谢物的调控。本研究以枳壳为阳性对照,参考枳壳的燥性评价指标,观察佛手不同饮片对大鼠摄食量、饮水量、尿液量、AQP3等燥性指标的影响,以探究佛手致燥的特点;同时,采用代谢组学技术,寻找生、制佛手给药干预后大鼠体内潜在的差异代谢物及代谢通路,以期为佛手蒸制前后药效变化研究提供科学思路。
1 材料
1.1 主要仪器
本研究所用的主要仪器有TGL-16MS型台式高速冷冻离心机(上海卢湘仪离心机仪器有限公司),SB-5200DT型超声波清洗机(宁波新芝生物科技股份有限公司),ACQUITY UPLC Ⅰ-Class型超高效液相色谱仪、VION IMS Q-TOF型高分辨质谱仪(美国Waters公司),UPH型台上式超纯水机(四川优普超纯科技有限公司)。
1.2 主要药品与试剂
生佛手饮片(批号171101)、枳壳饮片(批号170505)均购自广州至信药业股份有限公司,经广州中医药大学中药学院陈康教授鉴定为真品,分别来自芸香科植物佛手C. medica L. var. sarcodactylis Swingle的干燥果实、芸香科植物酸橙Citrus aurantium L.或其栽培变种的干燥未成熟果实。AQP3试剂盒(批号201809)购自大连美仑生物技术有限公司;L-2-氯苯丙氨酸购自上海恒创生物科技有限公司;色谱级甲醇、甲酸、乙腈均购自德国CNW公司。
1.3 动物
本研究所用动物为SPF级SD大鼠,雄性,体质量180~220 g,购自广州中医药大学实验动物中心,动物生产许可证号为SCXK(粤)2013-0034。所有动物均饲养于广州中医药大学(大学城)实验动物中心SPF级动物房,实验动物使用许可证号为SYXK(粤)2013-0085。
2 方法
2.1 制佛手的制备
称取生佛手饮片1 kg,淋润蒸馏水(蒸馏水质量为生佛手饮片质量的20%),隔水蒸制,待圆气后蒸制2.5 h,自然冷却至室温取出,于50 ℃恒温干燥箱烘干,取出,密封保存,备用[4]。
2.2 药液制备
取生佛手饮片50 g,分别以料液比1∶20和1∶15加入蒸馏水煎煮2次,第1次45 min,第2次30 min,合并2次煎煮液,水浴加热浓缩至200 mL,得生佛手药液,分装后冷冻保存。制佛手、枳壳药液的制备方法同上。
2.3 给药与分组
根据2020年版《中国药典》,佛手和枳壳每日最大用量均为10 g,根据人与动物之间药物剂量换算关系,以成人60 kg为标准体质量计算,大鼠每日给药剂量约为1.2 g/kg。佛手性较温和,在前期预实验基础上,本研究将生、制佛手的每日给药剂量均设为正常剂量的2倍(2.4 g/kg),枳壳的每日给药量则为正常剂量(1.2 g/kg)。
将24只大鼠随机分为4组,分别为空白组、生佛手组、制佛手组、枳壳组,每组6只。适应性喂养1周后,给药组大鼠分别灌胃相应药液(相当于生佛手2.4 g/kg、制佛手2.4 g/kg、枳壳1.2 g/kg),空白组大鼠灌胃等体积蒸馏水,连续35 d。每日记录大鼠摄食量、饮水量,分别于给药第0、7、14、21、28、35天记录一次体质量并收集大鼠尿液。至第35天末次给药后麻醉,腹主动脉取血,冷冻离心,取上层血清,保存于-80 ℃备用。
2.4 大鼠血清AQP3的检测
采用ELISA法检测。取“2.3”项下血清样品,以酶标仪于450 nm波长处测定各孔的光密度(OD)值,并计算其中AQP3的含量。操作过程严格按照试剂盒说明书操作。
2.5 代谢组学分析
2.5.1 代谢组学样本制备 取“2.3”项下血清样品,室温下解冻后取100 μL血清,加入10 μL内标(L-2-氯苯丙氨酸,质量浓度为0.3 mg/mL,甲醇配制),涡旋振荡10 s,再加入300 μL的蛋白沉淀剂甲醇-乙腈(2∶1,V/V),涡旋振荡1 min,冰水浴中超声提取10 min,-20 ℃下静置30 min,在4 ℃条件下以13 000 r/min冷冻离心15 min,取上层清液,即得样本提取液。质控样本由所有样本的提取液取适量等体积混合制备而成。
2.5.2 色谱条件 色谱柱采用ACQUITY UPLC BEH C18(100 mm×2.1 mm,1.7 μm);以0.1%甲酸溶液为流动相A,乙腈-甲醇(2∶3,V/V)溶液(含0.1%甲酸)为流动相B进行梯度洗脱(0~1 min,1%B→30%B;1~2.5 min,30%B→60%B;2.5~6.5 min,60%B→90%B;6.5~8.5 min,90%B→100%B;8.5~10.7 min,100%B;10.7~10.8 min,100%B→1%B;10.8~15 min,1%B);流速为0.4 mL/min;柱温为45 ℃;进样量为1 μL。
2.5.3 质谱条件 采用电喷雾离子源在正、负离子模式下进行质谱分析。毛细管电离电压为2.5 kV,进样电压为40 V,碰撞电压为6 eV,离子源温度为115 ℃,氮气温度为450 ℃,氮气流速为900 L/h,质谱扫描范围为m/z 50~1 000 Da。
2.6 数据处理与分析
采用SPSS 20.0软件进行数据统计分析,实验结果满足正态分布时以±s表示,多组间差异比较采用单因素方差分析,组间两两比较采用LSD-t检验(方差齐时)或Dunnett’s T3检验(方差不齐时),检验水准α=0.05。选择大鼠的血清样本采用液相色谱-质谱联用技术进行分析,对检测样本的基峰离子流图进行可视化检查,将所有原始数据经代谢组学处理软件进行预处理,得到保留时间、m/z和峰强度的数据矩阵。将数据矩阵导入SIMCA 14.0软件进行主成分分析(principal component analysis,PCA)和正交偏最小二乘法-判别分析(orthogonal partial least squares-discrimiant analysis,OPLS-DA)。代谢物用 Progenesis QI软件基于 HMDB(http://www.hmdb.ca/)、Lipidmaps(https://www.lipidmaps.org/)公共数据库及自建数据库进行定性。根据P值和代谢物浓度的差异倍数(fold change,FC)筛选差异代谢物,将筛选后的差异代谢物映射到KEGG(https://www.kegg.jp/kegg/pathway.html)数据库进行通路分析。
3 结果
3.1 药物对大鼠体质量、摄食量和饮水量的影响
给药第0~35天,各组大鼠体质量平缓上升,各组之间差异均无统计学意义(P>0.05)。制佛手组大鼠的摄食量、饮水量均具有高于枳壳组和生佛手组的趋势,但差异无统计学意义(P>0.05)。各组大鼠体质量、摄食量和饮水量变化趋势见图1。
3.2 药物对尿液量及血清AQP3含量的影响
给药第7、14天,各组大鼠尿液量差异无统计学意义(P>0.05)。给药第21天,与空白组比较,枳壳组尿液量显著降低(P<0.05);与枳壳组比较,制佛手组尿液量显著升高(P<0.05),且接近空白组。与空白组比较,各给药组血清AQP3含量均有不同程度的升高,枳壳组血清AQP3含量较空白组显著升高(P<0.05);与枳壳组比较,制佛手组血清AQP3含量显著降低(P<0.05),且接近空白组。结果见表1。
表1 各组大鼠尿液量及血清AQP3含量的测定结果(±s,n=6)
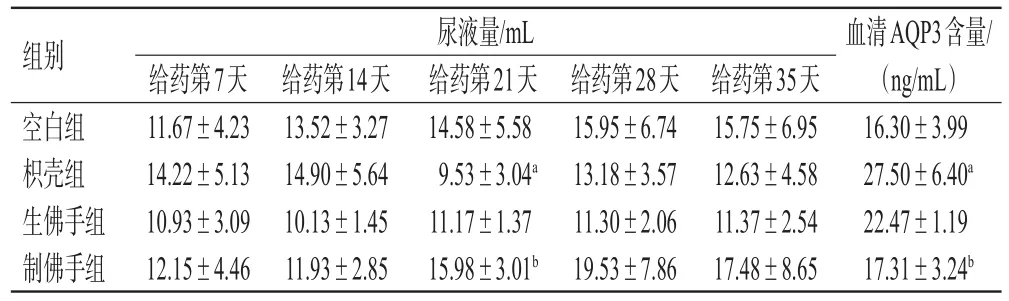
表1 各组大鼠尿液量及血清AQP3含量的测定结果(±s,n=6)
a:与空白组比较,P<0.05;b:与枳壳组比较,P<0.05
组别空白组枳壳组生佛手组制佛手组尿液量/mL给药第7天11.67±4.23 14.22±5.13 10.93±3.09 12.15±4.46给药第14天13.52±3.27 14.90±5.64 10.13±1.45 11.93±2.85给药第21天14.58±5.58 9.53±3.04a 11.17±1.37 15.98±3.01b给药第28天15.95±6.74 13.18±3.57 11.30±2.06 19.53±7.86给药第35天15.75±6.95 12.63±4.58 11.37±2.54 17.48±8.65血清AQP3含量/(ng/mL)16.30±3.99 27.50±6.40a 22.47±1.19 17.31±3.24b
3.3 大鼠血清代谢组学分析
3.3.1 代谢轮廓分析 采用液相色谱-质谱联用技术对样本进行代谢组学分析,采集正、负离子模式下质控样本的总离子流图,结果见图2。由图2可知,样品中代谢物在较短时间内能被很好地分离。
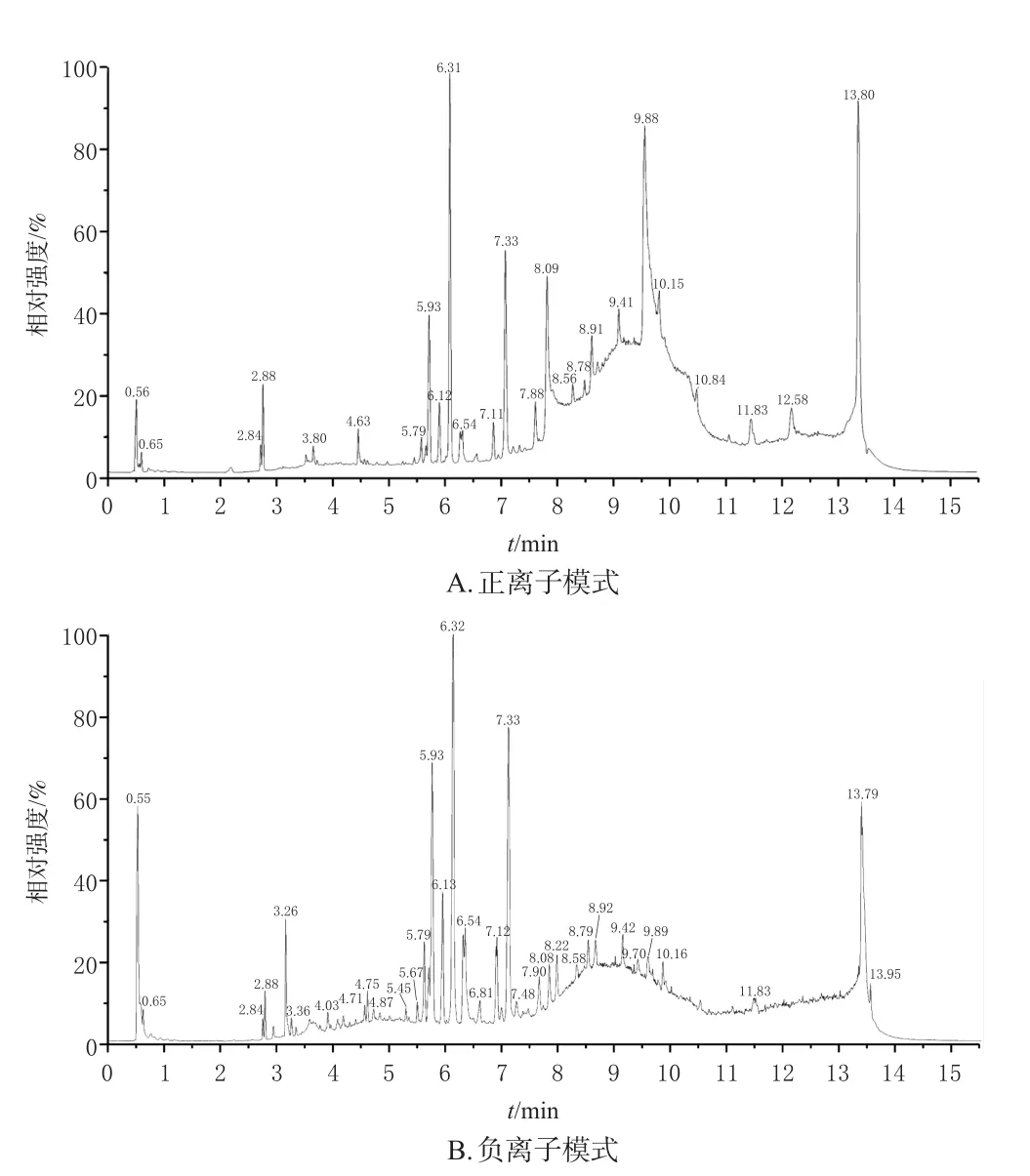
图2 正、负离子模式下质控样本的总离子流图
3.3.2 PCA 根据PCA得分图(图3)可知,所有质控样本聚在一起,说明样本及分析过程中仪器稳定性良好,模型可靠,所得差异代谢物能够反映样本之间的生物学差异。空白组、生佛手组和制佛手组基本分离,表明生、制佛手给药后均会影响大鼠体内的正常代谢,且佛手炮制前后对大鼠体内代谢的影响存在差异。
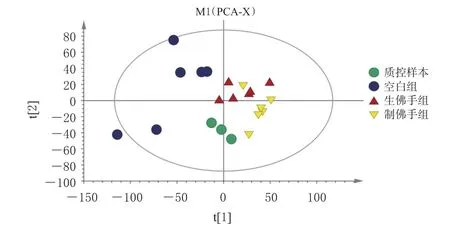
图3 各组样本PCA得分图
3.3.3 OPLS-DA 3组OPLS-DA模型中,模型拟合优度参数R2Y分别为1.000、0.991、0.829,预测优度参数Q2分别为0.928、0.947、0.256。空白组与生佛手组、空白组与制佛手组的R2Y、Q2接近于1,说明模型有较高的解释率及预测能力。由图4可知,各组样本之间分离较好,组内样本聚集,说明组间代谢物存在明显差异。
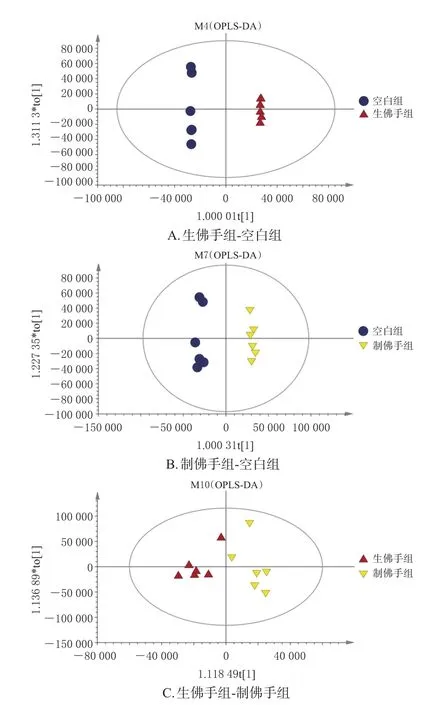
图4 各组样本OPLS-DA模型图
3.3.4 血清差异代谢物筛选 根据OPLS-DA模型筛选组间差异代谢物,以P<0.05、FC>3或FC<1/3作为筛选条件[9]。分析得到制佛手组-空白组差异代谢物有20个,包括10个氨基酸、7个脂类、3个其他类;生佛手组-空白组差异代谢物有3个,均为脂类;生佛手组-制佛手组差异代谢物有3个,包括2个氨基酸类、1个羧酸类,结果见表2。由表2可知,生佛手给药干预后在体内主要影响脂类,而制佛手给药后对脂类的影响降低,向氨基酸类迁移。
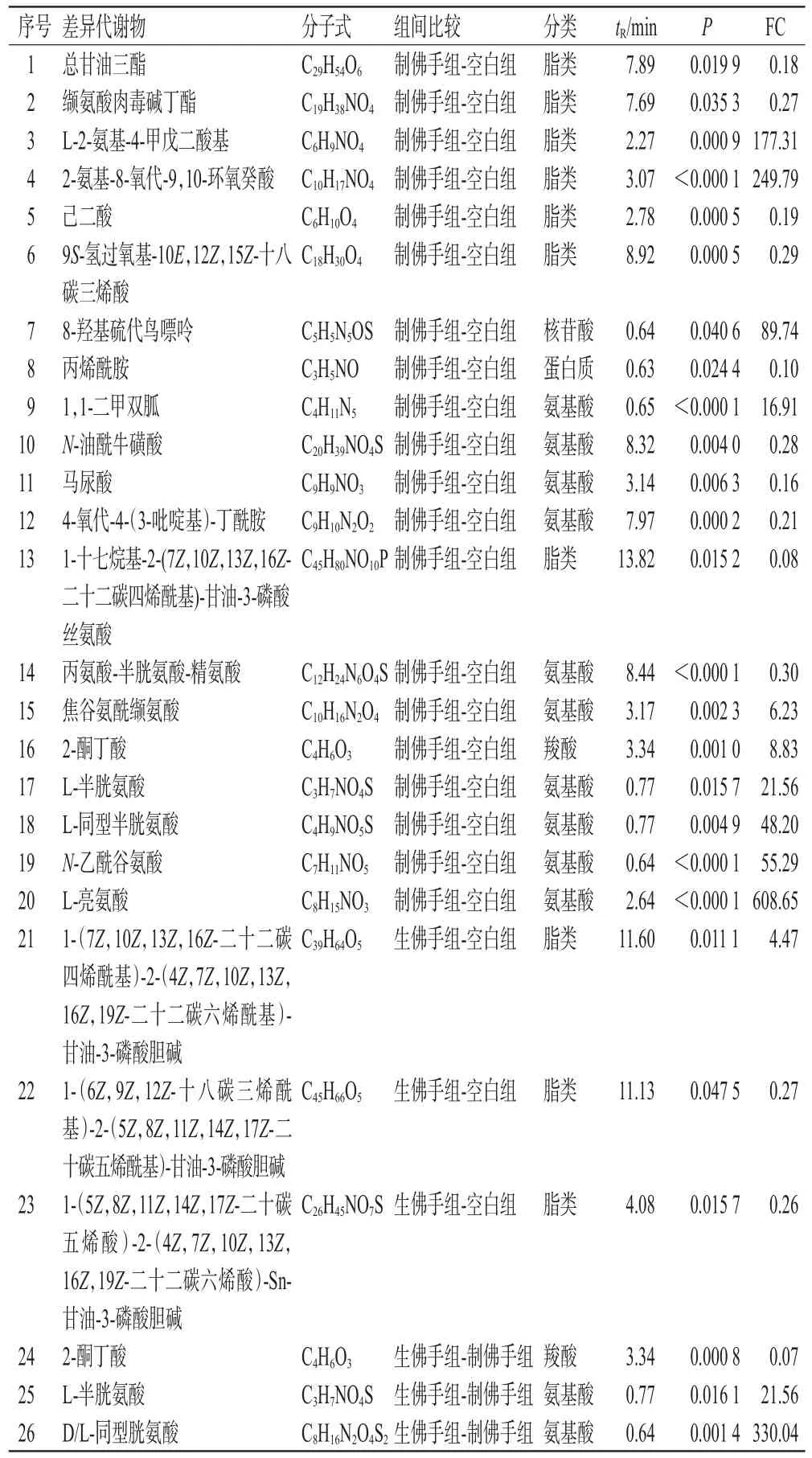
表2 大鼠血清中差异代谢物的鉴定结果
3.3.5 代谢通路分析 将差异代谢物进行匹配,得到具有KEGG信号的差异代谢物,通过KEGG pathway mapper功能进行通路富集分析,获得代谢通路富集结果。筛选出P<0.05的通路,认为该代谢通路有显著性差异。结果显示,生佛手和制佛手均影响了亚油酸代谢和甘油磷脂代谢。从通路P值来看,生佛手对甘油磷脂代谢的影响显著高于制佛手,对亚油酸代谢的影响显著低于制佛手;制佛手组-空白组和生佛手组-制佛手组的组间差异代谢物涉及多条代谢途径,结果见表3。
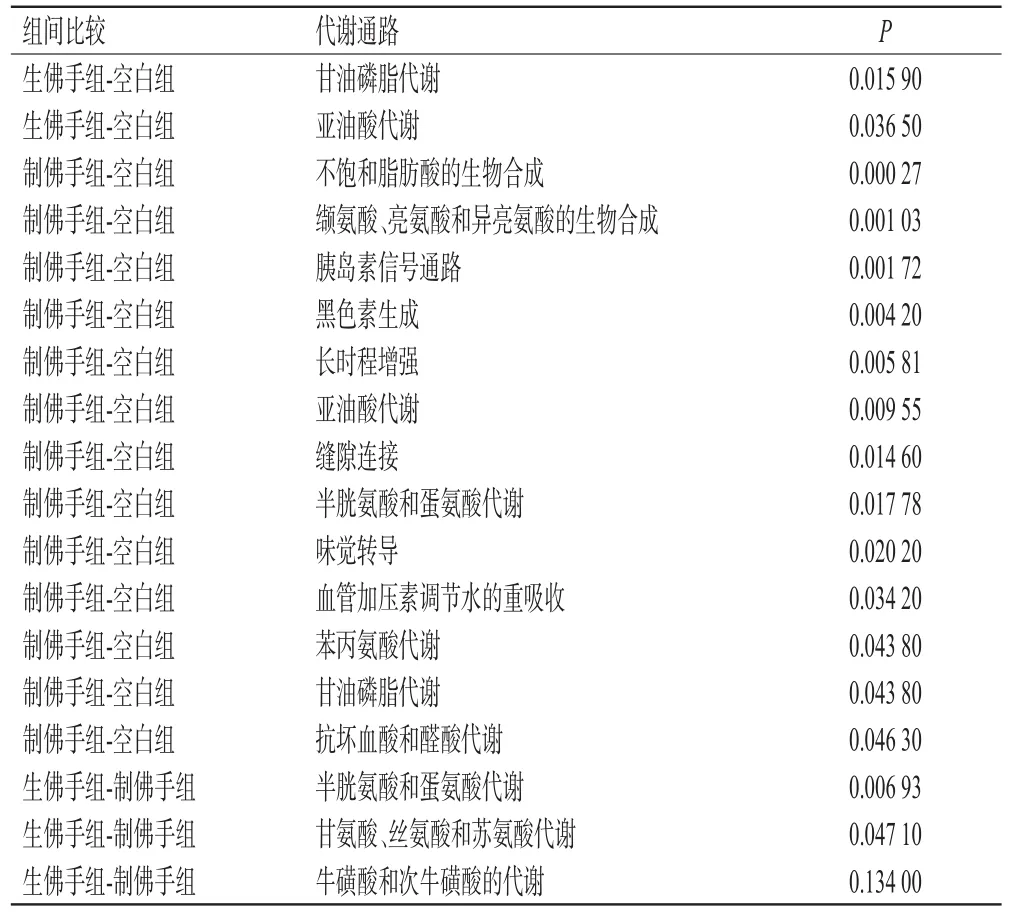
表3 空白组、生佛手组和制佛手组组间差异代谢物的代谢通路
4 讨论
本研究选用健康大鼠,连续给药35 d,大鼠经历了药物反应蓄积、症状表现和机体自我调节过程。从摄食量、饮水量、尿液量3个指标的动态观察结果可以看出,给药7 d,生、制佛手组间3个指标都出现了分化;给药第14天,两组间摄食量和饮水量分化最大,此后分化出现波动。生佛手组和枳壳组大鼠饮水量较空白组和制佛手组低,然而关于枳壳燥性的文献报道表明,生枳壳组大鼠饮水量会显著高于空白组,文献采用的剂量为10 g/kg[5―6]。本研究枳壳采用剂量为1.2 g/kg(正常剂量),给药剂量不同可能是本研究中饮水量指标结果无显著性的原因。由此也说明以饮水量作为燥性评价指标并不适合所有燥性中药。制佛手组和枳壳组组间的尿液量于给药第21天出现显著性差异,在此前后差异均无统计学意义。血清AQP3在机体发挥的作用主要是促进水在细胞内外的转运,促进肾小管的重吸收[10]。有实验证明,血清AQP3缺少小鼠会出现多尿症状[11]。本研究对大鼠血清AQP3含量的检测结果显示,制佛手组血清AQP3含量显著低于生佛手组(P<0.05)。相应尿液量观察结果显示,制佛手组尿液量较生佛手组高。由此得出,AQP3含量变化可以有效反映佛手的燥性。佛手的燥可使大鼠机体内血清AQP3含量增加,尿液量减少。综合各项动态观察指标和尿液量与血清AQP3的关联性,推测研究佛手的燥性,给药时长以21 d较为合适。综合本研究中各项燥性相关指标的观察/检测结果,枳壳与佛手具有相似的燥性表征,虽然指标值的转折点出现时间在两者中略有不同,但是不影响以枳壳作为佛手燥性相关研究的阳性对照药。
代谢组学结果显示,制佛手影响的通路涉及不饱和脂肪酸代谢、胰岛素代谢、水液代谢和氨基酸代谢等。胰岛素代谢、水液代谢等多个代谢中均有环磷酸腺苷(cyclic adenosine monophosphate,cAMP)代谢物的影响,即cAMP-蛋白激酶A(protein kinase A,PKA)通路受到影响。cAMP是细胞内重要的第二信使之一,目前已被证明可以调节各种细胞进程,例如细胞代谢、增殖、凋亡和基因表达等。cAMP-PKA信号通路还可以介导AQPs的运输、门控及重新分布,腺苷三磷酸在腺苷酸环化酶作用下生成cAMP,cAMP进一步激活PKA或蛋白激酶C,磷酸化活化AQPs,从而增加细胞膜对水的通透性[12]。研究证实cAMP-PKA信号通路的上调可使AQP3表达水平提高[13]。本研究代谢组学结果进一步印证血清AQP3可作为评价佛手燥性的指标之一。
生佛手组-制佛手组涉及的半胱氨酸和蛋氨酸代谢与肝脏内脂质代谢密切相关。蛋氨酸又名甲硫氨酸,能促进磷脂酰胆碱合成,蛋氨酸、胆碱缺乏容易导致磷脂酰胆碱合成减少,造成极低密度脂蛋白的合成、分泌减少及线粒体β-氧化功能损伤,从而使三酰甘油在肝细胞中大量堆积,导致肝细胞脂肪变性,形成脂肪肝[14]。生佛手组-空白组和制佛手组-空白组的差异代谢物均涉及甘油磷脂代谢,且生佛手对甘油磷脂代谢的影响大于制佛手。研究表明,甘油磷脂代谢与酒精性肝损伤引起的早期脂肪变性和炎症有关[15],因此认为生佛手和制佛手调节肝脏内脂质代谢的作用可能存在差异,后期可通过建立高脂血症动物模型来验证佛手炮制前后药效变化。
综上所述,制佛手可能通过影响cAMP-PKA通路缓和生佛手的燥性,血清AQP3含量可作为评价佛手炮制前后燥性变化的指标;生佛手和制佛手对大鼠血清内源性代谢物的影响存在较大差异,尤其在脂质代谢方面,可为研究佛手炮制前后药效变化提供思路。
