石淋清颗粒预防大鼠草酸钙肾结石形成的作用机制研究 Δ
2022-12-13靳潇潇李卫胜杨雄郑聪何文强河南中医药大学第一附属医院泌尿外科二区郑州450003
靳潇潇,李卫胜,杨雄,郑聪,何文强 (河南中医药大学第一附属医院泌尿外科二区,郑州 450003)
肾结石是泌尿系统常见疾病之一,由于生活环境的变化及饮食结构的改善,肾结石患病率呈上升趋势[1]。我国最近一项调查研究显示,肾结石患病率为5.8%(男性为6.5%,女性为5.1%),即每17人中就有1人患肾结石[2]。越来越多的证据表明,炎症、氧化和抗氧化失衡可能在肾结石的发展中起关键作用[3―5]。去乙酰化酶3(SIRT3)是存在于线粒体内的一种依赖于烟酰胺腺嘌呤二核苷酸(NAD+)的去乙酰化酶,主要调节线粒体功能和相关代谢,可反映能量限制和应激状态;叉头框蛋白O3a(FOXO3a)在线粒体内主要受SITR3的调控,可保护机体免受氧化应激损伤[6]。
中医范畴内肾结石属“石淋”“尿淋”“砂淋”等,主要是由于肾虚,膀胱气化不足,湿热蕴结与下焦,气滞血瘀而炼液成石[7],其治疗方式兼顾扶正祛邪、益气补肾、清热通淋[8]。石淋清颗粒主要由金钱草、海金沙、石韦、王不留行等组成,是河南中医药大学第一附属医院的自拟方,临床上主要用于促进泌尿系统结石患者排石,可缓解疼痛,缩短排石时间。为进一步了解石淋清颗粒的作用机制,本研究建立草酸钙肾结石大鼠模型,并以SIRT3/FOXO3a信号通路为靶点探讨石淋清颗粒预防肾结石形成的作用机制,以期为其临床应用提供实验基础。
1 材料
1.1 主要仪器
1.2 主要药品与试剂
石淋清颗粒由河南中医药大学第一附属医院药剂科提供;Von Kossa染色试剂盒(批号G1043)购自武汉赛维尔生物科技有限公司;苏木素-伊红(HE)染色试剂盒(货号G11120)购自北京索莱宝科技有限公司;活性氧(reactive oxygen species,ROS)试剂盒、丙二醛(malondi‐aldehyde,MDA)试剂盒、超氧化物歧化酶(superoxide dismutase,SOD)试剂盒(货号分别为E004-1-1、A003-1、A001-1)均购自南京建成生物工程研究所;骨桥蛋白(os‐teopontin,OPN)试剂盒(批号20211026R)购自江苏酶免实业有限公司;SIRT3抑制剂(批号GC19013)购自美国Glpbio公司;兔抗大鼠SIRT3多克隆抗体(批号2627S)购自美国CST公司;兔抗大鼠FOXO3a多克隆抗体、兔抗大鼠SOD2多克隆抗体(批号分别为66428、24127)购自武汉三鹰生物技术有限公司。本研究所用引物均由武汉赛维尔生物科技有限公司设计合成,具体引物序列及扩增产物长度见表1。

表1 引物序列及扩增产物长度
1.3 实验动物
本研究所用动物为SPF级雄性SD大鼠,共60只,体质量(200±20) g,由山东省济南朋悦实验动物繁育有限公司提供,动物生产许可证号为SCXK(鲁)20190003。大鼠饲养在河南中医药大学动物实验中心实验室,环境温度为(20±2) ℃,相对湿度为50%~60%。本实验已经河南中医药大学动物伦理委员会批准,伦理审查批准号为DWLL202105102。
2 方法
2.1 分组、造模与给药
适应性饲养1周后,将60只大鼠随机分为空白组、模型组和石淋清颗粒低、中、高剂量组(6.5、13、26 g/kg,低剂量为临床等效剂量)及SIRT3抑制剂组(石淋清颗粒26 g/kg+SIRT3抑制剂25 mg/kg,SIRT3抑制剂的剂量根据预实验结果设置),每组10只。参考文献[9]方法,除空白组大鼠外,其余各组大鼠将饮水更换为1%乙二醇溶液,并每天灌胃2%氯化铵溶液2 mL,连续4周,以复制草酸钙肾结石大鼠模型。造模同时,给药组大鼠灌胃相应药物,空白组和模型组大鼠灌胃等体积生理盐水,每天1次,连续4周。实验过程中,空白组和石淋清颗粒中剂量组大鼠无死亡,其余各组均死亡2只大鼠。
2.2 大鼠尿液和血清中相关指标的检测
各组大鼠在实验结束前1 d,禁食不禁水,采用代谢收集笼收集每只大鼠24 h尿量,以2 000 r/min离心10 min,取上清液,采用精密pH计测定尿液pH值,采用铬酸钾氧化甲基红催化光度法检测尿液中草酸(oxalic acid,Ox)含量,采用全自动生化分析仪检测尿液中Ca2+含量。各组大鼠尿液收集后,腹腔注射戊巴比妥钠行麻醉,于腹主动脉采血,血样以3 000 r/min离心15 min,取上层血清,采用全自动生化分析仪检测大鼠血清中肌酐(creatinine,Cr)、血尿素氮(blood urea nitrogen,BUN)及Ca2+含量。
2.3 大鼠肾组织病理学形态观察
采用HE染色法进行观察。大鼠采血完成后,采用空气栓塞法处死大鼠,然后剖取肾脏组织,取部分组织制备石蜡切片(剩余组织于液氮中保存备用,进行后续实验):取肾脏组织适量以4%多聚甲醛固定24 h后,经梯度乙醇脱水、二甲苯透明、石蜡包埋、切片(厚度为4 μm)等过程制作病理切片;切片经二甲苯脱蜡后,进行HE染色,然后于显微镜下观察肾组织病理学变化。
2.4 大鼠草酸钙肾结晶情况观察
采用Von Kossa染色法进行观察。将“2.3”项下剩余切片置于透明湿盒中,立即滴加Von Kossa染色液于组织切片上,以紫外灯连续照射5~20 min,蒸馏水清洗15 s×5次;以苏木素染色3~5 min,梯度乙二醇脱水,再以伊红染色5 min;脱水封片,于显微镜下观察大鼠草酸钙肾结晶情况。每只大鼠选取3张切片,每张切片选取3个视野观察草酸钙肾结晶数目(取平均值),然后进行评分:0分为无结晶;1分为散在的结晶存在;2分为广泛分布但不成堆或局部结晶存在;3分为成堆结晶但不连接;4分为结晶成堆且连接;5分为广泛成堆结晶[10]。
2.5 大鼠肾组织超微结构观察
采用透射电子显微镜进行观察。取冻存的肾组织适量,于2.5%戊二醛浸泡4 h,以磷酸盐缓冲液漂洗15 min×4次;再于1%锇酸中浸泡1.5 h,以磷酸盐缓冲液漂洗15 min×4次;经梯度乙醇脱水、浸透、包埋、切片后,采用透射电子显微镜观察大鼠肾小球足突细胞中的线粒体、基膜及肾小管上皮细胞线粒体。
2.6 大鼠肾组织中MDA、SOD、ROS、OPN水平的检测
取适量冻存的肾组织进行匀浆,以3 000 r/min离心15 min,取上清液,按照MDA、SOD、ROS、OPN试剂盒说明书方法操作,检测大鼠肾组织中上述指标水平。
中小企业的划分标准是由国务院负责企业工作的部门根据企业职工人数、销售额、资产总额等指标,结合行业特点制定,对于不同的行业,划分标准也有所不同。中小企业大多雇用人数与经营额都不大,多数上由业主直接管理。[1]其特点主要包括:经营产品单一,风险较高;所有权与经营权很难分离;会计及内部控制从业人员素质较低。
2.7 大鼠肾组织中SIRT3、FOXO3a、SOD2 mRNA表达水平的检测
采用PCR法进行检测。取冻存的肾组织100 mg于匀浆管内,加入RNA提取液1 mL充分研磨后,提取总RNA。取总RNA进行反转录合成cDNA,再以cDNA为模板进行PCR扩增。PCR扩增条件为95 ℃预变性10 min;95 ℃变性15 s,60 ℃退火 30 s,40个循环。以 GAPDH为内参,采用2-ΔΔCt法计算目的基因mRNA的表达水平。
2.8 大鼠肾组织中SIRT3、FOXO3a、SOD2蛋白表达水平的检测
采用Western blot法进行检测。取冻存的肾组织适量,加入预冷的裂解液于冰上进行匀浆并离心,采用BCA法检测蛋白浓度。蛋白变性后使用十二烷基硫酸钠-聚丙烯酰胺凝胶电泳,转膜,加入SIRT3、FOXO3a、SOD2、GAPDH 一抗(稀释度分别为 1∶800、1∶800、1∶5 000、1∶800)封闭,4 ℃孵育过夜;洗膜,加入二抗(稀释度为1∶5 000),室温孵育30 min;采用ECL法曝光显色,经凝胶图像分析仪拍照后,采用Image J软件分析,以目的蛋白条带与内参蛋白(GAPDH)条带灰度值比值表示目的蛋白的表达水平。
2.9 统计学方法
3 结果
3.1 石淋清颗粒对大鼠24 h尿量和尿液中相关指标的影响
与空白组比较,模型组大鼠24 h尿量和尿液pH值均显著降低(P<0.05或P<0.01),尿液中Ca2+、Ox含量均显著升高(P<0.01);与模型组比较,石淋清颗粒各剂量组大鼠上述指标均显著逆转(P<0.05或P<0.01),而SIRT3抑制剂组大鼠上述指标差异无统计学意义(P>0.05)。结果见表2。
表2 各组大鼠24 h尿量和尿液中相关指标的检测结果(±s)
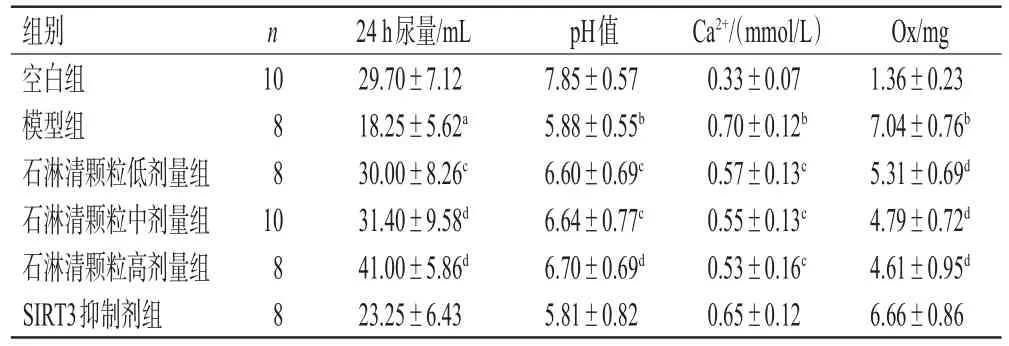
表2 各组大鼠24 h尿量和尿液中相关指标的检测结果(±s)
a:与空白组比较,P<0.05;b:与空白组比较,P<0.01;c:与模型组比较,P<0.05;d:与模型组比较,P<0.01
组别空白组模型组石淋清颗粒低剂量组石淋清颗粒中剂量组石淋清颗粒高剂量组SIRT3抑制剂组n 10 8 8 1 0 8 8 24 h尿量/mL 29.70±7.12 18.25±5.62a 30.00±8.26c 31.40±9.58d 41.00±5.86d 23.25±6.43 pH值7.85±0.57 5.88±0.55b 6.60±0.69c 6.64±0.77c 6.70±0.69d 5.81±0.82 Ca2+/(mmol/L)0.33±0.07 0.70±0.12b 0.57±0.13c 0.55±0.13c 0.53±0.16c 0.65±0.12 Ox/mg 1.36±0.23 7.04±0.76b 5.31±0.69d 4.79±0.72d 4.61±0.95d 6.66±0.86
3.2 石淋清颗粒对大鼠血清中相关指标的影响
与空白组比较,模型组大鼠血清中Cr、BUN、Ca2+含量均显著升高(P<0.01);与模型组比较,石淋清颗粒各剂量组大鼠血清中上述指标含量均显著逆转(低剂量组Ca2+含量除外,P<0.05或P<0.01),而SIRT3抑制剂组上述指标含量差异无统计学意义(P>0.05)。结果见表3。
表3 各组大鼠血清中相关指标检测结果(±s)

表3 各组大鼠血清中相关指标检测结果(±s)
a:与空白组比较,P<0.01;b:与模型组比较,P<0.05;c:与模型组比较,P<0.01
Ca2+/(mmol/L)2.22±0.06 2.34±0.07a 2.29±0.05 2.26±0.05c 2.28±0.04b 2.30±0.06组别空白组模型组石淋清颗粒低剂量组石淋清颗粒中剂量组石淋清颗粒高剂量组SIRT3抑制剂组n 10 8 8 1 0 8 8 Cr/(μmol/L)28.76±10.90 88.83±15.49a 63.67±13.71c 68.30±18.15c 60.63±20.64c 83.11±11.85 BUN/(mmol/L)17.96±8.41 65.25±18.45a 47.18±16.14b 48.39±19.42b 40.05±13.82c 60.82±13.50
3.3 石淋清颗粒对大鼠肾组织病理学形态的影响
与空白组比较,模型组大鼠肾小管管腔明显扩张,肾小球、肾小管排列紊乱,肾组织损伤严重。与模型组比较,石淋清颗粒各剂量组大鼠以上病理变化得到改善,且中、高剂量组改善更明显;而SIRT3抑制剂组大鼠肾脏损伤仍较为严重,肾小管、肾小球排列紊乱,且管腔扩张明显。结果见图1。
3.4 石淋清颗粒对大鼠草酸钙肾结晶的影响
空白组大鼠肾脏内未见结晶。模型组大鼠肾脏内可见大量弥漫性分布的结晶,且大多数在肾小管管腔内融合成堆。与模型组比较,石淋清颗粒各剂量组大鼠肾脏内结晶相对减少,呈散状分布,且高剂量组大鼠肾脏内结晶最少,呈零星分布;SIRT3抑制剂组大鼠肾脏内结晶部分弥漫分布但不成堆。结果见图2、表4。

表4 各组大鼠肾脏结晶的评分结果(只)

图2 各组大鼠草酸钙肾结晶的显微图
3.5 石淋清颗粒对大鼠肾脏超微结构的影响
与空白组比较,模型组大鼠肾小球基膜增厚,足突细胞中的线粒体水肿、破裂、嵴消失明显,肾小管上皮细胞中的线粒体水肿、破裂、双膜结构损坏、嵴消失明显、排列紊乱。与模型组比较,石淋清颗粒各剂量组大鼠肾小球基膜、足突细胞中的线粒体损伤及肾小管上皮细胞中的线粒体损伤均减轻,且高剂量组大鼠肾小管上皮细胞中的线粒体表现出代偿性增生;SIRT3抑制剂组大鼠上述肾脏超微结构仍损伤严重。结果见图3、图4。
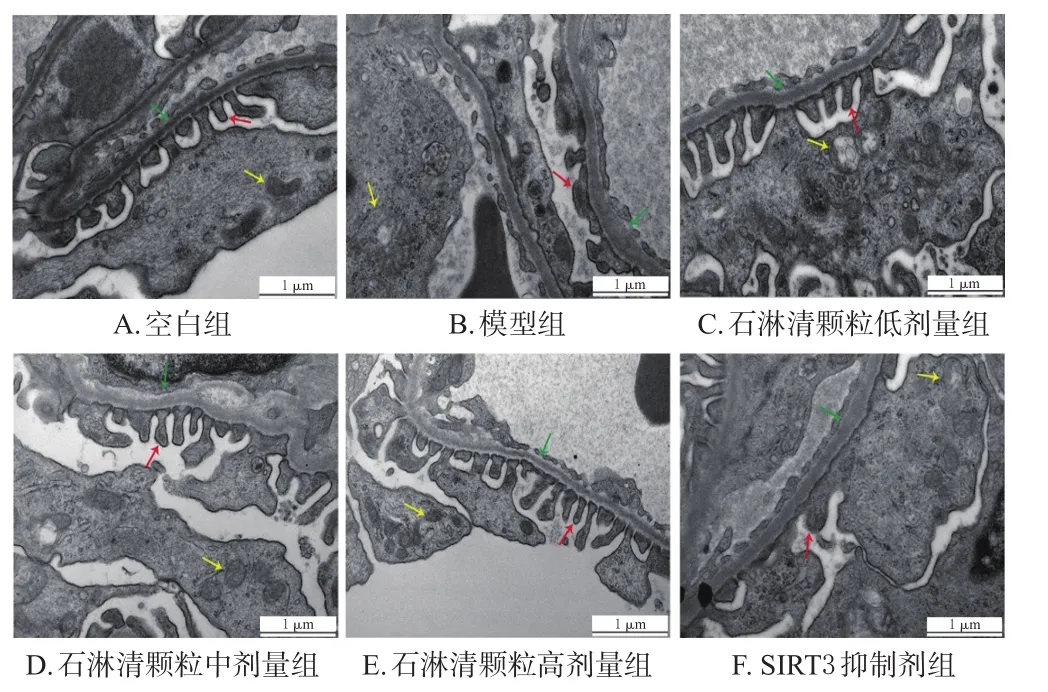
图3 各组大鼠肾小球的超微结构显微图

图4 各组大鼠肾小管的超微结构显微图
3.6 石淋清颗粒对大鼠肾组织中MDA、SOD、ROS、OPN水平的影响
与空白组比较,模型组大鼠肾组织中ROS、MDA、OPN水平均显著升高(P<0.01),SOD水平显著降低(P<0.01);与模型组比较,石淋清颗粒各剂量组大鼠肾组织中上述指标水平均显著逆转(P<0.05或P<0.01),而SIRT3抑制剂组大鼠肾组织中上述指标水平差异无统计学意义(P>0.05)。结果见表5。
表5 各组大鼠肾组织中MDA、SOD、ROS、OPN水平的检测结果(±s)

表5 各组大鼠肾组织中MDA、SOD、ROS、OPN水平的检测结果(±s)
a:与空白组比较,P<0.01;b:与模型组比较,P<0.05;c:与模型组比较,P<0.01
OPN/(ng/mL)22.48±4.59 30.60±3.49a 24.34±3.95c 24.05±3.89c 23.76±3.92c 28.38±3.63组别空白组模型组石淋清颗粒低剂量组石淋清颗粒中剂量组石淋清颗粒高剂量组SIRT3抑制剂组n 10 8 8 1 0 8 8 ROS 187.12±30.39 296.35±41.57a 252.36±21.97b 249.82±40.30c 234.56±41.09c 290.06±23.46 MDA/(nmol/mg)0.41±0.13 1.01±0.21a 0.82±0.18b 0.78±0.22b 0.76±0.18b 0.94±0.21 SOD/ (U/mg)49.60±7.63 24.58±4.47a 31.35±3.55b 32.01±3.21b 35.30±9.73c 24.11±4.56
3.7 石淋清颗粒对大鼠肾组织中SIRT3、FOXO3a、SOD2 mRNA和蛋白表达的影响
与空白组比较,模型组大鼠肾组织中SIRT3、FOXO3a、SOD2 mRNA和蛋白表达水平均显著降低(P<0.01)。与模型组比较,石淋清颗粒各剂量组大鼠肾组织中上述指标mRNA和蛋白表达水平均显著逆转(P<0.05或P<0.01);SIRT3抑制剂组大鼠肾组织中上述指标mRNA和蛋白表达水平差异无统计学意义(P>0.05)。结果见图5、表6。

图5 各组大鼠肾组织中SIRT3、FOXO3a、SOD2蛋白表达的电泳图
表6 各组大鼠肾组织中 SIRT3、FOXO3a、SOD2 mRNA和蛋白表达水平的检测结果(±s,n=3)
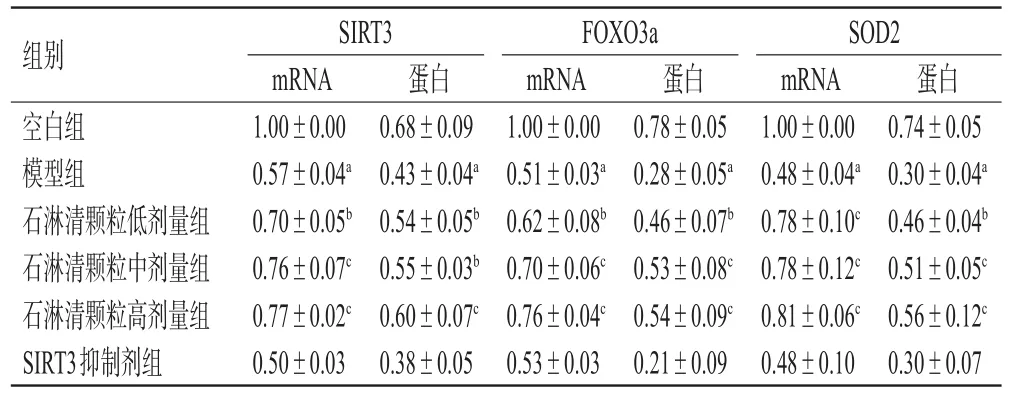
表6 各组大鼠肾组织中 SIRT3、FOXO3a、SOD2 mRNA和蛋白表达水平的检测结果(±s,n=3)
a:与空白组比较,P<0.01;b:与模型组比较,P<0.05;c:与模型组比较,P<0.01
组别空白组模型组石淋清颗粒低剂量组石淋清颗粒中剂量组石淋清颗粒高剂量组SIRT3抑制剂组SIRT3 mRNA 1.00±0.00 0.57±0.04a 0.70±0.05b 0.76±0.07c 0.77±0.02c 0.50±0.03蛋白0.68±0.09 0.43±0.04a 0.54±0.05b 0.55±0.03b 0.60±0.07c 0.38±0.05 FOXO3a mRNA 1.00±0.00 0.51±0.03a 0.62±0.08b 0.70±0.06c 0.76±0.04c 0.53±0.03蛋白0.78±0.05 0.28±0.05a 0.46±0.07b 0.53±0.08c 0.54±0.09c 0.21±0.09 SOD2 mRNA 1.00±0.00 0.48±0.04a 0.78±0.10c 0.78±0.12c 0.81±0.06c 0.48±0.10蛋白0.74±0.05 0.30±0.04a 0.46±0.04b 0.51±0.05c 0.56±0.12c 0.30±0.07
4 讨论
肾结石是一种慢性代谢性、高复发性疾病,其发生和发展与多种疾病(如高血压、糖尿病、代谢综合征等)有关。肾结石的非手术治疗方式是通过增加尿量和改善尿液pH值进行预防治疗的,如增加液体摄入量、低钙饮食、口服柠檬酸钾等[11―12]。
目前,草酸钙肾结石模型大多采用1%乙二醇溶液+2%氯化铵溶液进行诱导:体内乙二醇代谢后形成草酸,草酸与钙盐结合形成草酸钙,而氯化铵溶液可降低尿液pH值,从而促进草酸钙结晶的形成[13]。本研究结果显示,与空白组相比,模型组大鼠24 h尿量、尿液pH值均降低,尿液中Ca2+、Ox含量及血清中Cr、BUN、Ca2+含量均升高,且肾组织病理损伤较为严重,可见大量弥漫性分布的结晶。经石淋清颗粒干预后,大鼠24 h尿量、尿液pH值均升高,尿液中Ca2+、Ox含量及血清中Cr、BUN、Ca2+含量均降低,且大鼠肾组织损伤得到改善,黑色结晶相对减少、呈散状分布。这表明石淋清颗粒可抑制大鼠肾脏结晶的形成。
ROS的产生不仅损伤肾脏功能,还会促进结晶在肾脏的沉积,其主要来源于线粒体[14]。相关研究发现,肾结石患者体内抗氧化酶(如SOD、谷胱甘肽过氧化物酶)水平降低,且经手术处理后,患者体内MDA水平降低[4,14]。研究表明,OPN在肾结石患者体内存在高表达,从而在肾结石的形成过程中具有重要的作用[15]。经石淋清颗粒干预后,大鼠肾组织中ROS、MDA、OPN水平均降低,SOD水平升高,肾小球基膜、足突细胞和肾小管上皮细胞中的线粒体损伤均减轻。这表明石淋清颗粒可通过抗氧化作用改善大鼠肾小球足突细胞和肾小管上皮细胞的线粒体损伤。
相关研究表明,抑制SIRT3在细胞中的表达,可促进ROS的产生,从而增强氧化应激,进一步损伤细胞[16]。FOXO3a是参与细胞抗氧化的重要成员之一,其可从多种细胞刺激(生长因子、代谢应激、氧化应激)中接收信号[17―18],从而发挥抗氧化作用。另有研究发现,SIRT3的去乙酰化可调节FOXO3a的活性,二者共同在线粒体中发挥促进氧化应激相关基因转录的作用,进而增加SOD2的生成,从而改善细胞和组织的氧化损伤[19]。本研究结果显示,经石淋清颗粒干预后,大鼠肾组织中SIRT3、FOXO3a、SOD2 mRNA和蛋白表达水平均升高,而经SIRT3抑制剂+石淋清颗粒干预后,上述指标表达水平差异无统计学意义,且肾组织损伤较为严重,黑色结晶弥漫分布,肾小球和肾小管上皮细胞线粒体损伤严重。这表明石淋清颗粒可通过激活SIRT3/FOXO3a信号通路活性,发挥抗氧化作用,进而抑制肾结石的形成。
综上所述,石淋清颗粒可有效抑制大鼠草酸钙肾结石的形成,改善肾损伤,其作用机制可能与提高抗氧化作用和激活SIRT3/FOXO3a信号通路有关。
