铁死亡在压力诱导的椎间盘退变中的作用及机制研究
2022-12-12毛建鑫高楚尚启良王栋王迪杜牧杨柳罗卓荆
毛建鑫 高楚,2 尚启良 王栋 王迪 杜牧 杨柳 罗卓荆
下腰痛是一种临床常见的骨骼肌肉疾病,累及所有年龄段的人,在全球有超过5 亿人受其影响。并且下腰痛的发病率和致残率都很高,给病人家庭和社会造成了严重的经济负担[1-2]。椎间盘退变被认为是下腰痛发病的主要病理原因[3]。椎间盘由两端软骨终板、周围层状纤维环及中央的髓核组织组成,起到缓冲脊柱压力的作用。越来越多的证据表明,持续或过度的机械压力负荷会诱导髓核细胞的死亡并最终导致椎间盘退变[4-5]。然而,其潜在分子机制仍需进一步的研究。
铁死亡是2012 年发现的一种调节性细胞死亡方式,其特征是铁依赖性的脂质过氧化物积累过量导致细胞膜的氧化损伤和细胞死亡[6]。谷胱甘肽过氧化物酶4(GPX4)作为主要的内源性抗氧化物酶可将毒性的脂质过氧化物转化为无毒的脂质醇,被认为是铁死亡的核心抑制剂[7-8]。研究表明,铁死亡抑制剂Ferrostatin-1(Fer-1)在氧化应激诱导的椎间盘退变中起到显著的治疗作用[9];白细胞介素-6(IL-6)可以通过扰乱铁稳态促进髓核细胞铁死亡的发生和椎间盘退变[10]。然而,截至目前,尚无研究报道铁死亡是否参与压力诱导的椎间盘退变。
miRNAs 是一类高度保守的单链非编码RNA,可以通过抑制翻译或者促进mRNA降解来调节靶基因的表达,在细胞增殖、凋亡、自噬、衰老等广泛生理过程中发挥重要作用[11]。因此,miRNAs 的失调与多种病理过程相关,包括椎间盘退变[12]。研究表明,miR-98 表达水平的降低能够通过激活IL-6/STAT3 信号通路促进椎间盘退变的发生[13];靶向抑制miR-132可以有效缓解炎症诱导的髓核组织胞外基质降解[14]。
本研究中,我们进行了以下实验:①观察压力诱导下髓核细胞的增殖活力、细胞表型和脂质氧化水平;②运用TargetScan 8.0 数据库(Whitehead Institute for Biomedical Research 研究所,美国),基于序列互补原则,预测与GPX4 靶向结合的miRNA 及其位点,而后我们发现miR-1224靶向结合于GPX4,通过进一步检测该miRNA在髓核细胞中的表达水平,探究铁死亡在压力诱导的椎间盘退变中的作用及其分子作用机制,旨在为椎间盘退变的防治提供新的靶点。
材料与方法
一、实验材料、试剂与仪器
本研究所使用的大鼠髓核细胞系由美国芝加哥Rush大学陈棣教授惠赠[15]。
胎牛血清和LipofectamineTM2000均购自美国Invitrogen公司;Fer-1购自美国MCE公司;miRNA逆转录试剂盒购自日本TaKaRa 公司;CCK-8 试剂盒、丙二醛(MDA)试剂盒、RIPA 裂解液、免疫染色强力通透液、免疫荧光封闭液、DAPI 染色液购自上海碧云天生物技术有限公司;总RNA提取试剂盒购自美国Omega Bio-Tek 公司;miR-1224 模拟物、miR-1224 抑制剂及其阴性对照购自上海吉玛生物技术有限公司;GPX4抗体(ab125066)和MMP13抗体(ab39012)购自美国Abcam公司;ACAN抗体(C8035)购自美国Millipore 公 司;β-actin 购 自 武 汉Proteintech 公 司(HRP-60008)。
正置荧光显微镜(奥林巴斯公司,日本);L500型离心机(湘仪实验室仪器公司,中国);Western Blot 化学发光仪(GE 公司,美国);RT-PCR 仪、电泳仪、转膜槽(Bio-Rad公司,美国);SYNERGY H1型酶标仪(BioTek,美国);HH-S4 型电热恒温水浴锅(北京科伟永兴公司,中国);SW-CJ-1F 超净工作台(苏州净化公司,中国)。
二、细胞培养与转染
将大鼠髓核细胞在含有20%胎牛血清、1%链霉素和1%青霉素的DMEM/F12 培养基中进行培养。在37 ℃细胞培养箱中培养至密度为70%~90%,按5×104/mL 接种于六孔板中,待细胞贴壁完全后进行相应处理。
(一)压力培养
更换完全培养基并将细胞随机分为对照组、加压组和加压+Fer-1组。其中加压+Fer-1组以10 μmol/L Fer-1干预,对照组和加压组则加入等量DMSO。将加压组和加压+Fer-1组细胞置于静态压力培养仓内并调节仓内压力至1 MPa,加压培养24 h 后收集各组细胞进行相应检测。
(二)转染
将细胞随机分为miR-1224模拟物组(转染miR-1224模拟物)、模拟物对照组(转染miR-1224模拟物阴性对照)、miR-1224抑制剂组(转染miR-1224抑制剂)和抑制剂对照组(转染miR-1224 抑制剂阴性对照)。采用LipofectamineTM2000 按说明书对髓核细胞进行转染。分别于48 h 后收集细胞检测miR-1224表达情况,于72 h后收集细胞检测相关蛋白表达情况。
三、RT-PCR检测
按照RNA 提取试剂盒说明书对收集的细胞进行RNA 提取,检测RNA 的纯度与浓度后将RNA 逆转录为cDNA。进行PCR 扩增后以U6 为内参检测miR-1224 的表达水平,相关引物序列见表1。通过2-△△Ct计算miR-1224的相对表达量。重复三次。

表1 引物序列及扩增产物大小
四、Western Blot检测
加入强效RIPA 裂解液对收集到的细胞进行裂解,30 min后对细胞裂解液进行离心(12 000 g,10 min)并弃去沉淀,采用BCA 法检测蛋白浓度。随后,采用SDS聚丙烯酰胺凝胶电泳将目标蛋白进行分离并转移至聚偏二氟乙烯(PVDF)膜。依次进行脱脂牛奶封闭(室温,2 h)、一抗孵育(4 ℃,过夜)、二抗孵育(室温,1 h)后通过发光仪进行发光并保存分析数据。相关抗体(浓度)分别为GPX4(1∶1 000)、ACAN(1∶1 000)、MMP13(1∶1 000)、β-actin(1∶3 000)。
五、CCK-8检测细胞增殖活力
将细胞接种在96孔板中,待细胞贴壁完全后分组:对照组、加压组和加压+Fer-1 组分别加入Fer-1(10 μmol/L)或等量DMSO,并进行加压培养。24 h后,按照说明书分别向每孔加入10 μL CCK-8 溶液并置于常规细胞培养箱中继续培养4 h。最后,使用酶标仪检测每孔在450 nm 波长处的吸光度并保存分析数据。
六、透射电镜观察细胞超微结构
收集细胞,使用2.5%戊二醛固定液对细胞进行固定(4 ℃,过夜),使用磷酸缓冲液(PBS)润洗后继续在1%四氧化锇中进行固定。细胞经过梯度脱水后,使用Epon 812进行包埋并制作超薄切片。使用醋酸铀、柠檬酸铅染色后进行观察。
七、脂质氧化检测
收集细胞,对细胞进行裂解(4 ℃,20 min),将细胞裂解液离心(10 000 g,10 min)并弃去沉淀。按照试剂盒说明书配置MDA 检测工作液。将样品与检工作液混匀后沸水浴加热15 min,冷却至室温后使用酶标仪检测532 nm 波长处的吸光度值并保存分析数据。
八、细胞免疫荧光染色
按密度1×104/mL将细胞接种在12孔爬片,待细胞贴壁完全后进行加压培养。收集爬片,使用4%多聚甲醛对细胞进行固定(室温,20 min),用PBS浸洗后滴加强力通透液进行打孔(室温,15 min)。依次进行封闭(室温,1 h)、一抗孵育(4 ℃,过夜)、二抗孵育(室温,1 h)、封片后在显微镜下进行观察。相关抗体(浓度)分别为GPX4(1∶100)、ACAN(1∶100)、MMP13(1∶100)。
九、统计学分析
结 果
一、压力诱导髓核细胞铁死亡的发生
普通光学显微镜下观察细胞,与对照组相比,加压组髓核细胞数量减少、体积变小并伴有较多的漂浮细胞,而加压+Fer-1组则部分恢复了细胞状态(图1 a)。透射电镜扫描结果显示(图1 b),对照组线粒体体积及形态正常,线粒体嵴结构清晰;加压组线粒体体积缩小,膜致密度高,外膜连续性差,线粒体嵴减少,呈典型的铁死亡表型;加压+Fer-1组则在细胞表型上较加压组有所改善。同时,CCK-8 法检测结果显示,加压+Fer-1 组细胞增殖活力较加压组有所改善(图1 c,P<0.05)。铁死亡相关指标脂质氧化水平检测进一步验证了Fer-1 对压力作用下髓核细胞的保护作用(图1 d,P<0.05)。

图1 Fer-1有效逆转压力诱导的髓核细胞中铁死亡相关表型 a:Fer-1改善压力诱导下的细胞形态;b:透射电镜显示细胞超微结构;c:Fer-1改善压力诱导下的细胞增殖活力;d:Fer-1下调压力诱导下的脂质氧化水平上升(*P<0.05,**P<0.01)
以上结果均证实压力导致了髓核细胞铁死亡的发生。
二、压力导致髓核细胞GPX4表达降低
免疫荧光染色结果显示,与对照组相比,加压组髓核细胞中GPX4表达降低,合成代谢标志物ACAN表达降低,分解代谢标志物MMP13 表达增加(图2)。Western Blot 结果也证实了压力导致髓核细胞中GPX4表达降低并伴有明显的退变表型(图3,P<0.05)。以上结果提示,压力通过降低GPX4 表达进而促进髓核细胞铁死亡的发生。

图2 免疫荧光染色结果显示压力导致髓核细胞GPX4蛋白表达降低

图3 压力导致髓核细胞GPX4蛋白表达降低 a:加压处理后各蛋白的Western Blot结果;b:加压处理后各蛋白的相对表达量(**P<0.01)
三、miR-1224参与调控髓核细胞GPX4的表达
生物信息学TargetScan 8.0预测结果显示,miR-1224靶向结合于GPX4(图4 a)。为进一步验证miR-1224是否参与调节压力条件下髓核细胞中GPX4表达,首先,我们检测了miR-1224 在压力作用下的表达变化,RT-PCR 结果显示,与对照组相比,加压组中miR-1224表达升高(图4 b,P<0.05)。接下来,我们分别在髓核细胞中转染miR-1224 模拟物或miR-1224 抑制剂诱导miR-1224 水平的升高或降低(图4 c),以验证miR-1224 对GPX4 表达的调节作用。Western Blot 结果显示,与模拟物对照组相比,miR-1224模拟物组GPX4的蛋白表达被显著抑制,相反,miR-1224 抑制剂组GPX4 蛋白表达显著上升(图4 d、e,P<0.01)。MDA 检测结果也表明miR-1224 模拟物组中脂质氧化水平显著升高,而miR-1224抑制剂组则降低(图4 f,P<0.05,P<0.01)。以上结果证实,miR-1224 参与髓核细胞中GPX4 蛋白表达的调控。
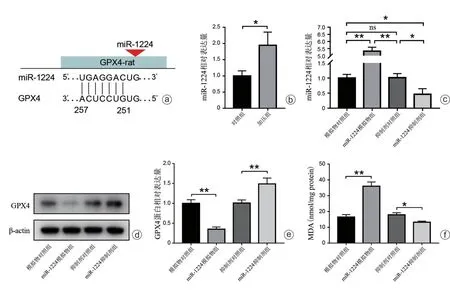
图4 miR-1224靶向抑制髓核细胞中GPX4的蛋白表达 a:miR-1224与GPX4 mRNA的结合位点;b:加压组miR-1224表达上调;c:miR-1224相对表达量;d、e:转染miR-1224下调GPX4蛋白表达;f:转染miR-1224上调脂质氧化水平(ns:无显著差异,*P<0.05,**P<0.01)
四、压力通过miR-1224-GPX4 途径促进髓核细胞铁死亡的发生
Western Blot 结果显示,转染miR-1224 抑制剂可以部分恢复压力诱导的GPX4 表达降低,并降低MMP13 的表达,升高ACAN 的表达,有效缓解了压力作用下髓核细胞的退变表型。相反,转染miR-1224 模拟物则进一步降低了GPX4 的表达,升高MMP13 的表达,降低ACAN 的表达,加剧压力导致的髓核细胞退变(图5 a~d,P<0.05,P<0.01)。MDA检测结果显示,转染miR-1224抑制剂可以部分降低压力导致的脂质氧化水平升高,而转染miR-1224 模拟物则加剧脂质氧化水平(图5 e,P<0.01)。同时,转染miR-1224抑制剂可以有效恢复压力对细胞形态的破坏,而转染miR-1224模拟物则加剧压力导致的细胞死亡,严重破坏了细胞形态(图5 f)。以上结果证实,压力通过升高miR-1224水平导致GPX4 蛋白表达降低,进而促进髓核细胞铁死亡的发生和表型退变,靶向抑制miR-1224表达则可以显著预防髓核退变。

图5 抑制miR-1224表达显著缓解压力导致的髓核细胞退变及铁死亡表型 a~d:抑制miR-1224表达上调GPX4蛋白表达并改善代谢紊乱;e:抑制miR-1224表达下调脂质氧化水平;f:抑制miR-1224表达改善细胞形态(*P<0.05,**P<0.01)
讨 论
椎间盘退变是下腰痛的主要原因之一,严重影响病人的生活质量。然而,目前针对椎间盘退变的治疗方式如物理治疗、非甾体类药物治疗、射频消融术等均旨在缓解症状。由于缺乏对椎间盘退变发生发展机制的全面了解,椎间盘退变的预防和椎间盘功能的恢复仍是一个难题[16-17]。作为承载和缓冲脊柱压力的主要生理结构,持续或过度的机械压力是导致椎间盘退变的主要原因之一。因此,本研究致力于探究压力诱导椎间盘退变的潜在机制。
凝胶样的髓核组织是承载和缓冲机械应力的重要结构,而髓核细胞则通过分泌Ⅱ型胶原和蛋白聚糖来维持髓核组织的凝胶样性状。因此,髓核细胞功能紊乱或死亡增加将会导致细胞外基质代谢失调,并最终导致髓核组织退变[18]。研究表明,压力诱导的髓核源性干细胞凋亡在椎间盘退变中发挥重要作用[19];内质网应激和内质网线粒体相互合作参与了压力诱导的髓核细胞程序性死亡[20];SIRT1 通过调节髓核细胞内线粒体自噬在压力导致的椎间盘退变中起到保护性作用[21]。然而,尚不明确压力是否会导致髓核细胞铁死亡的发生。作为一种新型的细胞程序性死亡方式,铁死亡参与了许多疾病的病理生理过程,如肾损伤、肿瘤、缺血再灌注损伤、退行性疾病等[22]。并且,高通量药物筛选发现含有芳烷胺的小分子合成化合物Fer-1 可以显著减缓脂质过氧化物的积累,是铁死亡的有效抑制剂,然而其潜在机制仍有待探索[23]。在本研究中我们发现,铁死亡抑制剂Fer-1 预处理可以有效缓解压力诱导的髓核细胞死亡,并显著改善压力导致的铁死亡特征性线粒体改变和脂质氧化水平增加,首次证实了压力作用下髓核细胞中铁死亡的发生。
由于对膜脂质过氧化物的清除能力,GPX4 被证实为铁死亡的关键调控因子。GPX4 的失活将导致细胞内过氧化物的积累,引发铁死亡[7-8]。本研究发现,压力导致髓核细胞中GPX4 蛋白表达降低。为探究其潜在机制,我们采用生物信息学软件TargetScan 8.0 对靶向结合于GPX4 的miRNA 进行了预测。miRNA 是由内源基因编码的长度约为19~25 bp的非编码单链RNA,通过与靶基因mRNA的3’非编码区(untranslated region,UTR)区域互补结合在蛋白翻译水平上抑制靶基因表达[24]。预测结果显示miR-1224 与GPX4 的3’UTR 区域存在特异性结合。miR-1224与肿瘤细胞的增殖和转移、急性肝损伤及心血管损伤等多种病理过程密切相关[25]。并且有研究表明,抑制miR-1224 可以上调大鼠心肌细胞中GPX4 蛋白表达,进而在缺氧/复氧损伤中对心脏起到保护作用[26]。在本研究中,我们发现转染miR-1224模拟物能够显著抑制髓核细胞中GPX4蛋白表达,而转染miR-1224 抑制剂则有相反结果,证实了在大鼠髓核细胞中miR-1224对GPX4蛋白表达的靶向负调控作用。同时,我们发现压力作用下髓核细胞中miR-1224的表达水平上调,转染miR-1224抑制剂可以有效缓解压力对髓核细胞增殖活性的抑制作用并显著改善压力导致的髓核细胞退变表型,而转染miR-1224 模拟物则进一步加剧压力对髓核细胞活性的影响,证实了miR-1224在压力作用下对髓核细胞的保护作用。
本研究采用静态可调节压力加载装置对髓核细胞进行加压培养,该模型已被广泛认可并应用于压力诱导的髓核组织退变相关研究。然而我们必须认识到体外髓核细胞压力培养无法完全模拟体内生理环境,本研究仍具有一定的局限性。因此,下一步我们将分别通过构建大鼠体内椎间盘加压模型和收集临床退变髓核样本,在体内对上述研究结果进行进一步的验证。
综上所述,本研究发现在压力作用下,髓核细胞中miR-1224 表达上调,而GPX4 蛋白表达下调。miR-1224通过靶向负调控GPX4的表达促进了髓核细胞中铁死亡的发生,并最终导致了髓核组织退变。靶向抑制髓核细胞内miR-1224 的表达将有效缓解压力导致的髓核组织退变,这将为椎间盘退变的防治提供新的靶点和思路。
