卵巢-附件影像报告和数据系统模型及联合CA125 对卵巢肿瘤的诊断价值
2022-12-12高雪娇张璇付莹章婷韩方于利利
高雪娇,张璇,付莹,章婷,韩方,于利利
华中科技大学同济医学院附属协和医院妇产科,湖北 武汉 430022
卵巢癌是妇科肿瘤中病死率最高的恶性肿瘤[1],卵巢肿瘤良恶性的早期判断对患者的生存预后尤为重要。超声是附件包块的首选辅助检查方法,有许多评价模型。国际卵巢肿瘤分析小组于2000年提出简单的卵巢肿瘤良恶性鉴别特征[2],随后在2005年提出Logistic回归模型[3],2014年结合CA125又提出不同类型附件肿瘤的评价(assessment of different neoplasia in the adnexa,ADNEX)模型[4],均未单独将生理或典型良性病变图像与恶性病变分开评价,存在部分病例性质无法确定的局限。2011年Amor等[5]首次将良性病变及6项怀疑恶性的特征区分开,提出妇科超声影像报告和数据系统(gynecology imaging reporting and data system,GI-RADS),但无法有效评价多房囊性包块。2018年美国放射学会提出卵巢-附件报告和数据系统(ovarian-adnexal reporting and data system,ORADS)[6],并基于其与ADNEX模型的对比,于2020年提出超声分层风险与管理指南[7],有效地将良性病变单独分开,扩大了评价范围。指南中将O-RADS>3归为恶性,且需结合血清学肿瘤标志物判断,而未给出具体方案。糖类抗原125(carbohydrate antigen 125,CA125)是最常用的区分卵巢肿瘤良恶性的肿瘤标志物,是卵巢癌诊断的重要参考指标。因此,本研究旨在探究ORADS模型及其联合CA125的诊断模式对卵巢肿瘤良恶性鉴别诊断的价值。
1 资料与方法
1.1 研究对象 2014年1月—2016年12月因卵巢附件包块于华中科技大学同济医学院附属协和医院手术患者623例,年龄14~93岁,平均(37.7±14.4)岁。纳入标准:①术前接受妇科常规超声检查;②化疗前有血清肿瘤标志物检查结果。排除标准:①有双侧附件切除史;②有引起腹水的其他疾病;③怀疑异位妊娠。本研究经华中科技大学同济医学院附属协和医院医学伦理委员会审批[批准号〔2022〕伦审字(0117)号]。
1.2 方法
1.2.1 超声检查 用GE VolusonE8/S8多普勒超声仪,腹部探头频率3~5 MHz,腔内探头频率5~9 MHz。行常规经阴道超声,检查前嘱患者排空膀胱,取截石位。对不能行经阴道超声检查或肿瘤过大、探查不全时经腹部超声检查,重点观察卵巢肿瘤大小及实性成分大小,形态是否规则、分隔和血流的分布情况,采用血流评分(color score,CS)[2],1分:无血流信号,2分:少许血流信号,3分:中等血流信号,4分:丰富血流信号,同时全面观察患者盆腔情况,包括子宫、双侧附件及有无盆腔转移结节、盆腹腔积液等。
1.2.2 评价标准 由1名具有5年以上工作经验的妇产科超声医师在未知病理结果的情况下用O-RADS模型评价623例患者的附件包块,进行诊断。对多发或双侧病变,每个病变均单独评估,且以评分最高者作为该患者的最终评分。
1.2.2.1 O-RADS分类 O-RADS将风险分为6类(0~5类)[7],实际运用仅有1~5类。1类:正常卵巢,≤3 cm卵泡/黄体;2类:几乎确定为良性,<10 cm单纯囊肿/出血性囊肿/畸胎瘤/内膜样囊肿,任何大小卵巢冠囊肿/腹膜假性囊肿/输卵管积水;3类:恶性风险低,≥10 cm单房囊肿/畸胎瘤/内膜样囊肿/出血性囊肿,任何大小单房囊肿并囊壁不规则(厚度<3 mm),<10 cm囊壁规则的多房囊肿(CS 1~3分),任何大小壁规则的实性包块(CS 1分);4类:中等恶性风险,单房囊肿有实性成分(任何大小,0~3个乳头状突起,CS 1~4分),多房囊肿(壁光滑,≥10 cm,CS 1~3;壁规则,任何大小,CS 4分;任何大小,壁或隔不规则,CS 1~4分),多房囊肿有实性成分(任何大小,CS 1~2分),任何大小壁规则的实性包块(CS 2~3分);5类,恶性风险高,单房囊肿(任何大小,≥4个乳头状突起,CS 1~4分),多房囊肿有实性成分(任何大小,CS 3~4分),实性包块(任何大小,壁规则CS 4分,壁不规则CS 1~4分),腹水/腹膜结节。分类为4或5,则为恶性。CA125≥35 U/ml为恶性[8]。
1.2.2.2 联合诊断标准 将O-RADS 4分为A和B两组,A组:单房囊肿有实性成分(任何大小,0~3个乳头状突起,CS 1~2分),多房囊肿(壁光滑,≥10 cm,CS 1~3分);B组:具有4类中除A以外的特征。当O-RADS为4A且CA125≥35 U/ml、O-RADS为4B和5为恶性。
1.3 统计学方法 采用SPSS 23.0和MedCalc15.0软件。以病理结果为“金标准”,计算O-RADS及其联合CA125的敏感度、特异度、准确度、阳性预测值、阴性预测值,用χ2检验比较2种方法的差异。绘制受试者工作特征(ROC)曲线,计算曲线下面积(AUC),用Z检验进行比较。P<0.05为差异有统计学意义。
2 结果
2.1 病理结果 623例卵巢肿瘤中,良性461例,包括内膜囊肿136例,畸胎瘤185例,其他良性囊肿52例(单纯囊肿26例,黄体囊肿11例,卵巢冠囊肿2例,卵巢甲状腺肿1例,滤泡囊肿8例,输卵管积液4例),浆液囊腺瘤31例,黏液性囊腺瘤57例;交界性47例(交界性浆液性囊腺瘤17例,交界性黏液性囊腺瘤26例,交界性子宫内膜样瘤4例);恶性115例(浆液性癌67例,黏液性癌3例,生殖细胞肿瘤12例,转移性腺癌15例,透明细胞癌6例,鳞状细胞癌2例,性索-间质细胞肿瘤10例)。本研究将交界性归为具有恶性风险。
2.2 O-RADS 4A和4B的恶性风险指数及CA125分布不同评分恶性风险指数基本与指南一致,4B的风险指数(93.55%)明显高于4A(25.93%),4A中CA125为恶性的概率(29.63%)明显低于4B(64.52%),见表1。
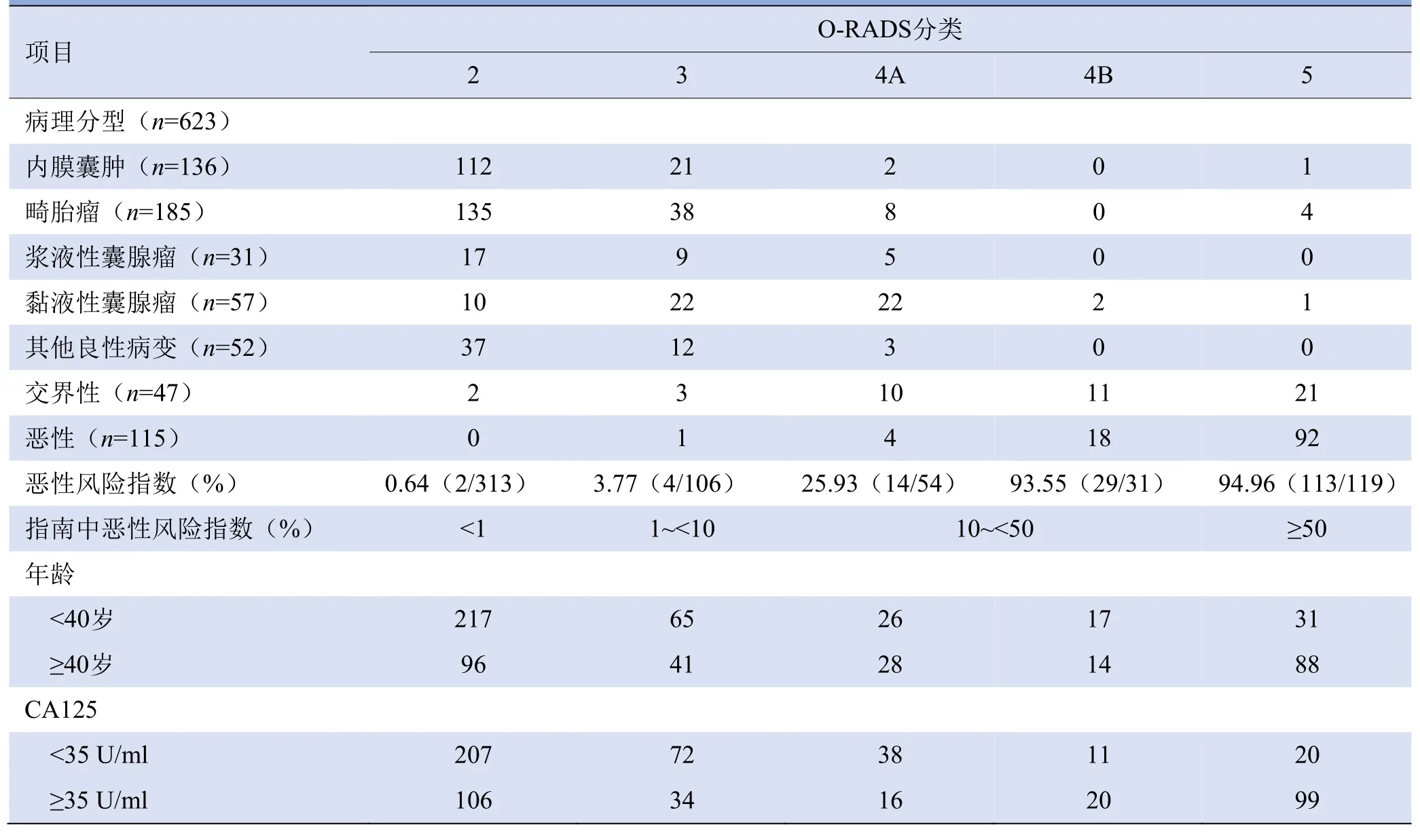
表1 不同临床情况下O-RADS分类及恶性风险指数(例)
2.3 O-RADS、CA125及两者联合诊断卵巢肿瘤的效能 O-RADS单独评价与联合CA125诊断的敏感度差异无统计学意义(χ2=1.552,P=0.213),均优于CA125(χ2=23.484、14.594,P均<0.001);而联合诊断的特异度均高于单独O-RADS和CA125(χ2=18.553、131.827,P均<0.001),见表2。

表2 O-RADS、CA125及两者联合预测诊断卵巢肿瘤的效能
2.4 O-RADS、CA125联合诊断的ROC曲线 联合诊断、单独O-RADS、CA125诊断的AUC依次降低(联合诊断与O-RADS:Z=2.241,P=0.025;联合诊断与CA125:Z=11.212,P<0.001;O-RADS与CA125:Z=9.155,P<0.001)(图1)。
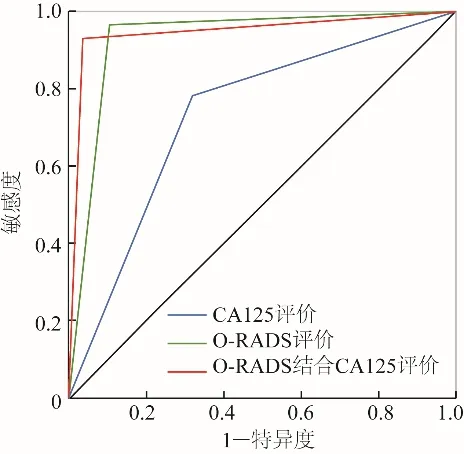
图1 O-RADS、CA125及两者联合诊断鉴别卵巢肿瘤良恶性的ROC曲线
3 讨论
3.1 研究结果及临床意义 本研究发现O-RADS评价系统具有较高的敏感度和特异度。结合既往研究,O-RADS的敏感度明显高于其他模型[9],能明显提高恶性肿瘤的检出率。另外,O-RADS对交界性肿瘤较敏感,大多数交界性肿瘤分期较早[10],有助于提高患者的生存质量,尤其是需要保留生育功能的年轻女性。同时,O-RADS分层管理要求>3分者需结合血清肿瘤标志物和咨询或转诊至妇科肿瘤专家,有助于临床医师确定是否需要随访、保守治疗或手术切除,规范治疗流程。
本研究发现O-RADS评分为4B和5的患者恶性风险均高达90%以上,而单用O-RADS体系对恶性肿瘤诊断特异度优势不明显的原因,主要是O-RADS 4A中部分图像特征(表现为≥10 cm的多房囊性包块及单房含实性成分且CS评分为1~2分)倾向于良性,其恶性风险明显低于4B和5的患者。而针对这一部分患者,O-RADS联合CA125的诊断模式能去除82.50%的假阳性,显著提高诊断特异性。因此,本研究提出仅4A结合CA125的联合诊断模型,结果显示,与O-RADS单独评价相比,联合诊断的特异度和阳性预测值均明显提高,进一步提高了对卵巢肿瘤良恶性的鉴别诊断。
3.2 不同模型在卵巢肿瘤中的应用价值 超声评估的有效性和重复性对附件包块的术前诊断至关重要,实际运用中模型众多,缺乏统一。其中,国际卵巢分析小组提出的模型因常搭载在GE超声仪器中,且可以在其官网上在线或下载手机应用程序计算而被广泛应用,GI-RADS因操作简单也得到认可。不同模型的使用范围因所需参数不同而存在区别:①简单模型[2]只能评价单独有恶性或良性特征的附件包块,而补充模型[11]将恶性特征和良性特征均为0,或者并存的情况细化分层,能有效评价之前无法确定的包块。②回归模型[3]需要采集既往病史、激素治疗情况、年龄及是否有触痛,无法单独依赖图像进行评估。③ADNEX模型[4]需要区分是否为专科医院,多房必须超过10个囊腔,年龄在14~100岁,典型良性病变CA125升高影响有效评估。④GI-RADS[5]无法有效评价不含厚分隔的多房囊性包块及无法获取血流阻力指数的包块。⑤O-RADS[7]几乎囊括了所有包块可能出现的图像特征,且无年龄限制,无论是否结合CA125都有较高的诊断效能。
无论大小、形态、血流分布情况,所有模型对单纯囊肿、输卵管积液、典型内膜囊肿、畸胎瘤均诊断一致为良性;而具有实性回声、多个乳头状突起、腹水及丰富血流信号表现均诊断为恶性;不同模型的差别均体现在中间不典型图像的区分及其他临床指标的纳入。不同于O-RADS和GI-RADS,其他模型均未将良性与可疑恶性图像单独分层评价,容易将畸胎瘤(无声影的高回声)、内膜囊肿(非纯液性暗区内见片状高回声,CS 1分)内高回声归为实性成分,造成假阳性。年龄是卵巢癌的独立风险因素,只有回归模型和ADNEX模型计算需要年龄,评价中呈现相似的图像恶性风险随着年龄增长而增加,而O-RADS则体现在分层管理中绝经前/后随访的差异。GI-RADS将良性病变分开,且6个恶性特征简单易操作,但是血流阻力指数因受到机器敏感度、包块深度、呼吸运动等影响,无法获取或个体差异明显。而O-RADS分层细致且血流评分相对直观、偏差小,有助于减少或消除超声报告中的歧义,提高不同检查者间的诊断一致性[12]。
3.3 O-RADS的应用及展望 O-RADS作为最新的超声评价模型,具有较高的敏感度,而特异度稍低。Basha等[12]研究发现,O-RADS的敏感度明显优于简单模型与GI-RADS,三者间特异度无明显差异。而将多房囊肿和单房含实性且CS 1~2分归为4A,当4A且CA125<35 U/ml 时恶性风险降为13.16%,4A 且CA125≥35 U/ml时将为56.25%,特异度及准确率明显提高。Cao等[13]将O-RADS 4中光滑的多房囊肿和实性成分归为4A,恶性风险率为17.02%,4B为42.57%,当截断值变为>4A后,准确率也明显升高。2个研究均表明4类可进一步分层降级以提高诊断准确性,而节点的设定因病理类型分布不同而略有差别,未来需要通过多中心、大样本研究提出最佳分割特征。
O-RADS对不同评分的图像特征进行了详细的描述,有助于规范超声医师对包块的测量及描述,在无经验者与专家间诊断效能高度一致[12-13]。与此同时,由于其分类信息较以往模型细致,评价者需要熟悉并掌握良恶性图像的特征,否则无法正确评价典型良性病变,给患者增加不必要的手术。另外,由于本研究为回顾性研究,存储的静态图像质量会因机器不同、血流敏感性设定不同、患者肠气干扰等而与实际情况存在偏差,影响评估。未来需要做一些前瞻性研究,进一步验证该评价系统的诊断价值。
