直肠癌DCE-MRI 纹理分析预测Ki67 表达状态的价值
2022-12-10刘宇卉陈安良武敬君刘铁利刘爱连
刘宇卉,陈安良,武敬君,刘铁利,赵 莹,王 凯,刘爱连
(1.大连医科大学医学影像学院,辽宁 大连 116044;2.大连医科大学附属第一医院放射科,辽宁 大连 116011)
分子生物学标记物近年来被广泛应用在评估直肠癌术前辅助治疗病理反应和预后预测中[1-5]。直肠癌的发生、发展与肠上皮细胞的凋亡、增殖速度密切相关,增殖细胞核抗原Ki67 是一种非组蛋白核蛋白,在除细胞静止期(G0 期)以外的细胞周期的每个活跃期表达,也是分裂细胞中核糖体合成的重要因素,Ki67 蛋白被蛋白酶降解后半衰期缩短,其能用来判断肿瘤细胞的增殖活性[6],有研究证实Ki67 在直肠癌及其他癌症中的表达可在一定程度上反映患者的预后[7]。目前Ki67 的检测主要依赖于手术切除样品或活检的免疫组化分析,考虑到肿瘤的异质性,特别是较大的肿瘤,这种方法有一定的局限性。动态对比增强磁共振成像(Dynamic contrast-enhanced magnetic resonance imaging,DCE-MRI)技术是检出直肠病变的高敏感技术,可从形态学及血流动力学等方面探索癌灶内部的生物学特征,反映肿瘤血管生成的程度以及血管通透性。直肠癌肿瘤新生血管的血管壁成熟性差、动静脉血管间相交通、基底膜完整且血管通透性高等特点,可造成直肠癌微循环不均衡现象的出现,而DCE-MRI 评价直肠癌微循环的病理基础与此存在关联,间接反映组织生物学行为。但目前仍缺少DCE-MRl 纹理分析在直肠癌中的研究。本研究应用DCE-MRI 纹理分析方法得出DCE-MRI 纹理特征参数与直肠癌中生物学标志物Ki67 的可能关联,在术前预测直肠癌Ki67 表达状态,从而为直肠癌的治疗以及术后评估等提供更多的参考。
1 材料与方法
1.1 研究对象
回顾性收集2015 年9 月—2020 年3 月于大连医科大学附属第一医院行盆腔DCE-MRI 扫描的原发性直肠腺癌患者91 例。其中,Ki67 高表达组56例(男42例,女14例,平均年龄(66.29±10.92)岁),低表达组35 例(男25例,女10例,平均年龄(63.69±8.29)岁)。本研究经过大连医科大学附属第一医院医学伦理委员会批准(批准文号:PJ-KSKY-2019-49),免除知情同意。纳入标准:①经手术病理检查结合分子生物学标记物Ki67 的免疫组化检测,病理为直肠腺癌;②MRI 检查后1 月内进行手术治疗,未经任何免疫治疗及新辅助放化疗;③临床、病理、影像资料完整。排除标准:①MRI 检查前已行抗癌治疗或手术治疗;②病理类型非腺癌(包含腺鳞癌、鳞状细胞癌、印戒细胞癌等);③图像质量不佳或病灶显示不佳,不利于感兴趣区的勾画;④有远隔转移,不易手术。
1.2 扫描方法及参数
评估患者无MRI 检查禁忌及相关病史后,嘱咐患者于检查前3 d 低脂、少渣饮食,检查前6 h 禁食水。选用3.0T MR(Signa HDxt,GE MedicalSystems,Milwaukee,WI,USA)扫描仪,配体部8 通道相控阵表面线圈,指导患者采取仰卧位。自两侧骶髂关节连线水平至耻骨联合下缘水平范围内,对患者行盆腔扫描,扫描序列为常规DWI、T2WI、DCE-MRI。扫描参数见表1,扫描启动时间是1 期之后,灌注期相39,本研究选用的对比剂为GE 药业生产的钆双胺注射液(Gd-DTPA-BMA,欧乃影),通过静脉注射的方式,按照0.1 mmol/kg 的剂量,以2.5 mL/s 的速率,将对比剂注入肘静脉,注射后用20 mL 生理盐水冲管。

表1 3.0T MRI 扫描序列及参数
1.3 图像分析与测量
将DCE-MRI 图像导入GE Functool 4.6 工作站后,通过GenIQ 软件进一步完成DCE-MRI 的后处理,以DICOM 格式导出转运常数(Ktrans)、速率常数(Kep)、血管外细胞间隙体积百分数(Ve)图像,并导入ITK-SNAP 3.6 软件(https://www.softpedia.com/get/Science-CAD/itk-Snap.shtml),由两名影像诊断医师(年资分别为8 年和5 年)勾画病灶,纹理分析过程中,采用双盲法在每例患者的DCE-MRI Ktrans、Kep、Ve后处理图像中,选取包括病灶的最佳、最大层面和相邻上下两个层面增厚肠壁的边缘,并将3 个层面的感兴趣区(Region of interest,ROI)融合成1 个容积感兴趣区(Volume of interest,VOI),包含肿瘤坏死、出血及钙化区域,并尽量避开周围脂肪及内容物,分别测量并记录Ki67 高低表达组基于Ktrans、Kep、Ve后处理图像的纹理特征参数,包括最大强度值(Max intensity)、中等强度(Median intensity)、均值(Meanvalue)、最小强度值(Min intensity)、偏度(Skewness)、峰度(Kurtosis)、熵(Entropy)、能量(Energy)、群集显著性(Cluster prominence)、集群阴影(Cluster shade)、相关性(Correlation)、惯性矩(Inertia)(图1)。
1.4 Ki67 免疫组化蛋白检测
本研究中所有直肠癌患者的手术病理标本均由本院病理科医生统一检测完成。
Ki67 阳性表达定位于细胞核,于100 倍光镜下任选5 个视野进行观察,同时分别计数5 个视野中100 个细胞的阳性细胞数。阳性细胞数的判定标准如下:<5%为(-),5%~<25%为(+),25%~<50%为(++),50%~<75%为(+++),≥75%为(++++)。当P53 的阳性细胞数<50%时,属于低表达组,反之为高表达组[8-9](图2)。
1.5 统计学分析
运用SPSS 23.0 统计学软件进行相关数据的统计分析。采用组内相关系数(Intraclass correlation coefficients,ICC)对两位观察者所测数据的一致性进行检测,当ICC值>0.75,即一致性良好时,采用高年资医师测量数据进行后续比较。比较两位观察者所测数据的正态性,采用Shapiro-Wilk 正态性检验。数据满足正态分布时,采用独立样本t 检验,统计描述为均数±标准差(),统计量为t值;反之,采用Mann-Whitney U 检验,统计描述为中位数(25%,75%),统计量为Z值。应用受试者工作特征(Receiver operating characteristic,ROC)曲线分析DCEMRI 的有统计学差异的纹理特征参数的鉴别效能、灵敏度、特异度及95%置信区间(Confidence interval,CI);应用二元Logistics 回归分析联合DCEMRI 纹理特征参数进行效能分析,用Delong 检验对各单一参数模型的AUC 进行比较,并对联合模型AUC 与各单一参数模型的AUC 进行比较,P<0.05时差异有统计学意义。
2 结果
2.1 一般资料
直肠癌患者Ki67 低表达组和高表达组的临床一般资料及比较结果见表2。

表2 Ki67、P53 低表达组和高表达组患者的临床一般资料
2.2 两名观察者测量数据的一致性检验
观察者一和观察者二所测量的DCE-MRI 纹理特征参 数Max intensity、Median intensity、Mean val ue、Min intensity、Skewness、Kurtosis、Entropy、Energy、Cluster prominence、Cluster shade、Correlation、Inertia的ICC值分别 为0.997、0.964、0.948、0.874、0.992、0.893、0.996、0.903、0.995、0.994、0.993、0.986,一 致性良好,ICC值均>0.75。
2.3 Ki67 两组纹理特征参数的测量结果比较
Ki67 高表达组纹理参数Max intensityKtrans(1.48(0.99,2.71))、EnergyKtrans(4.76±1.45)、Maxi ntensityKep(10.01±6.31)、EnergyKep(3.28±2.44)、EntropyKep(5.28(4.80,5.52))值均大于低表达组Max intensityKtrans(0.92(0.53,1.34))、EnergyKtrans(1.90±2.49)、Max intensityKep(7.30±5.35)、EnergyKep(1.66±2.17)、EntropyKep(4.65(4.14,5.25)),差异有统计学意义(P<0.05)(表3)。

表3 Ki67 低表达组和高表达组的纹理特征参数的测量结果比较
2.4 Ki67 高低表达组纹理特征参数的效能分析
通过对Ktrans、Ve、Kep3 个后处理图像的纹理特征参数进行效能分析,得到有统计学差异的纹理特征参数的曲线下面积(AUC)分别为0.758(Max intensityKtrans)、0.826(EnergyKtrans)、0.650(Max intensityKep)、0.748(EnergyKep)、0.716(EntropyKep),其中单个参数诊断效能最高的是EnergyKtrans,AUC 为0.826。联合有统计学差异的纹理特征参数得到联合诊断效能,AUC 为0.947,灵敏度91.1%(表4,图3)。经Delong 检验,Ki67 两组间差异有统计学意义的纹理特征参数联合模型的AUC 大于单一参数模型Max intensityKtrans、EnergyKtrans、Max intensityKep、EnergyKep、EntropyKep的AUC,差异有统计学意义(P<0.05)(表5)。

表4 Ki67 低表达组和高表达组纹理特征参数的效能分析
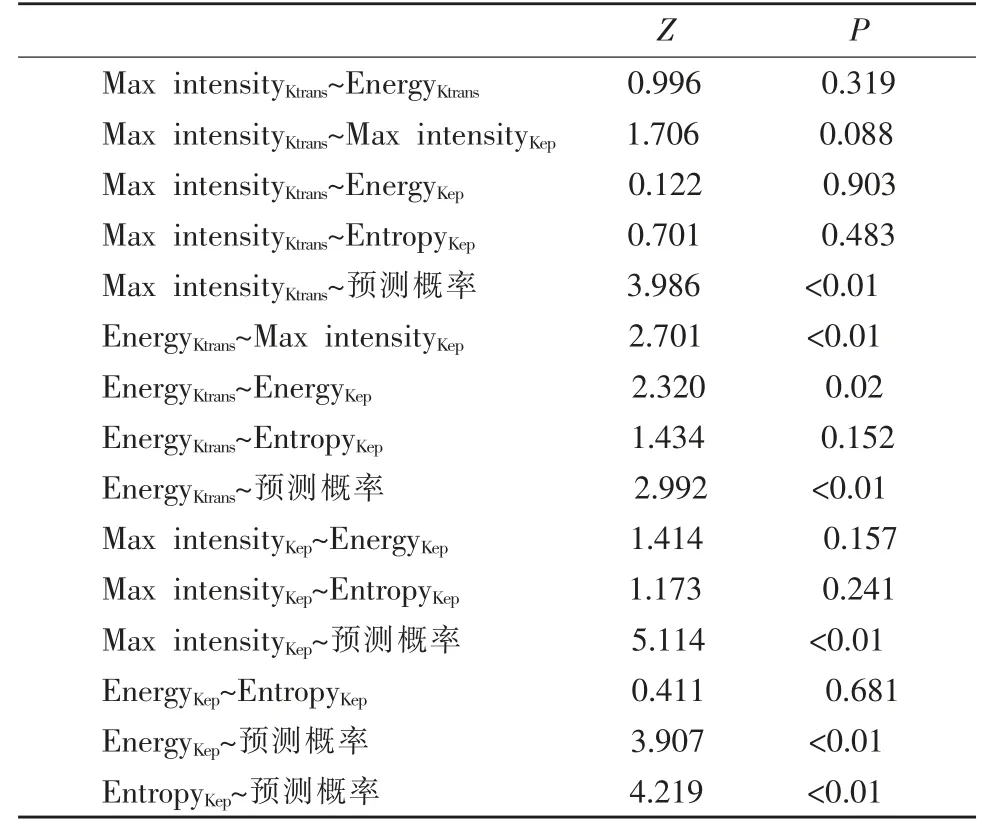
表5 Ki67 两组间参数联合和单一参数经Delong 检验结果比较
采用Logistic 回归分析,将Ki67 两组间差异有统计学意义的纹理特征参数依据加权系数进行联合,回归模型:-15.978+1.228×Max intensityKtrans+2.110×EnergyKtrans-0.102×Max intensityKep-1.443×EnergyKep+2.531×EntropyKep。
3 讨论
近年来DCE-MRI 在直肠癌诊疗中的得到广泛应用,它通过分析对比剂进出肿瘤的过程,提供肿瘤组织血管特性的定量指标,是一种血流动力学和形态学相结合的功能性影像技术[10]。在常规MRI 和DCE-MRI 的基础上利用人工智能方法分析直肠癌肿瘤异质性[11-13],挖掘直肠癌病变信息,使DCE-MRI 数据能够量化的反映组织灌注和毛细血管通透性等病理特征,多用于临床病例的智能诊断、评估和预测等研究[14]。
本研究采用纹理分析方法研究直肠癌Ki67 表达与DCE-MRI 定量成像特征之间的潜在联系,研究结果发现Ki67 高表达组的Max intensity值相对更高,表明其ROI 的强度分布特征更强,表达程度与体素值呈正相关。Ki67 高表达组Energy、Entropy高于低表达组,强度水平分布的均匀性可通过Energy 测量获得,如果能量值较高值为高,那么分布会有较小数量的强度水平;强度水平上的系数值分布的随机性则是通过Entropy 测量获得,如果Entropy的值高,则该分布会出现在图像中更多高强度水平之间,在简单的图像中,Entropy值较低,而在复杂图像中,Entropy值较高。以上结果说明Ki67 在肿瘤细胞中高表达时,随肿瘤细胞分化程度降低,肿瘤纹理特性更强,图像纹理信息量越大,从而潜在地描述了肿瘤的异质性,揭示了发生Ki67 高表达组的直肠癌肿瘤与正常肠壁组织的病理生理上的改变,推测可能与肿瘤组织的血供改变、出血坏死区域分布、乏氧状态甚至基因改变等因素相关[15-17]。在胰腺癌和乳腺癌中均有研究表明,病理分级越高的肿瘤可表现出更高的Entropy值和更高的Max intensity值,且表明乳腺癌Ki67 低表达组的Energy、Entropy值均小于Ki67 高表达组,与本研究的结果相似[18-19]。
这些特征的表示表明Ki67 高表达的病变更有可能是异质性的,肿瘤的异质性一方面与血管外细胞外基质、血管生成和细胞结构有关,另一方面还与肿瘤内出血和坏死区域的不均匀不一致的变化特点有关,这可以解释为Ki67 高表达者具有更多的生物增殖特性,摄取的体素更均匀,像素灰度频率的分布特征更高[20]。然而,这些发现需要在未来通过更多的研究进一步评估。
本研究的主要不足有以下两点:一是样本量相对较小,选择的研究方式为回顾性研究,因此最终获得的研究成果可能存在一定的偏差,今后的研究中应增大样本量,保证研究的科学性、可靠性,同时开展前瞻性研究,结果更有说服力;二是结合肿瘤相邻上下两个层面以及最大层面的情况可以看出,通过人工的方式对ROI 进行勾画,可能存在主观性判断的问题。
本研究结果显示,当仅考虑直肠癌组织的某个纹理特征参数时,多数情况下其评估价值有限,而把Ki67 高低表达组有统计学差异的纹理特征参数联合分析,其诊断效能提升至0.947,此时判断Ki67 表达的灵敏度为91.1%,因此利用有组间差异的纹理特征参数进行联合分析有望作为预测直肠癌Ki67表达状态的一个良好的影像学方法。
