苦杏仁苷对模型大鼠瘀热互结证的改善作用*
2022-12-08黄全元谢旭华
黄全元,杨 斌,罗 俊,谢旭华,卢 晓,以 敏
(1.广西医科大学第一附属医院,广西 南宁 530021;2.广西医科大学,广西 南宁 530021;3.广西壮族自治区柳州市工人医院,广西 柳州 545005)
瘀热互结证是指火热毒邪或兼夹痰湿壅于血分,搏血为瘀,致血热、血瘀两种病因互为搏结、相合为患而形成的一种证型[1]。瘀热互结于皮肤,可见皮肤黏膜瘀斑、红肿现象,体温升高,凝血功能混乱;于肝脏,则导致肝脏功能受损[2-3]。苦杏仁苷是杏、桃、李子、苹果、山楂、枇杷等蔷薇科植物种仁中普遍存在的含氰基糖苷化合物[4],能调血脂,增强巨噬细胞作用,以减少斑块数量,增加正常血管腔面积,抑制反馈性管腔增大[5]。苦杏仁苷可减轻肾损伤[6],改善糖尿病肾病模型大鼠的过度氧化应激、炎症和肾组织纤维化[7],还可减轻慢性胰腺炎模型大鼠胰腺纤维化程度,抑制白细胞介素1β(IL-1β)诱导的终板软骨细胞变性,改善微循环并缓解血液停滞[8]。为此,本研究中利用大鼠瘀热互结证模型,观察不同剂量苦杏仁苷对其中医体征、给药后不同时间段的体温、血小板、凝血指标、肝肾功能等的影响。现报道如下。
1 材料与方法
1.1 仪器、试药与动物
仪器:CA-1500型全自动凝血分析仪[希森美康医用电子(上海)有限公司];XSP-8CE型生物光学显微镜(上海长方光学仪器有限公司);7100型全自动血生化分析仪(日本Hitachi公司);MC-347型电子体温计[欧姆龙(大连)有限公司];SHANDON Excelsion型高级自动组织脱水机(英国Shandon公司);Thermo-Histocentre3型全自动组织包埋机(美国Thermo公司);Leica-RM2135型高级组织切片机(德国Leica公司);漩涡混合器(上海跃进医疗器械厂)。
试药:苦杏仁苷(成都曼斯特生物科技有限公司,批号为MUST-17042810,纯度≥98%);阿司匹林肠溶片(广东南国药业有限公司,批号为170903);角叉菜胶(美国Sigma公司,批号为CAS9000-07-1);高活性干酵母(河北马利食品有限公司,批号为20170704);水合氯醛(成都市科隆化学品有限公司,批号为CAS302-17-0);氯化钠注射液(广西裕源药业有限公司,批号为R17080102);白细胞介素6(IL-6)试剂盒(批号为T12017846)、肿瘤坏死因子-α(TNF-α)试剂盒(批号为S24017847),均购自武汉华美生物工程有限公司;丙二醛(MDA)试剂盒(批号为20180412)、超氧化物歧化酶(SOD)试剂盒(批号为20180412),均购自南京建成生物工程研究所;血管内皮生长因子(VEGF)试剂盒(上海源叶生物科技有限公司,批号为E20180501A);Y9醇溶性伊红(上海国药集团化学试剂有限公司);磷酸盐缓冲液(PBS,福州迈新生物技术开发有限公司)。
动物:SPF级SD大鼠50只,雄性,8周,体质量(210±20)g,由广西医科大学实验动物中心提供,实验动物使用许可证号SYXK(桂)2014-0003,实验动物生产许可证号SCXK(桂)2014-0002。本实验经广西医科大学实验动物中心伦理委员会批准,于广西医科大学实验动物中心[温度(22±1)℃,相对湿度40%~70%]饲养及实验。
1.2 方法
1.2.1 分组、给药与建模
将50只SD大鼠分为正常对照组(尾静脉注射等体积生理盐水)、模型组(尾静脉注射等体积生理盐水)、阿司匹林组(灌胃100 mg/kg)及苦杏仁苷高、低剂量组(分别尾静脉注射40 mg/kg、20 mg/kg),各10只。给予相应药物或生理盐水,每天1次,连续7 d。给药第4天时,腹腔注射1%角叉菜胶溶液(每天1次,连续3 d),给药第7天时皮下注射20%高活性干酵母溶液(10 mL/kg),以复制大鼠瘀热互结证模型。
1.2.2 瘀热互结证表征
注射干酵母溶液后6 h时,将大鼠置冷光源下观察并评分。中医表征评分标准:舌质、眼睛、爪甲、尾部无明显变化记0分;表现微红、红润、瘀斑分别记1,2,3分;舌质红紫、眼睛红紫、爪甲红紫色、尾部出现明显瘀斑记4分。
1.2.3 体温测定
于注射干酵母溶液前2 h(基础体温)时及注射后1,2,3,4,5,6,7 h时测定大鼠体温[9-10],并计算各时点体温与基础体温的差值。
1.2.4凝血指标检测
注射干酵母溶液后7 h时,腹腔注射10%水合氯醛麻醉大鼠,腹主动脉取血5 mL,放入抗凝管(含肝素),摇匀,测定血小板计数(PLT)水平;腹主动脉取血1.5 mL,并缓慢注入0.5 mL含109 mmol/L枸橼酸钠溶液的塑料管中并充分混匀,3 000 r/min离心15 min,取血浆,测定凝血四项指标[凝血酶原时间(PT)、活化部分凝血活酶时间(APTT)、凝血酶时间(TT)及纤维蛋白原(Fib)]。
1.2.5 肝肾功能指标检测
注射干酵母溶液后7 h时,腹腔注射10%水合氯醛麻醉大鼠,腹主动脉取血5 mL,室温下放置2 h,10 000 r/min离心10 min,取上清液,测定碱性磷酸酶(ALP)、天门冬氨酸氨基转移酶(AST)、丙氨酸氨基转移酶(ALT)、血尿酸(UA)、尿素氮(BUN)、肌酐(CREA)的水平。
1.2.6 肾脏病理形态观察
取血后,迅速对大鼠剖腹,取两侧肾脏,用滤纸吸干肾表面血液后,去包膜称定质量并计算肾脏指数,固定于10%中性福尔马林液(经焦碳酸二乙酯处理)中浸泡1 h,常规脱水,石蜡包埋,切片(4~6 μm厚),用苏木素-伊红(HE)染色。采用显微镜采集病理图像并分析,观察肾小球、间质血管是否充盈;系膜细胞、内皮细胞、肾小管结构是否清晰;细胞质丰富、红染情况;间质血管是否有扩张、淤血,评分标准见表1。

表1 瘀热互结证肾脏病理形态等级评分标准Tab.1 Rating criteria of renal pathology of heat stagnation and blood stasis syndrome
1.3 统计学处理
2 结果
2.1 瘀热互结证表征评分
与正常对照组比较,模型组大鼠中医表征评分显著升高(P<0.05);与模型组比较,苦杏仁苷高、低剂量组和阿司匹林组大鼠中医表征评分均显著降低(P<0.05)。详见表2。
表2 各组大鼠中医表征及肾脏指数和病理评分比较(±s,n=10)Tab.2 Comparison of TCM symptoms,kidney index and pathological score of rats in each group(±s,n=10)
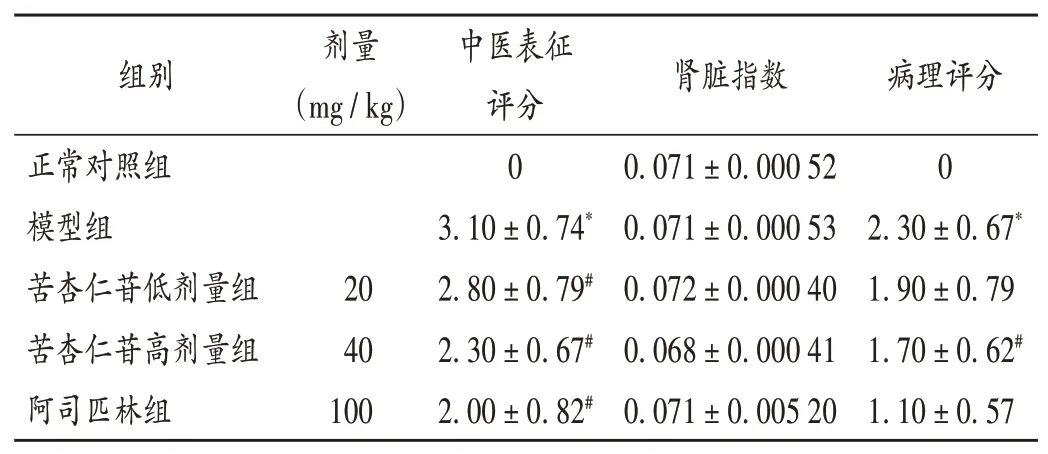
表2 各组大鼠中医表征及肾脏指数和病理评分比较(±s,n=10)Tab.2 Comparison of TCM symptoms,kidney index and pathological score of rats in each group(±s,n=10)
注:与正常对照组比较,*P<0.05;与模型组比较,#P<0.05。表3至表5同。Note:Compared with those in the normal control group,*P<0.05;compared with those in the model group,#P<0.05(for Tab.2-5).
?
2.2 体温
正常对照组大鼠体温变化不大,温度均差<0.5℃。与正常对照组比较,模型组大鼠注射干酵母溶液后2,3,4,5,6,7 h时的体温显著升高(P<0.05);与模型组比较,阿司匹林组、苦杏仁苷高、低剂量组大鼠体温在各时间点的变化幅度均有不同程度降低。详见表3。
表3 各组大鼠体温变化比较(±s,℃,n=10)Tab.3 Comparison of temperature changes of rats in each group(±s,℃,n=10)
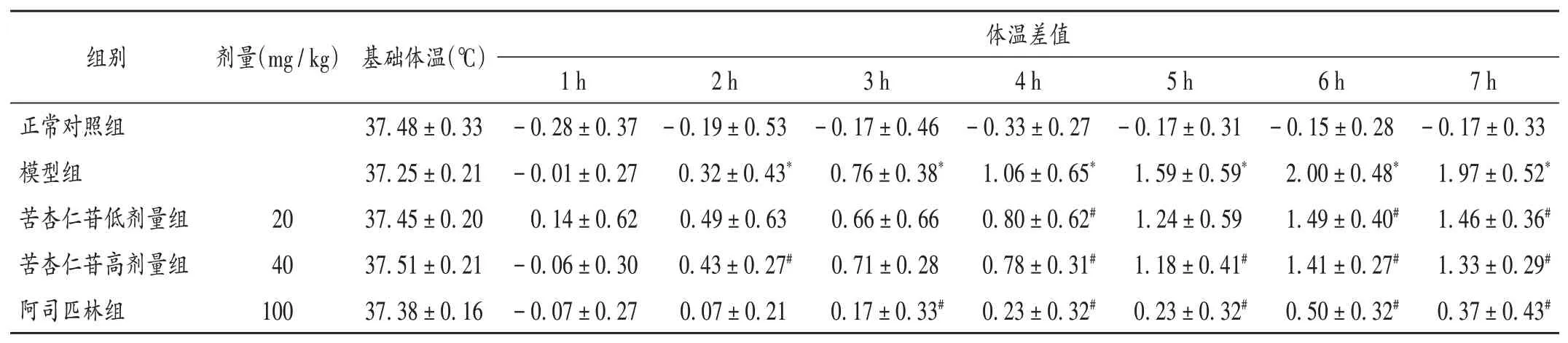
表3 各组大鼠体温变化比较(±s,℃,n=10)Tab.3 Comparison of temperature changes of rats in each group(±s,℃,n=10)
?
2.3 肾脏病理形态变化
各组大鼠肾脏指数无显著差异(P>0.05)。与模型组比较,苦杏仁苷高剂量组大鼠病理评分显著降低(P<0.05)。详见表2和图1。
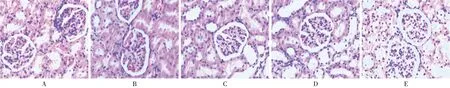
图1 大鼠肾脏病理形态(HE,×200)A.Normal control group B.Model group C.Low-dose amygdalin group D.High-dose amygdalin group E.Aspirin group
2.4 凝血指标
与正常对照组比较,模型组大鼠PLT和Fib水平均显著升高,APTT,PT,TT均显著缩短(P<0.05);与模型组比较,苦杏仁苷低剂量组大鼠APTT,PT,TT均显著延长(P<0.05),苦杏仁苷高剂量组大鼠PLT和Fib水平均显著降低,APTT,PT,TT均显著延长,阿司匹林组大鼠PLT水平显著降低,APTT,PT,TT均显著延长(P<0.05)。详见表4。
Fig.1 Pathological morphology of rat's kidney(HE,×200)表4各组大鼠凝血指标比较(±s,n=10)Tab.4 Comparison of blood coagulation indexes of rats in each group(±s,n=10)

Fig.1 Pathological morphology of rat's kidney(HE,×200)表4各组大鼠凝血指标比较(±s,n=10)Tab.4 Comparison of blood coagulation indexes of rats in each group(±s,n=10)
?
2.5 肝肾功能指标
与正常对照组比较,模型组大鼠ALT,AST,BUN,CREA水平均显著升高(P<0.05);与模型组比较,苦杏仁苷低剂量组大鼠ALT和CREA水平均显著降低,苦杏仁苷高剂量组大鼠AST,BUN和CREA水平均显著降低(P<0.05);阿司匹林组大鼠BUN和CREA水平均显著降低(P<0.05)。详见表5。
表5 各组大鼠肝肾功能指标比较(±s,n=10)Tab.5 Comparison of liver and kidney function indexes of rats in each group(±s,n=10)
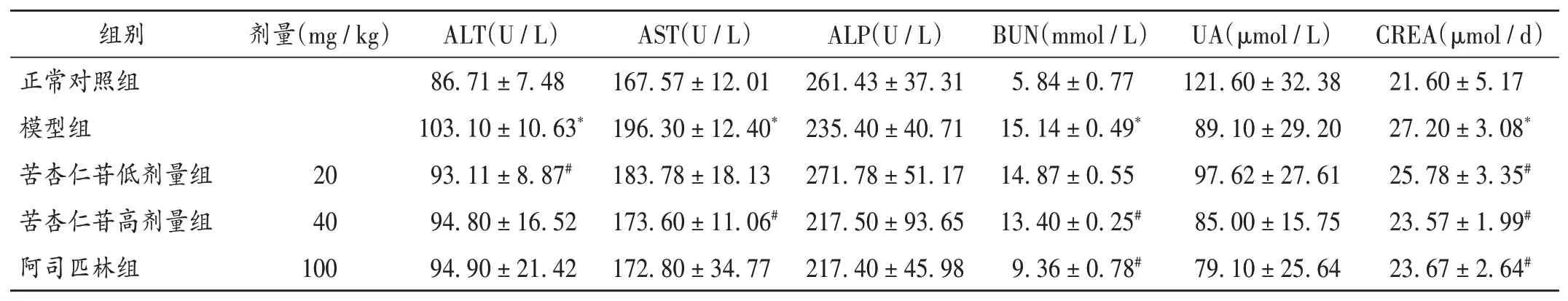
表5 各组大鼠肝肾功能指标比较(±s,n=10)Tab.5 Comparison of liver and kidney function indexes of rats in each group(±s,n=10)
?
3 讨论
本研究中,瘀热互结证是由角叉菜胶的“致瘀”和干酵母的“致热”作用,于营血、脉络处相互搏结,相结为患,致使全身多个脏腑受损,形成新的特征性复合疾病大鼠模型。中医瘀热互结证相关疾病包括心脑血管疾病、血栓性疾病、内脏器官功能障碍、血液系统疾病、传染性疾病等。阿司匹林不仅具有解热作用,还能通过抑制环氧合酶抗炎,同时减少血小板中血栓素A2的生成,治疗瘀热互结证的“瘀”和“热”。瘀热互结证临床表现包括:1)体温升高;2)舌质呈红紫色、舌下脉络肉眼可见变粗长,舌体或舌边有瘀斑出现;3)多个部位有深紫、暗红或鲜红色血液流出;4)皮肤、指甲可见瘀点、瘀斑;5)出现卷缩、烦躁不安及谵语、神昏等精神异常;6)实验室检查指标,PLT增多,肝肾功能异常,血液黏度增高,肾脏病理性损伤,血液流变学指标异常等[11-16]。
本研究中,模型组大鼠中医表征评分明显高于正常对照组,且其体温较正常对照组明显升高,说明大鼠瘀热互结证模型复制成功。推测苦杏仁苷的解热作用与其减少炎性因子IL-6和TNF-α,从而相应降低下丘脑视前区附近前列腺素E2的分布,下丘脑体温调节中枢下调体温调定点,减少产热有关[17-18]。
淤血的形成与PLT和凝血四项指标变化有关[19]。本研究中,与正常对照组比较,模型组大鼠PLT和Fib水平升高,PT,TT,APTT均缩短;与模型组比较,苦杏仁苷高、低剂量组大鼠PLT和Fib水平均降低,PT,TT,APTT均延长。表明苦杏仁苷有助于瘀热互结证模型大鼠PLT,PT,TT,APTT和Fib水平恢复正常。ZHANG等[20]研究发现,苦杏仁苷可改善微循环障碍,降低血液黏度。WANG等[21]及KUNG等[22]研究发现苦杏仁苷可降低核因子(NF)-κB水平。
瘀热互结证病机为湿热瘀毒互结,侵袭于肝胆,以致肝胆疏泄功能失常,而致肝炎、胆石症等肝胆疾病,最易表现为肝胆湿热。瘀热阻滞在肾和膀胱,导致蓄血,肾气不固,水府热结、气化失司,亦可出现小便不利,甚至少尿,无尿或尿中带血,如流行性出血热并急性肾功能衰竭[23]。本研究中,各组大鼠肾脏指数无明显变化,模型组大鼠肝肾功能异常,肾脏有病理性损伤,苦杏仁苷高、低剂量组上述指标均有改善。推测苦杏仁苷可通过细胞信号通路改变组织细胞的膜稳定性以及细胞核转录功能等,提高了实质细胞在瘀热互结证下缺血缺氧的耐受能力,同时通过改善血液循环功能,促进血液的正常流动和缺氧缺血的恢复,从而保护肝肾细胞。
综上所述,苦杏仁苷对模型大鼠瘀热互结证具有良好的改善作用,可降低大鼠体温,改善瘀斑等体征及保护肾功能。
