牦牛睾丸发育过程中INHβB、FSHR和LHR的表达差异性分析
2022-12-07龙亚丽王军乾潘阳阳马文斌王靖雷余四九王立斌
龙亚丽,王军乾,潘阳阳,,王 萌,赵 凌,马文斌,张 虔,王靖雷,余四九,王立斌*
(1.甘肃农业大学动物医学院,甘肃兰州 730070;2.甘肃省牛羊胚胎工程技术研究中心,甘肃兰州 730070)
牦牛(Bosgrunniens)是分布在我国青藏高原的特有畜种(占世界牦牛总数的95%),生活在海拔2 500 m~5 000 m高寒低氧环境中,是当地牧民重要的生活物资来源。一般在放牧饲养条件下,公牦牛3岁~4岁以后才能达到性成熟,种用期限较短,严重制约着牦牛的繁殖率和出栏率。因此,明确牦牛睾丸发育与退化的分子调控机制,充分利用公牦牛的配种能力,对提高牦牛生产能力具有重要意义。
抑制素(inhibin,INH)是一种由性腺分泌的糖蛋白激素,由α和β两个亚基通过二硫键联结而成,主要有INHA(αβA)和INHB(αβB)两种形式[1]。INHβB作为评估睾丸组织功能正常与否的激素受体,是睾丸产生精子的主要标志,也是INH在雄性血清中存在的唯一形式[2];INHβB受垂体-性腺轴的反馈调节,影响生精上皮的功能[3];INHβB不仅可作为检查性腺功能正常与否的睾丸特异性标记物[4],也可作为精子发生的动力学标志物[5];其表达水平影响睾丸的体积的大小及精子的数量[6]。促卵泡素(follicle stimulating hormone,FSH)和促黄体素(luteinizing hormone,LH)是下丘脑-垂体-性腺轴中的重要神经内分泌产物,控制着类固醇激素的合成和配子的产生[7];FSH能够选择性刺激支持细胞分泌INHβB,LH则能够选择性地刺激睾丸间质细胞分泌INH[8]。在公畜中,FSH起着促进睾丸足细胞合成、分泌雄激素、刺激生精上皮发育和精子发生的作用[9],FSH与FSHR结合才能传递信号,因此激素反应的强度和靶点都受FSHR水平和细胞特异性表达的控制[10]。FSH通过与FSHR结合促进精子发生,同时FSHR起着激活性腺支持细胞的营养作用[11]。有研究表明,LH通过与LHR结合促进睾丸间质细胞分泌睾酮,促进精子的生成和成熟。LH对雄性第二性征的发生、类固醇的生成和配子的发生也起着重要的作用[12]。研究发现,竹鼠在敲除LHR后内外生殖器官明显萎缩,且可导致雄雌鼠的不孕不育[13-14]。
雄性动物睾丸发育过程中INH、FSH和LH三者之间存在互相调控作用,且在不同物种中,三者的调控存在差异,尚未有其在牦牛上的研究报道。本研究通过分析牦牛睾丸发育过程中INHβB、FSHR和LHR的表达差异,从表达水平和细胞定位两个层面为进一步阐明INH、FSH和LH在牦牛睾丸发育及精子生成中发挥的作用提供理论资料。
1 材料与方法
1.1 材料
1.1.1 主要试剂 INHβB抗体(abcam)、FSHR抗体(Ab-AF5242)、LHR抗体(bs-6431R)、二抗(Goat Anti-Rabbit IgG),北京博奥森生物技术有限公司产品;β-actin(13E5)Rabbit mAb,Cell Signaling公司产品;RNA提取试剂盒,Omega(北京)公司产品;GoscriptTMReverse Transcription System反转录试剂盒,Promega(美国)公司产品;DAB显色液,Invitro‐gen Zymed(美国)公司产品;免疫组化染色试剂盒,北京博奥森生物技术有限公司产品;GoTaq®Green Master Mix 2×,Promega(美国)公司产品。
1.1.2 主要仪器设备 实时荧光定量PCR仪,Roche生物科技公司产品;显微照相装置(DP71),日本Olympus公司产品;化学发光仪,上海Roche生物公司产品。
1.2 方法
1.2.1 样品采集 样品取自甘肃省甘南藏族自治州某屠宰场,采集不同年龄健康公牦牛的睾丸组织(1岁、3岁、5岁和9岁牦牛各3头)。颈动脉放血处死后,30 min内采集睾丸组织样品,生理盐水冲洗2次~3次,一部分用锡箔纸包裹保存于液氮中,用于RT-qPCR和Western blot试验;另一部分固定于40 mg/mL的多聚甲醛溶液中用于免疫组织化学试验。
1.2.2 引物设计 根据GenBank公布的牛INHβB、FSHR和LHR基因序列在NCBI Primer-Blast设计引物,所用引物均由生工生物工程(上海)有限公司合成,具体引物信息见表1。

表1 引物序列
1.2.3 RNA提取及基因表达水平检测 取出睾丸组织样品加液氮研碎,称取0.1 g组织放入离心管;用TransZol试剂盒提取组织中的RNA,置-80 ℃保存;使用反转录试剂盒将RNA反转录为cDNA,置-20 ℃保存。RT-qPCR反应体系:SYBR Premix ExTaqⅡ10 μL,cDNA 2 μL,上、下游引物各0.5 μL,ddH2O 7 μL;反应条件:95 ℃ 4 min;95 ℃ 30 s,58 ℃30 s,72 ℃ 15 s,72 ℃ 5 min;共40个循环,重复3次。根据每个样品的Ct值,用2-ΔΔct法分析基因的相对表达量。
1.2.4 蛋白质提取及其相对表达量的检测 加液氮研碎组织,称取0.1 g加入离心管;加入RIPA裂解缓冲液,置于摇床2 h;组织完全裂解后,4 ℃条件下12 000 r/min离心5 min,小心取上清液,置-80 ℃保存;蛋白变性:蛋白原液与4×蛋白上样缓冲液按3∶1混合,100 ℃ 10 min,置-20 ℃保存。配制100 mg/mL蛋白分离胶和50 mg/mL蛋白浓缩胶,进行十二烷基硫酸钠聚丙烯胺凝胶电泳(sodium dodecyl sulfate polyacrylamide gelelectrophoresis,SDS-PAGE);转膜;一抗孵育4 ℃冰箱过夜;二抗孵育;用化学发光仪扫描目的条带,利用Image J软件对INHβB、FSHR和LHR蛋白条带进行灰度值测定,根据灰度值分析INHβB、FSHR和LHR蛋白相对表达量(目的灰度数值/内参灰度数值)。
1.2.5 INHβB、FSHR和LHR的定位 用40 mg/mL多聚甲醛固定的睾丸组织样品,用纱布包裹置于流水中冲洗24 h,制作石蜡切片。切片、脱蜡,在pH 6.0的柠檬酸盐缓冲液(0.01 mol/L)中进行抗原修复,加热沸腾15 min,冷却至常温;免疫组化试剂盒(抗兔)孵育二抗;以二氨基联苯胺染色法用DAB显色液进行显色;苏木精复染、梯度酒精脱水、二甲苯透明、中性树脂封片,晾干。最后用IHC方法检测INHβB、FSHR和LHR在睾丸组织中的定位。
1.2.6 数据分析 单因素方差法分析3种基因与蛋白的相对表达水平,利用SPSS25.0处理数据,Graphpad prism8.3.0制图。
2 结果
2.1 INHβB、FSHR和LHR mRNA在不同年龄牦牛睾丸中的表达
INHβB、FSHR和LHRmRNA在不同年龄段牦牛睾丸中均有表达,且在不同年龄段之间其表达存在显著差异(P<0.05)。随着牦牛年龄的增长,INHβB、FSHR和LHR的相对表达量呈现先升高后降低的趋势,5岁时表达量最高,显著高于其他3个年龄段(图1)。

A.INHβB;B.FSHR;C.LHR;不同小写字母代表组间差异显著,P<0.05
2.2 INHβB、FSHR和LHR蛋白在不同年龄牦牛睾丸中的表达
INHβB、FSHR和LHR蛋白在不同年龄牦牛睾丸中均有表达(图2)。随着年龄的增长,3种受体蛋白的表达量均呈现先升高后降低的趋势(图3),5岁时达到最高,显著高于其他3个年龄段P<0.05);不同年龄蛋白表达量的变化趋势与基因表达的变化趋势相似。

1.1岁;2.3岁;3.5岁;4.9岁
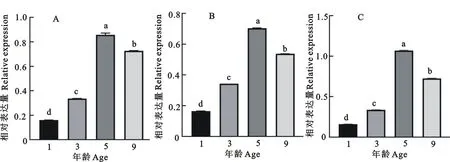
A.INHβB;B.FSHR;C.LHR;不同小写字母代表组间差异显著,P<0.05
2.3 INHβB、FSHR和LHR蛋白在不同年龄牦牛睾丸中的定位
INHβB、FSHR和LHR蛋白在不同年龄牦牛睾丸组织中均有表达,1岁主要表达于生精小管和初级精母细胞各级生精细胞;3岁随着睾丸发育体积和功能的不断完善,管腔明显较1岁时增大,主要表达于各级生精细胞、睾丸生精小管、支持细胞及睾丸间质细胞;5岁生精小管管腔较3岁进一步增大,主要表达于各级生精细胞、睾丸生精小管、支持细胞及睾丸间质细胞;9岁生精小管管腔增大,但此时生精小管管腔中的细胞分泌变少,且出现空泡化现象,主要表达于各级生精细胞、睾丸生精小管、支持细胞及睾丸间质细胞(图4、图5和图6)。
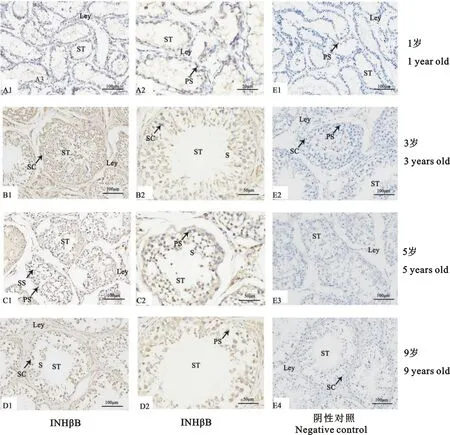
A1~D2.INHβB蛋白阳性表达;E1~E4.阴性对照;ST.生精小管;PS.初级精母细胞;SS.次级精母细胞;SC.睾丸支持细胞;Ley.睾丸间质细胞;S.精子

A3~D4.FSHR蛋白阳性表达;F1~F4.阴性对照;ST.生精小管; PS.初级精母细胞; SS.次级精母细胞; SC.睾丸支持细胞; Ley.睾丸间质细胞; S.精子
3 讨论
在雄性动物体内,促性腺激素INH、FSH和LH通过与受体结合影响雄性生殖。INH主要由睾丸分泌,通过血液循环调节动物的生殖活动,有INHβA和INHβB两种形式,由位于生精小管基底膜上的睾丸支持细胞分泌产生的INHβB是生长转化因子β家族中的一员,有支持精子发生的作用[15],被认为是雄性支持细胞功能及生精功能的潜在标志物[16],INHβB水平的迅速增加与支持细胞的增加呈正相关影响睾丸的体积和精子生产[17]。男性血清INHβB和小鼠睾丸INHβB水平随年龄的顺延呈现先上升后降低的趋势[18-19],大鼠体内INHβB水平呈现同样的变化趋势,并受支持细胞的活性和数量影响[20]。本研究通过免疫组织化学检测发现,INHβB在不同发育阶段牦牛睾丸组织的支持细胞、间质细胞以及各级生精细胞中表达,且INHβB基因和蛋白在牦牛睾丸中的表达水平随年龄增长表现为先上升后下降的趋势,5岁牦牛睾丸中表达量最高,此研究结果与刘敏清等[21]一致,他认为牦牛性成熟前,睾丸仅有少量的支持细胞、间质细胞和初级精母细胞,随着年龄的增加,睾丸体积增大、生精功能不断完善、各类生殖细胞增多、生精和生殖能力随年龄增加表现为先上升后下降的过程,符合睾丸发育的变化过程。公牦牛1岁、3岁和5岁INHβB表达量呈上升趋势,出现这种情况的原因可能与牦牛在1岁时出现精原细胞,3岁达到性成熟,产生精子,5岁生殖能力旺盛相关,INHβB可能参与了睾丸的生精功能,在牦牛睾丸的发育过程发挥着重要作用。
FSH与分布在性腺中的特异性受体FSHR结合,作用于睾丸支持细胞及曲细精管,促进各级精母细胞的发育及精子的成熟,FSH对睾丸发育以及促进精子发生起着极为重要的作用。在山羊中,睾丸的精原细胞和支持细胞中有FSHR的表达,FSHR的表达量随着年龄的增加而升高[22],说明FSHR的表达量与睾丸的曲细精管发育以及精子的生成密切相关;大鼠中,睾丸FSHR的水平在出生后随日龄的增加而升高,60日龄时达到最高水平[23]。本研究结果显示,FSHR主要表达在牦牛睾丸的支持细胞、间质细胞以及各级生精细胞中;FSHR基因和蛋白在不同发育阶段牦牛睾丸中均有表达,随年龄的增长FSHR基因和蛋白在牦牛睾丸组织中逐渐升高,5岁时达到最大值,到9岁表达量明显下降。张宜等[22]认为FSHR主要表达于分化后的支持细胞,进而促进支持细胞的分化与精子的形成。本试验有效验证了FSHR在一定程度上影响牦牛睾丸的发育过程及生精能力。FSHR表达趋势与产舒恒一致,他的研究结果表明梅山公猪睾丸组织中FSHR的表达,呈先上升后下降的趋势。
LH是由垂体前叶分泌的一种促性腺激素,通过与LHR结合对哺乳动物的生殖调控起重要作用。研究发现,LH是睾丸间质细胞合成睾酮的重要激素,与LHR结合,激活睾丸间质细胞中腺苷酸化酶,使胆固醇进入线粒体内膜,促进睾酮合成,睾酮又能促进精子的生成和雄激素的成熟[24]。研究发现,LHR在性腺和非性腺组织中均有表达[25],但在睾丸组织中表达量较高[26]。由此推断,LHR对性腺的发育起着十分重要的作用。本研究发现,LHR蛋白在不同发育阶段牦牛睾丸组织中均有表达,主要定位于睾丸支持细胞、间质细胞和各级生精细胞中,这一结果与他人研究结果相一致[27]。LHR在猪和梅山公猪睾丸中的表达量有随年龄增长呈先升高后降低的趋势,这与本研究结果相似,LHR基因和蛋白在牦牛睾丸中的表达水平随着年龄增长呈现先升高后降低的趋势,在5岁时最高,LHR通过介导相关激素调控牦牛初情期发育和精子发生,对公牦牛生殖系统起着重要作用。
本研究结果表明,INHβB、FSHR和LHR在不同年龄牦牛睾丸组织中均有表达,且在性成熟前,其表达量随年龄的增加而升高,年老时又逐渐下降,3种受体表达量的变化趋势相似,其对牦牛睾丸的发育和精子的形成具有促进作用。免疫组织化学结果显示,INHβB、FSHR和LHR主要存在于睾丸支持细胞、间质细胞和各级生精细胞中。研究结果为进一步探索抑制素联合激素调控牦牛睾丸发育过程提供了基础资料。
