黄铁矿在氯化钴中的电化学氧化机理研究
2022-12-06李栢庄毛王彬唐家华李佳蕊顾云贵
李栢庄,毛王彬,唐家华,李佳蕊,顾云贵,何 琳,张 炎
(昆明理工大学理学院)
引 言
黄铁矿(FeS2)是地壳中含量最为丰富的金属硫化物[1],应用广泛,在工业生产中具有重要作用;但黄铁矿暴露于地表时容易被氧化产生酸性矿山废水(Acid Mine Drainage,AMD)[2],而AMD的治理费用较高。根据已知资料,美国采矿业平均每年要花费约4亿美元用于管理和治理AMD[3];而澳大利亚对AMD的治理费用每年也高达6 000万澳元;中国每年的AMD排放量高达30亿t以上,却仅有不到5 %被处理。虽然人们在这方面花费了巨大的人力物力,结果却并不理想,且AMD的产生通常会有一定的滞后性。当AMD开始积累时,便逐渐显现其弊端,对矿山环境的影响与破坏会持续很长一段时间。AMD的pH值一般为2~4,严重时pH值<2,且废水中含有大量的可溶性Fe、SO2、Ca、Mg、Al、Mn等物质及有毒有害的重金属,如Pb、Cr、Cu、Cd等[4]。AMD还会使水变浑浊、变色及污染地下水源,从而导致矿山周围水体、土壤及生态环境遭到破坏。早在20世纪人们就对矿山环境的防治措施[5]进行了探讨。因此,黄铁矿氧化机理及其动力学影响因素研究在环境治理领域具有直接意义与指导性意义。黄铁矿在酸性条件下的氧化更为常见,因而在酸性条件下的研究更具有实际意义。NABLO[6]在以H2SO4为工作电解质的条件下进行了模拟分析。LI等[7]就硫酸铁-儿茶复合物对黄铁矿电化学氧化行为的影响进行了探讨。AHLBERG等[8]对酸性高氯酸盐溶液中黄铁矿的电化学氧化行为进行了探讨。研究黄铁矿的氧化机理及其规律对于从源头上减缓酸性矿山废水的产生和提高黄铁矿中伴生贵重金属的浸出效率及促进地球上Fe、S循环都具有重要意义。目前,虽然就黄铁矿氧化的研究报道已有许多,但对于其详细的表面氧化机理却仍有待探究。为了从源头上控制酸性矿山废水的产生,必须先了解黄铁矿的氧化机理,这样才能找出有效且合理的处理方法以降低ADM的影响。因此,本次试验通过不同电化学技术对黄铁矿电极在酸性CoCl2溶液中的电化学氧化机理展开探讨,期望能对其氧化机理有进一步的理解。
1 试验材料
1.1 电极及仪器
试验电极采用镶嵌有厚度为2 mm、表面积约为1 cm2黄铁矿的石墨棒作为工作电极,铂电极作为辅助电极,饱和甘汞电极作为参比电极所组成的三电极系统;试验所用测量仪器为CHI660e型电化学工作站(上海辰华仪器有限公司)。
1.2 电解液
用电子天平称取一定量的CoCl2·6H2O固体,溶解于事先准确量取有10 mL H2SO4与一定量去离子水的100 mL烧杯中,之后用去离子水定容至500 mL容量瓶中,以此配置成5份pH值均为1.0,浓度分别为1 mmol/L、3 mmol/L、5 mmol/L、7 mmol/L、9 mmol/L 的CoCl2电解液。
2 结果与讨论
2.1 黄铁矿的开路电位
黄铁矿在不同浓度CoCl2溶液中的开路电位见图1。在测试时间(本次试验为800 s,时间间隔为0.1 s)内开路电位的波动小于5 mV时,即可认为黄铁矿在该溶液中达到稳定。
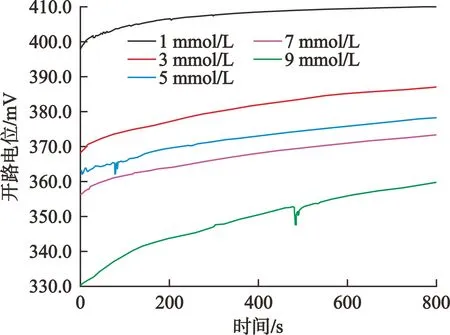
图1 黄铁矿在不同浓度CoCl2溶液中的开路电位
由图1可以看出:测试时间为500~800 s时,黄铁矿电极在CoCl2溶液中的开路电位变化小于5 mV,并且随着CoCl2浓度的升高,开路电位逐渐减小。其中,黄铁矿在1 mmol/L、3 mmol/L、5 mmol/L、7 mmol/L、9 mmol/L CoCl2溶液中的稳定开路电位分别为410.0 mV、386.9 mV、378.1 mV、373.3 mV、359.7 mV。由此可以看出,CoCl2浓度对开路电位有影响。
2.2 黄铁矿的CV曲线
黄铁矿在pH=1.0的不同浓度CoCl2溶液中,采用电位-0.7 ~ 0.8 V[9],扫描圈数3圈,扫描频率50 mV/s进行循环伏安(CV)研究。为了保证结果的准确性,试验采用第二次循环扫描的数据作图,结果见图2,试验结果展现了较好的重现性。从扫描结果可以看出:在阳极扫描过程中,在电位为0.6 V、0.8 V附近出现了2个氧化峰,分别将其命名为A2和A3;在阴极扫描过程中,在电位为0.4 V、-0.4 V附近出现了2个明显的还原峰,分别将其命名为C1、C2。出峰的位置和强度与前人的研究成果略有不同,这可能是由黄铁矿的组成、电解液的浓度和种类等原因造成的。

A1、A2、A3—氧化峰 C1、C2—还原峰图2 黄铁矿在不同浓度CoCl2溶液中的CV曲线

(1)
(2)
(3)
当黄铁矿的阴极扫描从0.8 V至0.4 V时出现了还原峰C1,此时,可能是阳极扫描过程中生成的Fe3+被还原成Fe2+,见式(4)。当阴极扫描继续进行至-0.4 V时出现还原峰C2,可能是2个原因[11]导致的:一是FeS2被还原成FeS和H2S,见式(5);二是黄铁矿电极表面的S0发生了还原反应,从而生成了H2S,见式(6)。

(4)

(5)

(6)
2.3 黄铁矿的Tafel曲线
试验中不同浓度CoCl2溶液的Tafel电位测定均为-0.1~0.5 V,扫描频率为10 mV/s,扫描段数为1段。黄铁矿在不同浓度CoCl2溶液中的Tafel曲线见图3,基于Tafel曲线得到的相关参数见表1。
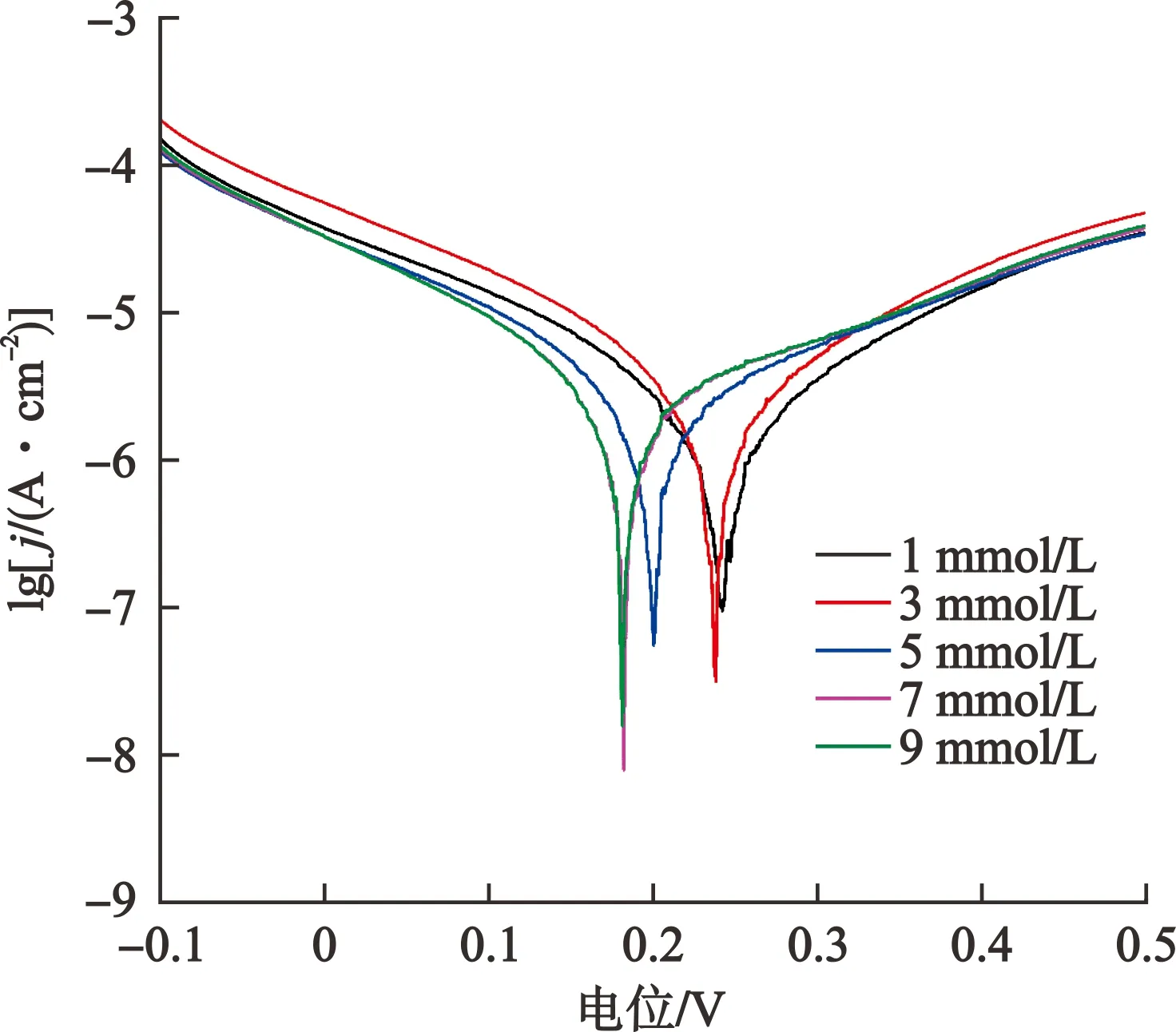
图3 黄铁矿在不同浓度CoCl2溶液中的Tafel曲线
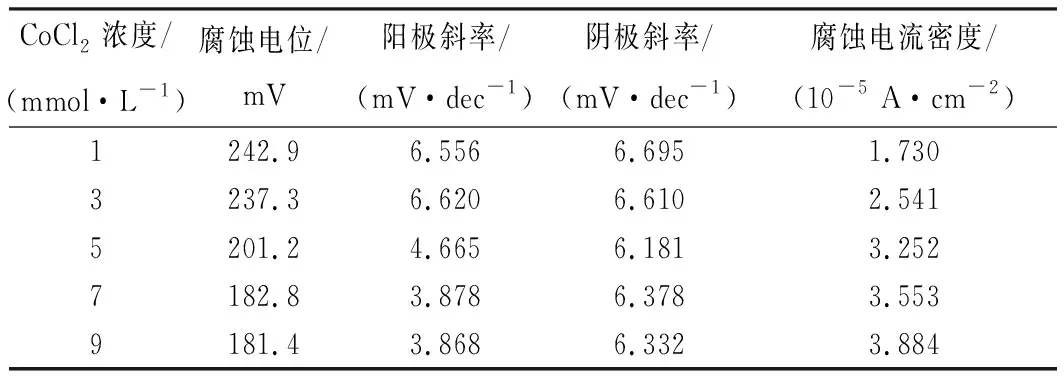
表1 黄铁矿在不同浓度CoCl2溶液中的Tafel曲线参数
由图3、表1可以看出:黄铁矿的腐蚀电位随着CoCl2浓度的升高而逐渐减小,在CoCl2浓度为9 mmol/L 时达到最小值181.4 mV。而黄铁矿的腐蚀电位与上述开路电位有差异,主要是因为在对黄铁矿进行Tafel曲线测量的过程中,电位是从负电位向正电位扫描,这个过程中存在阴极极化[12]现象,从而使得Tafel曲线所测腐蚀电位小于上述开路电位。此外,黄铁矿电极表面会发生强极化[13]过程,使其表面生成一层钝化膜,从而导致腐蚀电位与开路电位数值不同。
由表1还可以看出:黄铁矿的腐蚀电流密度随着CoCl2浓度的升高而增大,且在CoCl2浓度为9 mmol/L时达到最大值3.884×10-5A/cm2。高腐蚀电流密度说明黄铁矿在电化学浸出过程中氧化速率快,因此表1的结果表明当CoCl2浓度较高时,黄铁矿的氧化速率也较快。
2.4 黄铁矿的EIS曲线
EIS在研究电极的电化学反应过程中应用广泛,通过建立电路模型,根据电路中元件的类型和数据来推测其电化学反应机理。试验测量了在电位为0.4 V、0.5 V、0.6 V、0.7 V、0.8 V时黄铁矿在7 mmol/L CoCl2溶液中的电化学阻抗谱(EIS)。此外,使用Zsimpwin3.10软件对得到的电化学阻抗谱进行拟合得到相应的等效电路图。试验测试频率为105~10-1Hz,振幅为5 mV。黄铁矿在5 mmol/L CoCl2溶液中于0.4~0.6 V和0.7 V、0.8 V电位下的EIS曲线和等效电路图分别见图4、图5,等效电路图中各元件参数分别见表2、表3。

-Zi—电极虚部阻抗 Zr—电极实部阻抗 cal—拟合模拟值 msd—试验测量值Rs—溶液电阻(Ω·cm2) Q—表面层-电极界面的双电层电容(sn/(Ω·cm2))Rct—电子转移电阻(Ω·cm2) W—瓦尔伯扩散阻抗(s0.5/(Ω·cm2)) Rp—极化电阻(Ω·cm2)Q1—电极与电解质之间的双电层电容(sn/(Ω·cm2)) Q2—产物与电解质之间的双电层电容(sn/(Ω·cm2))图4 黄铁矿在5 mmol/L CoCl2溶液中于电位0.4~0.6 V下的EIS曲线和等效电路图
由图4-a、b可以看出:在0.4 V和0.5 V的低电位下,在高频和中频处显示出一个不完整的半圆,且在低频处显示出了典型的Warburg阻抗特征。采用Rs(Q(RctW))等效电路对0.4 V和0.5 V电位下测得的阻抗进行拟合与描述,见图4-d。然而,在0.6 V电位下,有较为完整的半圆但无典型的Warburg阻抗特征(见图4-c),故而采用Rs(Q1(Rp(Q2(Rct))))等效电路来拟合,见图4-e。
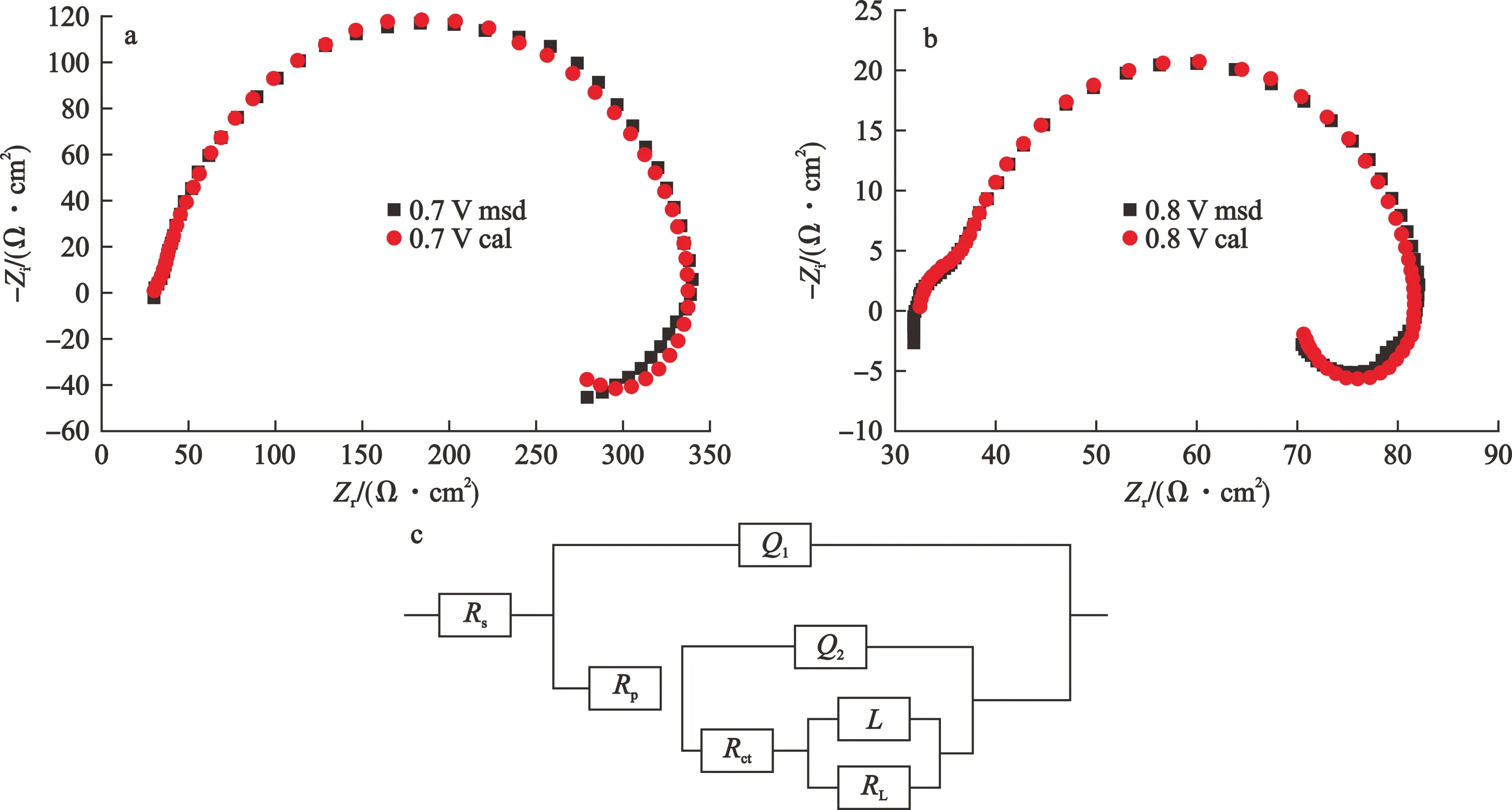
L—电极表面产物S0或Fe(OH)3/Fe2O3产生的屏蔽效应而引起的电感[14] (H)RL—由电感产生的电阻(Ω·cm2)图5 黄铁矿在5 mmol/L CoCl2溶液中于电位0.7 V、0.8 V下的EIS曲线和等效电路图
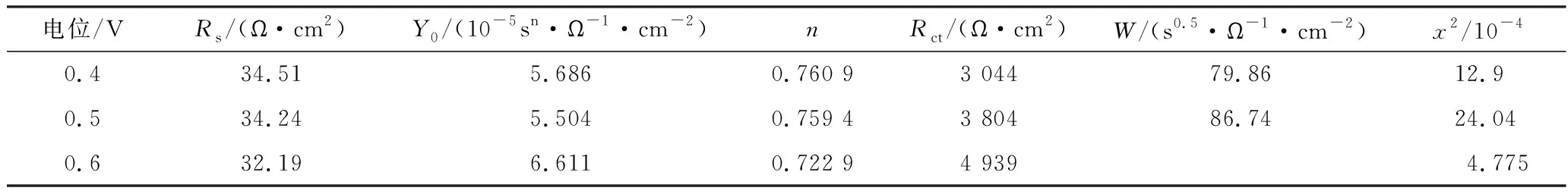
表2 黄铁矿在5 mmol/L CoCl2溶液中于电位0.4~0.6 V下的等效电路图各元件参数

表3 黄铁矿在5 mmol/L CoCl2溶液中于电位0.7 V、0.8 V下的等效电路图各元件参数
由图5可以看出:在0.7 V和0.8 V的高电位下,阻抗图与前述低电位下有所不同,这是因为在高电位下发生了反应(1),生成了S0物质,S0覆盖在黄铁矿电极表面形成一种S0膜,其会在黄铁矿电极表面上产生屏蔽效应,从而产生电感效应。因此,采用Rs(Q1(Rp(Q2(Rct(LRL)))))等效电路来拟合,见图5-c。
由表2、表3可以看出:n值表示电极表面的粗糙程度和不均匀性,其数值越接近于1则表明电极表面越光滑。卡方值x2的大小说明了等效电路图与试验测得的阻抗图吻合程度的好坏,本次试验中,卡方值x2很小则说明等效电路图与试验所得的阻抗图吻合程度好;且在电位为0.4~0.8 V时Rs相差不大,说明体系十分稳定。Rct为反应中电子转移的数值,其常用来评定反应的快慢,其数值越大则说明电极表面的腐蚀速率越缓慢,而在电位0.4~0.8 V下,Rct先上升后下降,在0.6 V时达到最大值4 939 Ω·cm2;表明在5 mmol/L CoCl2溶液中,当电位为0.6 V时,黄铁矿的表面腐蚀速率最缓慢,且在本次试验电位范围内,电位低于或高于0.6 V都有利于黄铁矿表面氧化。而与0.4 V、0.5 V的低电位相比,0.7 V和0.8 V电位下Rct都较小,说明高电位更有利于黄铁矿表面氧化。
3 结 论
1)开路电位与Tafel曲线参数的腐蚀电位与腐蚀电流密度表明,在本次试验条件下,黄铁矿电极在pH=1.0 的9 mmol/L CoCl2溶液中最容易被腐蚀。
2)从电化学阻抗谱EIS和等效电路图可以看出,在电位为0.4~0.8 V时,黄铁矿在0.6 V电位下最不容易被腐蚀;而在高电位下,黄铁矿的氧化能力增强,容易被氧化腐蚀。该结论对黄铁矿的防腐及开采有重要意义。
3)CV曲线的测量是为了获取黄铁矿在氧化过程中一些简单的物理化学反应信息,例如,A2、A3峰代表反应生成了Fe3+、单质硫、多硫化物(FeSn)和缺金属硫化物(Fe1-xS2)等。若要了解黄铁矿在pH=1.0 CoCl2溶液中的具体氧化还原反应及过程,还需采用其他测量技术(如Raman光谱、XPS等)进一步探索。
