石芝珊瑚(Fungiidae)的分类、生活史及其生物地理研究进展
2022-12-05韦雨鑫余克服
韦雨鑫,余克服,陈 飚
(广西大学a.广西南海珊瑚礁研究重点实验室;b. 珊瑚礁研究中心;c. 海洋学院,南宁 530004)
石芝珊瑚科(Fungiidae)在分类学上隶属刺胞动物门(Cnidaria)珊瑚虫纲(Anthozoa)六放珊瑚亚纲(Hexacorallia) 石珊瑚目(Scleractinia),该科物种的生长形态犹如蘑菇,因而又被称为蘑菇珊瑚(mushroom coral)(Hoeksema, 1989a)。在石珊瑚目中,石芝珊瑚科具有最新修订的分类学系统,且个体具有易于识别、收集和计数的特点,因此常被作为定量生态学研究的模型种群(model groups)(Goffredo et al., 2000; Benzoni et al., 2012;Hoeksema,2012a;Feliciano et al.,2018)。石芝珊瑚科包含17个属,具有多样化的进化分歧与丰富的物种多样性,是珊瑚礁生态系统的框架构建者和维持珊瑚礁生态系统平衡的主要贡献者。与其他的珊瑚种类相比,大部分石芝珊瑚是由单个巨大的水螅体(polyp)所形成,并存在独特的生活史,即幼年的固着生活(attached living)阶段和成年的自由生活(free living)阶段(Gittenberger et al.,2011;Benzoni et al.,2012)。由于成年石芝珊瑚具有运动能力,能在不同类型的基质(包括岩石、沙地、淤泥等)上生存,并进行正常的营养获取与光合作用,因而得名“会走路的珊瑚”(赵盛龙,2009)。但目前中国对于石芝珊瑚的生理、生态特征的相关研究仍较少。因此,本文从石芝珊瑚的物种多样性、生活史、空间分布特征3个方面进行综述,以期进一步了解石芝珊瑚的生物学特性、生物地理分布模式、环境适应能力及其对珊瑚礁的生态贡献。
1 石芝珊瑚的物种多样性
石芝珊瑚是刺胞动物门珊瑚虫纲六放珊瑚亚纲石珊瑚目石芝珊瑚科所有种类的统称。石芝珊瑚科(Fungiidae) 由Dana 于1846 年 建 立(Hoeksema,1989a),该科下属的物种大多是由一个水螅体单独形成骨骼的单体珊瑚(solitary coral),而少部分为群体珊瑚(colonial coral)。单体石芝珊瑚可依据口的数量差异,分为单口、多口与假单口——“长口”(实际上是多口的融合)(邹仁林,2001)。石芝珊瑚的珊瑚骨骼(corallum)多呈圆形、长椭圆形或叶片形。表面呈菌伞的褶襞状,隔片(septa)上的装饰(隔片齿,septal teeth)或呈小的颗粒状,或呈大的叶片状,隔片越过珊瑚杯壁(corallum wall)向外延伸形成珊瑚肋(costae),珊瑚肋刺(costal spines)从颗粒状、短棒状到长刺状不等(Hoeksema, 1989a;邹 仁 林,2001;黄 晖 等,2021)。
根据Wells 的报道,石芝珊瑚科可以追溯到白垩纪中期,是由现已灭绝的Synastreidae(隶属六放珊瑚)演化而来(Wells, 1966; Hoeksema, 1989a)。前期关于石芝珊瑚科分类学的研究大部分是基于物种间生活史的差异和形态学结构特征进行的(Wells,1966;Cairns,1984;Hoeksema,1990,1993a)。在自然环境中,根据上述特征能够较容易地在属的水平上区分出石芝珊瑚。而对于更精细化的鉴定,则主要依据珊瑚微结构(micro-architecture)的差异(例如珊瑚壁、隔和肋的形态),并辅以整体形态来进行分类鉴别(Hoeksema, 1989a;邹仁林,2001)。但由于珊瑚的形态特征会对环境的变化作出响应,因此许多珊瑚物种存在多样化的表型变异。例如,分布于印度尼西亚苏拉威西岛(Sulawesi Island)附近点礁的石芝珊瑚,其最初依据形态可鉴定为3 个物种;但经过等位酶电泳(allozyme electrophoresis)分析发现,此区域的石芝珊瑚仅分属于直肋圆饼珊瑚(Cycloseris costulata)和细致圆饼珊瑚(Cycloseris tenuis)2 个物种,其中直肋圆饼珊瑚(Cycloseris costulata)具有2种不同的形态(一种可能是发生在河口附近特有的生态表型)(Gittenberger et al.,2006)。因此,仅基于形态学分析会导致许多物种之间的系统发育关系不明确。目前,线粒体细胞色素氧化酶I 基因序列(Cytochrome Oxidase I, COI)和核糖体转录间隔区序列(Internally Transcribed Spacer, ITS)等高分辨率的分子标记在珊瑚系统发育分析中已被广泛运用。因此,采用分子分析与形态学特征相结合的技术手段将有助于对石芝珊瑚进行更为准确的分类研究与比较分析,并扩宽对石芝珊瑚物种多样性的认识。
Gittenberger 等(2011)在印度—太平洋地区[包括红海、东印度洋(安达曼海)、印度—太平洋中部和中太平洋(夏威夷)]采集了68个石芝珊瑚样本,分别基于COI 序列数据集、ITS 序列数据集和COI+ITS组合序列数据集对样本开展系统发育分析,并结合形态学的初步鉴定结果(Hoeksema,1989a)进行比较。结果发现,所测序的样本包含3个主要的进化枝(clade),其中1个进化枝由具有较长触手的石芝珊瑚物种所组成,而另外2个进化枝则在形态上还无法区分。此外,基于珊瑚形态-分子(morpho-molecular)的联合分析显示,原属于铁星珊瑚科(Siderastreidae) 的Psammocora explanulata和Coscinarea wellsi与石芝珊瑚科的亲缘关系更为紧密。Benzoni 等(2012)基于COI 序列和细胞核rDNA 序列(完整的ITS1、5.8S、ITS2 序列和18S、28S片段)对这2个物种进行分析,结果表明它们实际属于石芝珊瑚科的圆饼珊瑚属(Cycloseris)。此外,对其骨骼结构形态特征的重新评估也证实了分子分类的分析结果,因此上述2个物种被重新命名为Cycloseris explulata和Cycloseris wellsi。另外,Oku等(2017)曾对在日本冲绳西表岛(Iriomote Island)附近采集的Cycloseris hexonalis样本进行系统发育研究。其中,形态学的分析结果表明,所采集的样本可划分为4 种形态。同时,利用线粒体COI和细胞核ITS 标记进行的分子系统发育分析则表明,Cycloseris hexonalis的所有形态类型均属于1个全新、独立的进化分支。因此,将Cycloseris hexonalis归入1个新建的Sinuorota属。
形态特征与分子分析相结合,不仅能更准确地推断石芝珊瑚的分类学位置,而且有助于发现隐藏的物种或谱系。石芝珊瑚(Fungia fungites)曾被报道以2 种形态存在(附着和不附着)(Hoeksema et al., 2011a)。对在日本南西诸岛(Nansei Island group)上采集到的石芝珊瑚(Fungia fungites)样本进行COI 和ITS 标记分析,其结果显示存在2 个显著的遗传分支(都包含附着和不附着2种形态),分支A 是碓刺石芝珊瑚(Danafungia scruposa)和小帽状珊瑚(Halomitra pileus)的姐妹支,而分支B 是独立的,并与上述3 个物种存在较大的遗传分化(Oku et al.,2020)。此外,在形态学特征上,分支A 的样本的隔片齿密度(8~22 个/cm)和隔片齿形状与Hoeksema(1989a)所描述的更接近(8~25个/cm)。由此推断,分支A 是真正的石芝珊瑚(Fungia fungites),而分支B属于1个尚未确定的物种。因此,目前发现的石芝珊瑚(Fungia fungites)实际上是1个物种复合体,其中还能够划分出超过2个以上的种或亚种类型(Oku et al.,2020)。
最新基于形态学和分子分类学的研究对石芝珊瑚科进行厘定,并确定该科包括17 个属(约55种)。分别为Cantharellus、梳石芝珊瑚属(Ctenactis)、圆饼珊瑚属(Cycloseris)、刺石芝珊瑚属(Danafungia)、石芝珊瑚属(Fungia)、帽状珊瑚属(Halomitra)、辐石芝珊瑚属(Heliofungia)、绕石珊瑚属(Herpolitha)、石叶珊瑚属(Lithophyllon)、叶芝珊瑚属(Lobactis)、侧石芝珊瑚属(Pleuracti)、多叶珊瑚属(Polyphyllia)、足柄珊瑚属(Podabacia)、履形珊瑚属(Sandalolitha)、Sinuorota、Zoopilus和Patelopsammia(Hoeksema et al.,2021)。目前关于石芝珊瑚科系统发育的相关研究(Grinblat et al.,2021)仍在进行中。下文将着重介绍几种常见的属。
石芝珊瑚属Fungia。该属中的大部分种类自由生活,单体形态主要呈圆状、卵圆状、扁平状与穹顶状,大小与陆地上的蘑菇相接近,中间仅有1个口。隔片齿小而尖,珊瑚肋成排,并形成珊瑚肋刺。石芝珊瑚属在自然海区多呈白色、棕色等,并多见于礁坡和潟湖内,生长基底通常为泥质或沙质环境。石芝珊瑚属的分布范围广泛,在红海和印度洋西部常见,代表种为石芝珊瑚Fungia fungites(Linnaeus,1758)(图1-a)。
辐石芝珊瑚属Heliofungia。单种属(仅包含1个物种:辐石芝珊瑚Heliofungia actiniformis,图1-b),其水螅体是所有珊瑚中最大的。呈长圆筒状的触手伸展不受昼夜节律的影响。该珊瑚个体在生活时多呈灰色、绿色和棕褐色。常见于潟湖内碎石和沙质基底之上或浑浊的环境中,广泛分布于印度-太平洋海区。
梳石芝珊瑚属Ctenactis。成年种类自由生活。形状呈长履形或长椭圆形,骨骼直径最长可达50 cm。或单口或多口,成年的种类多口沿中线形成中轴沟。生活时多呈棕色,常见于珊瑚礁外礁坡和潟湖,广泛分布于印度-太平洋海区。代表种为厚实梳石芝珊瑚Ctenactis crassa(Dana,1846)(图1-c)和刺梳石芝珊瑚Ctenactis echinata(Palas, 1766)(图1-d)。
绕石珊瑚属Herpolitha。自由生活的群体珊瑚,沿着中轴形成一系列口,由于群体分叉使其形状多变,呈似字母Y、X 或V 形。生活时常为绿色或褐色,多生于礁坡和潟湖,常见于印度-太平洋海区。代表种为绕石珊瑚Herpolitha limax(Esper,1797)。
多叶珊瑚属Polyphyllia。成年种类自由生活,多口,骨骼延长呈椭圆形或长形。珊瑚肋小而稀。在整体形态上,多叶珊瑚属(Polyphyllia)与绕石珊瑚属(Herpolitha) 最相似,但多叶珊瑚属(Polyphyllia)的气孔(stomatal)较多,在珊瑚表面分布更均匀。多生活于礁坡和潟湖,常见于印度—太平洋海区。代表种为多叶珊瑚Polyphyllia talpina(Larmarck,1801)(图1-e)。
履形珊瑚属Sandalolitha。自由生活的群体珊瑚。珊瑚骨骼形状不规则(圆板形、长履形或无中轴沟)。隔片和珊瑚肋紧密排列,装饰有粗糙且不规则的锯齿。生活于各种珊瑚礁生境,常见于印度-太平洋海区。代表种为健壮履形珊瑚Sandalolitha robusta(Quelch,1886)(图1-f)。
帽状珊瑚属Halomitra。自由生活。珊瑚骨骼常为近圆形或半圆钟盖形,隔片-珊瑚肋上的装饰的形状排列类似于Fungia fungites。多生于礁坡隐蔽处或潟湖的软质基底上,常见于印度-太平洋海区。代表种为小帽状珊瑚Halomitra pileus(Linnaeus,1758)(图1-g)。
圆饼珊瑚属Cycloseris。单体种自由生活,骨骼呈圆形或卵圆形;群体种通常较小,骨骼形状不规则。隔片—珊瑚肋上的装饰细而尖。常见于泥质基底环境中,分布于印度洋-中太平洋海区。代表种为直肋圆饼珊瑚Cycloseris costulata(Ortmann,1889)(图1-h)。

图1 常见的石芝珊瑚科物种Fig.1 Common species of Fungiidae family
2 石芝珊瑚的生活史
2.1 石芝珊瑚的繁殖
造礁石珊瑚有2 种基本的性别模式(sexuality),分别为:雌雄同体(hermaphroditism;水螅体能同时产生雄性和雌性配子)与雌雄异体(gonochorism;水螅体只产生雄性或雌性配子,且在整个生命史中仅存在一种性别)(Harrison et al., 1990;Baird et al.,2009)。然而,石芝珊瑚科是拥有非典型性别特征(atypical sexuality)的物种之一,而这种特征在造礁石珊瑚中并不常见。迄今为止,已报告的大多数石芝珊瑚科物种均为雌雄异体(Loya et al.,2009;Harrison,2011),但实际上石芝珊瑚的性别包括雌雄异体、顺序雌雄同体[sequential protandrous hermaphrodites;水螅体尺寸较小时只表现雄性功能,较大时只表现雌性功能(Kramarsky-Winter et al.,1998;Loya et al.,2008)]以及双向性别转换体(Loya et al., 2008, 2009; Eyal-Shaham et al.,2020)。根据性别分配理论(sex-allocation theory)(Charnov,2020),至少有4 种石芝珊瑚属于顺序雌雄同体。例如,楯形叶芝珊瑚(Lobactis scutaria)在个体尺寸为2.5~6.0 cm 时主要表现为雄性,而当个体尺寸超过9 cm时,则以雌性为主(Kramarsky-Winter et al., 1998)。此外,与植物的生殖策略类似,石芝珊瑚[如:刺梳石芝珊瑚(Ctenactis echinata)(Loya et al., 2008)和绕石珊瑚(Herpolitha limax)(Eyal-Shaham et al., 2019)] 可通过双向性别转变的方式响应能量限制与环境压力,该策略的优势在于雄性石芝珊瑚维持生命的物质与能量需求要显著低于雌性,因此性别的转变不仅能提高石芝珊瑚的繁殖成功率,并会增强石芝珊瑚种群在应对环境压力与资源限制时的适应能力(Loya et al.,2008;Eyal-Shaham et al.,2019)。值得注意的是,在对日本冲绳(Okinawa)的石芝珊瑚(Fungia fungites)繁殖量的日观测结果显示,该物种除雄性和雌性外,还存在部分雌雄同体的个体,这种混合性别模式的出现可能是受环境影响的结果(Eyal-Shaham et al.,2020),例如温度、光照等。
造礁石珊瑚的基本生殖模式分为有性生殖和无性生殖。有性生殖又分为排幼型(brooding)和排卵型(broadcast spawning)两类。排幼型是指由珊瑚的生殖腺所产生的卵子和精子在胃循环腔内完成受精,所产生的受精卵将会保留在珊瑚的体内或体表,直到发育成幼虫后才释放至水体中;排卵型是指珊瑚的卵子和精子经口排入水体之中,并在珊瑚体外完成受精,而后发育成幼虫,该受精方式通常仅发生于不同珊瑚个体的卵子与精子之间。大部分石芝珊瑚物种属于排卵型。Krupp(1983)曾观察楯形叶芝珊瑚(Lobactis scutaria)产卵和发育的情况:雌性用口将卵子喷射到上方的水体中,但卵子由于尺寸和脂质含量的影响而处于负浮力的状态,最终落在珊瑚的口盘(oral discs)上,并随着珊瑚表面纤毛黏液系统(muco-ciliary system)的活动而移出边缘;雄性同样以喷射的方式将精子排出,并在水中与卵子结合形成受精卵。在受精卵形成的12 h 后,其将迅速发育形成石芝珊瑚的浮浪幼虫。在24 h 内,石芝珊瑚浮浪幼虫的1 个口开始发育。浮浪幼虫可在39 h 内取食,并在7 d 内完成固着。除此之外,石芝珊瑚还存在混合型生殖模式,即物种兼具排卵型与排幼型的繁殖特征。已有研究表明,日本冲绳的石芝珊瑚(Fungia fungites)既可通过释放配子的方式完成繁殖,也可以在体内将受精卵孵育成幼体后再将其释放至海水中(Loya et al.,2009)。对于石芝珊瑚的无性生殖,可通过出芽(budding)、横向分裂(transverse division)或径向碎裂(radial fragmentation)的方式完成(Hoeksema, 1989a, 2014a; Yamashiro et al., 1998; Hoeksema et al.,2010)。有性生殖对于珊瑚种群产生新的基因型至关重要(Krupp,1983),但是,在自由生活的珊瑚种群中,通过无性生殖的繁殖策略则能够快速产生大量后代,并加快种群繁衍、扩张的速度。此外,无性繁殖还能促使后代在离开母体珊瑚后找到更为适宜生存的环境,这能够最大限度地增加个体存活的几率(Hoeksema et al.,2011a,2011b;2018)。因此,2 种繁殖模式的组合对提高石芝珊瑚物种多样性与环境适应性至关重要。
影响造礁石珊瑚繁殖时间的因素极其复杂。Hunter(1988)通过室内模拟实验与自然海区产卵时间的长期观察,有力地证明了月球对珊瑚产卵夜的控制,表明造礁石珊瑚的产卵模式与地-月周期存在紧密的关联。石芝珊瑚的繁殖时间同样也会受到地-月周期的影响。Loya 等(2009)曾观察发现刺梳石芝珊瑚(Ctenactis echinata)、厚实梳石芝珊瑚(Ctenactis crassa)和弯石叶珊瑚(Lithophyllon repanda)主要在每年7—8 月满月(full moon)后的第4—8天的夜晚进行繁殖。此外,海表温度的季节性变化也是影响珊瑚繁殖时间的主要因素(Harrison et al.,1990)。据报道,石芝珊瑚在夏季随月运周期(lunar cycles)进行大量繁殖,夏季的每个月仅有1次短暂的产卵活动,并在秋季随着温度的降低而减少产卵,而冬、春季则未发现石芝珊瑚存在产卵活动(Krupp,1983)。另外,石芝珊瑚还存在白天同步产卵的现象(Mangubhai et al.,2007;Eyal-Shaham et al.,2019)。由于石芝珊瑚的配子仅能存活若干小时,而同步释放配子则可有效提高整个种群受精的成功率。
2.2 石芝珊瑚的营养模式
珊瑚与虫黄藻(Symbiodiniaceae)存在紧密的共生关系,虫黄藻能利用无机营养物质进行光合作用,并将所固定的有机碳转运进珊瑚宿主体内,为宿主提供超过95%的营养来源(周进,2014)。据统计,约85%的珊瑚是通过水平传递(horizontal transmission;从周围环境中获取微生物)的方式从水体之中获得虫黄藻,石芝珊瑚也不例外(Krupp,1983;Harrison et al.,1990)。Krupp(1983)首次发现楯形叶芝珊瑚(Lobactis scutaria)的浮浪幼虫水平传递虫黄藻的模式。此外,Schwarz 等(1999)曾描述楯形叶芝珊瑚(Lobactis scutaria)获取虫黄藻的过程:在受精后的第3天,楯形叶芝珊瑚(Lobactis scutaria)的幼虫已形成完整的口腔和胃腔,并能主动进食。在加入食物(经过均质处理的卤虫homogenized artemia)后,可观察到幼虫的口腔末端发生扩张并排出黏液并不加区别地摄入任何颗粒,包括在实验中所添加的虫黄藻。虫黄藻通常以2 种方式进入楯形叶芝珊瑚(Lobactis scutaria)的幼虫的体内,其中,一部分的虫黄藻会混合于其他颗粒物中,并形成较大食物团被幼虫的口腔所吞噬(图2-a),幼虫的黏液链(mucous strand)则会吸附另一部分的虫黄藻,进而被幼虫的内胚层的共生细胞所吸收并完成共生体系的构建(图2-b)。除虫黄藻外,所有摄入的颗粒物均在第二天被消化或排出。另外,石芝珊瑚幼虫摄食活动的强度与虫黄藻共生关系构建的成功率存在紧密的正相关关系,这表明虫黄藻的水平传递效率与石芝珊瑚幼虫口腔的发育程度关系密切(Schwarz et al.,1999)。

图2 扫描电子显微照片记录的楯形叶芝珊瑚(Lobactis scutaria)幼虫获取虫黄藻的过程Fig.2 Scanning electron micrograph recorded the process of acquisition of symbiodiniaceae by larvae of Lobactis scutaria
2.3 石芝珊瑚的生长发育
大多数石芝珊瑚科的成员以单体的形式生长,少数为群体生长,且超过70%的物种在其生活史中均存在自由生活阶段(Hoeksema et al., 2016)。已有研究表明,幼年石芝珊瑚的柄(stalk)与口盘的分离是由骨骼溶解促进的(Yamashiro et al., 1987;Yamashiro et al.,1994),溶解过程破坏了有序、致密的晶体堆积,导致骨架断裂的表面呈现白色和白垩色(Yamashiro et al.,1996)。一些石芝珊瑚幼年时固着于坚硬的基底上,在口盘生长直径接近50 mm 时,会主动溶解附着在柄状基片上的骨骼,并脱离基底自由生活(Oku et al.,2020)。所有的单体珊瑚和少部分的群体珊瑚[如梳石芝珊瑚属(Ctenactis)、绕石珊瑚属(Herpolitha)、多叶珊瑚属(Polyphyllia)、履形珊瑚属(Sandalolitha)] 均具备上述生活史特征(黄晖等,2021)。然而,大多数的群体石芝珊瑚种类[如石叶珊瑚属(Lithophyllon)和足柄珊瑚属(Podabacia)]均终生保持固着生活的状态。
石芝珊瑚的生长速率与尺寸大小有关。颗粒侧石芝珊瑚(Pleuractis granulosa)、刺梳石芝珊瑚(Ctenactis echinata)、楯形叶芝珊瑚(Lobactis scutaria)和石芝珊瑚(Fungia fungites)等物种的生长速率随着珊瑚体型的增加而降低(Chadwick et al.,2000; Goffredo et al., 2003; Knittweis et al., 2009)。此外,珊瑚在成长过程中骨骼长宽比的变化速率对骨骼形状也具有一定的影响(Goffredo et al.,2003)。当珊瑚口盘长宽比等距生长时,通常会形成圆形骨骼(如石芝珊瑚属);而当长宽比呈异速生长时(口盘长比宽长得快),往往会形成椭圆形(如梳石芝珊瑚属)。圆形骨骼可能是石芝珊瑚最原始的骨骼类型,而生活区域的环境压力会促使其由圆形发育转变为椭圆形发育,以便更好地清除沉积物和获取食物(Goffredo et al.,2003)。在石芝珊瑚死后,其钙质骨骼会存留在沙质栖息地附近,并作为其他珊瑚幼虫附着的基底,从而为形成新的斑块礁奠定基础(Yamashiro et al.,1987)。
2.4 独特的生存策略——移动性(mobility)
石芝珊瑚有一个独特的生存策略,大多数种类在自由生活阶段具有在不同栖息地之间迁移的能力(Chadwick, 1988; Hoeksema, 1988; Chadwick et al.,1992; Hoeksema, 2012b),并根据差异的环境情况移动到浅层或深层礁带。一些石芝珊瑚物种会通过向外礁坡等浅水区域迁移的方式以增加自身的光合作用效率(Hoeksema, 2012b)。例如,楯形叶芝珊瑚(Lobactis scutaria)在浅水区域可以达到很高的种群密度,表明该区域可能是最适合它们生活的栖息地(Goffredo et al.,2000)。而许多石芝物种能够向较深的水域进行迁移,并适应该区域沙质基底的环境。例如,一些自由生活的圆饼珊瑚属(Cycloseris)的成员可生活于较深水域的沙质栖息地中(Hoeksema,2012b)。而形态特征(表面光滑度、隔片形态和骨骼密度等)的差异也会影响石芝珊瑚对栖息环境的选择偏好性(Hoeksema,2012a)。例如,刺梳石芝珊瑚(Ctenactis echinata) 和石芝珊瑚(Fungia fungites)具有巨大的珊瑚肋刺,这可为防止其在礁区过快的下滑提供额外的摩擦阻力。此外,这些物种的口表面发育有尖锐而狭窄的隔片,该特性不具备保护组织免受沉积物伤害的能力,导致其不适合在沙质基底上生存(Hoeksema,2012a)。另外,由于石芝珊瑚具有移动性的特点,这会直接导致该科中大多数自由生活的物种之间可能不存在群落饱和(community saturation) 和竞争排斥(competitive exclusion)(Hoeksema, 2012b)。独特的移动性还能够促使石芝珊瑚从与大型群体珊瑚的竞争接触中撤退(Chadwick,1988),并能有效利用绝大多数珊瑚无法存活的沙质栖息地(Chadwick et al.,1992),从而拓宽其在珊瑚礁中的生态位。
石芝珊瑚的向下迁移包括主动和被动2种模式(Hoeksema,1988;Chadwick et al.,1992)。在斜坡上自由活动的石芝珊瑚可通过水的运动或重力作用实现由浅水向深水的移动,一旦到达较深的礁坡和沙质基底,其移动速率便会下降,甚至几乎完全不动(Denis et al.,2015;Palmas et al.,2021)。此外,石芝珊瑚可在自由生活的阶段通过被动迁移的方式避开与其他珊瑚的物理接触,且具有较低的攻击性(Chadwick,1988;Chadwick et al.,1992)。但是,如果它们在被动迁移过程中接触到竞争物种或敌害生物(如:长期不动且会产生毒素的海绵)时,则会通过主动迁移的方式摆脱风险(Abelson et al.,1999; Voogd et al., 2005; Gittenberger et al., 2011;Hoeksema et al., 2014b)。例如,楯形叶芝珊瑚(Lobactis scutaria)可通过主动扩张其水螅体方式进行移动,以逃脱邻近物种的威胁(Chadwick,1988; Hoeksema et al., 2012c)。此 外,Ohara 等(2021)研究发现,石芝珊瑚在被珊瑚碎屑掩埋或分布区域内的鹿角珊瑚(Acropora corals)过度生长时,会通过主动迁移的方式摆脱困境。另外,石芝珊瑚的移动距离与移动速率会受到多种因素的影响,如:沉积物类型、形态大小和底面粗糙度等(Ohara et al.,2021)。Chadwick(1988)曾把不同尺寸大小的楯形叶芝珊瑚(Lobactis scutaria)放置在细疣蔷薇珊瑚(Montipora verrucosa)的碎片旁,发现尺寸较小的珊瑚在实验开始3周后平均移动了7.12±11.04 mm,而尺寸较大的珊瑚则移动了3.12± 2.42 mm。除此之外,长椭圆形石芝珊瑚的移动速度明显快于圆形珊瑚,且底面光滑的石芝珊瑚的移动速度也显著高于底面粗糙的石芝珊瑚(Ohara et al.,2021)。值得注意的是,Ohara 等(2021)在日本冲绳恩纳村(Onna) 附近的珊瑚礁(26°30′35.28″N,127°52′55.92″E)观测发现,在秋季,石芝珊瑚具有较高的迁移率。但在台风影响时期,石芝珊瑚的迁移率在统计上出现显著下降。虽然,上述现象与石芝珊瑚的被动迁移策略似有矛盾,但此现象背后的机制还有待进一步研究。
3 石芝珊瑚的空间分布模式及其影响因素
3.1 石芝珊瑚的空间分布模式
造礁石珊瑚主要分布于南北纬30°之间的热带与亚热带浅海海域,在生物地理学上可大致划分为2个区系,分别是印度—太平洋区系(Indian-Pacific fauna)与大西洋—加勒比海区系(Atlantic-Carribean fauna)(Kohn,2001)。石芝珊瑚在印度—太平洋区系具有较高的物种丰富度(species richness),并分布于非洲东海岸至美洲西海岸宽阔的热带、亚热带海域,是该区域珊瑚物种多样性的重要组成部分(图3)。石芝珊瑚独特的生活史特征为其幼虫提供“固着—扩散”的机会,这促使其能够在不同类型的珊瑚礁基质上生存(Ohara et al.,2021),包括岩石、沙地与淤泥等(Hoeksema, 2012b;Hoeksema et al.,2019)。因此,石芝珊瑚具有较强的环境适应能力,并能够分布于多样化的生境中(Hoeksema,1991;1993b;2012a;2015)。
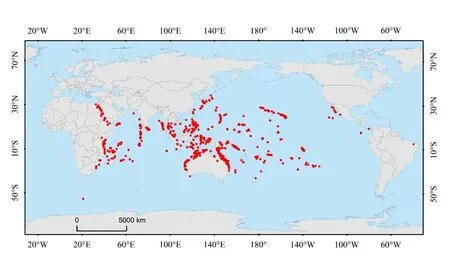
图3 石芝珊瑚的全球分布特征Fig.3 Global distribution characteristics of Fungiidae
3.1.1 跨大陆架分布模式 发育于大陆架之上的珊瑚礁是研究跨大陆架环境梯度对珊瑚组合多样性影响的理想模型(Hoeksema et al., 2019)。深度、离岸距离、海流等是影响该分布模式的主要环境参数(Cleary et al.,2005)。关于石芝珊瑚分布模式的研究表明,该物种的跨大陆架分布规律与Connell(1978)所提出的珊瑚礁“中度干扰假说”(intermediate disturbance hypothesis)一致。在对印度尼西亚Spermonde 群岛底栖生物(benthic taxa)多样性研究中发现,该地区石芝珊瑚的物种丰富度和香农多样性指数(Shannon's Diversity Index)随深度和离岸距离的变化呈单峰变化(Cleary et al.,2005)。大多数的石芝珊瑚在大陆架中部的礁斜坡上(距海岸线12.5~30.0 km,海底深度在30~50 m之间)显示出最高的丰度,这与该区域受到适宜的波浪作用密切相关(Hoeksema,2012a)。此外,对雅加达海域千岛群岛(Thousand Islands archipelago)石芝珊瑚多样性研究显示,总物种多样性的峰值出现在海底深度介于30~60 m之间的中部珊瑚礁,而不是距离大陆最远的北部珊瑚礁(Hoeksema et al.,2019)。这是由于近岸海域具有较浅的深度与强烈的地表径流影响[例如,在Hoeksema(2012a)的研究中近岸区域海底最大深度仅为15 m],导致该海域具有更低的透光度与更高的浑浊度,并抑制珊瑚的光合作用效率。因此,在近岸分布的石芝珊瑚具有更强的抵抗高浑浊度环境的能力,而部分主要生活于大深度的石芝珊瑚类型(如圆饼珊瑚属)则在该区域较为罕见(Hoeksema,2012a;Hoeksema et al.,2019)。另外,位于大陆架外缘的近海区域易受到上升流和强烈波浪作用的影响(Cleary et al.,2005; Hoeksema, 2012a),这会限制石芝珊瑚的生长。因此,仅有少量石芝珊瑚物种在生理上具备适应近岸和近海环境的能力(Cleary et al.,2005)。相比之下,大陆架中部区域海域具有较高的海水透明度(地表径流影响较弱)、较大的深度梯度(包括能让耐高浊度的物种生活的沙质基底)、较低的富营养化程度以及适宜的波浪作用,这将有利于石芝珊瑚的生长、发育,并促使其群落形成单峰结构的跨大陆架生物地理分布模式(Cleary et al., 2005;Hoeksema,2012a;Hoeksema et al.,2019)。
3.1.2 珊瑚礁地貌带分布模式 在珊瑚礁地貌带范围内,礁体物理结构会对石芝珊瑚分布产生影响,石芝珊瑚通常在陡峭的坡向地貌上表现出最高的多样性(Claereboudt, 1988; Latypov, 2007; Prasetia et al.,2020)。离岸斜坡(offshore reef slopes)是石芝珊瑚最原始的栖息地(Claereboudt, 1988; Latypov,2007; Prasetia et al., 2020),而近岸生境(onshore habitats)、浅层礁坪(shallow reef flats)和沙质基底(deep sandy reef bases)则可能隶属于衍生的栖息地(Hoeksema,2015)。Spermonde群岛珊瑚礁区的研究发现,石芝珊瑚密度的峰值出现在较为陡峭的斜坡区域(Hoeksema,2012a)。此外,光照也是影响石芝珊瑚地貌带分布的主要因素。在红海北部埃拉特(Eilat)珊瑚礁区,大多数石芝珊瑚生活于深度<10 m 的礁坪和礁坡地貌带中,密度可达15 ind/m2,并覆盖约5%的基质,而在深度10~50 m的礁坡上却很少见(Goffredo et al.2000,2003)。当水深<20 m 时,绝大多数石芝珊瑚分布于弱光照强度的礁体(受遮挡的区域)中,该生境具有较低的物种竞争水平、沉积速率和捕食强度,可为幼年石芝珊瑚提供有利的生存条件(Dinesen,1983;Sammarco,1991;Goffredo et al.,2000)。而在水深>20 m 的区域,石芝珊瑚主要分布在开阔、无遮挡的区域(Goffredo et al.,2000,2003),这可能与部分石芝珊瑚类群的趋光性密切相关(Fabricius et al.,2003)。生活在较深区域的石芝珊瑚物种的形状通常比浅水区域更为扁平,这是由于在深度较大的区域,光线主要来自上方,石芝珊瑚的形状越平坦,所能接收到的光照越充足(Hoeksema et al.,1989b)。除此之外,潟湖由于较为极端的环境通常被认为不利于珊瑚生长(覃祯俊,2020)。但已有研究发现,石芝珊瑚在南海珊瑚礁的潟湖中仍可以很好地适应和生存,甚至发生聚集现象(图4) (Hoeksema,1993;Qin et al.,2021),这可能与其共生的微生物群(microbiota)的环境适应性密切相关(Qin et al.,2019,2021),但关于石芝珊瑚在潟湖生境中的分布规律和影响因素还有待进一步研究。

图4 南海石芝珊瑚的群体聚集现象(a.西沙甘泉岛外礁坡;b.西沙银屿潟湖坡;c.西沙石屿外礁坡;d.马来西亚古达珊瑚礁外礁坡)Fig.4 Aggregation of Fungiidae in the South China Sea(a.the outer reef slope of Robert Island,Xisha;b.the lagoon slope of Yin Yu,Xisha;c.the outer reef slope of Shi Yu,Xisha;d.the outer reef slope of Kudat coral reef,Malaysia)
3.1.3 纬向分布模式 石芝珊瑚的多样性从赤道向两极随纬度的增加而降低。澳大利亚东部(09°09′S—31°28′S)的相关研究显示,石芝珊瑚物种丰富度的最大值出现在该区域的北部,仅巴布亚湾(Gulf of Papua,<10°S)就拥有近30 种石芝珊瑚。但是,位于该区域南部的弗雷泽岛(Fraser Island,>25°S)以南仅能观察到5种石芝珊瑚(Hoeksema,2015)。此外,红海北部石芝珊瑚的生长常数(K=0.049~0.109)仅为赤道附近海域石芝珊瑚生长常数(K=0.215~0.404)的一半,生长速率与纬度之间呈显著的负相关关系(Chadwick et al.,2000;Goffredo et al., 2003)。无独有偶,石芝珊瑚(Fungia fungites)的生长速率也呈现类似变化规律,其K值由澳大利亚大堡礁(Great Barrier Reef)附近(17°S)的0.215 下降至到沙姆沙伊赫(Sharm el Sheikh;27°N)的0.088(Goffredo,1995),并随着纬度的升高再次下降至埃拉特(Eilat;29°N)的0.049(Goffredo et al.,2003)。
综上,石芝珊瑚的空间分布模式在不同物种之间存在很大的差异。这可能与物种在形态和生活史策略上的差异有关。因此,进一步对石芝珊瑚的空间分布模式与变化规律进行研究,将有助于加深对该物种种质资源总量与多样性的了解,并为揭示其应对气候变化的机制与潜力提供生物地理学证据。
3.2 影响石芝珊瑚的生态环境因素
水温、浑浊度、波浪等环境因素对石芝珊瑚的生长、发育有显著影响。首先是水温。适宜石芝珊瑚生长的水温一般要求在22.0~30.0℃之间,其生长率在水温较高的热带海域要显著高于水温较低的海域(梁景芬,1981)。因此,石芝珊瑚多样性随纬度的增加而减少的现象也与水温的降低密切相关(聂宝符,1997)。但是,对日本冲绳北部珊瑚礁的相关研究却显示,在造礁石珊瑚受热胁迫影响已大量减少或局部灭绝的情况下,石芝珊瑚仍能大量存活并保持良好的健康状况(Loya et al.,2008)。这表明石芝珊瑚对热压力具有较强的耐受能力(Hoeksema, 1991; Hoeksema et al., 2011b)。其次是浑浊度。大陆沿岸的沉积速率较高,而石芝珊瑚个体的形态扁平,容易受到高浑浊度与沉积压力的影响,并导致其死亡(梁景芬,1981;Chadwick et al.,1992)。但相较于其他珊瑚,石芝珊瑚却具有独特的泥沙排斥策略(sediment exclusion strategy),并能够耐受高浑浊度的礁区环境。例如,石芝珊瑚可利用纤毛触手的活动清洁、黏液分泌和组织扩张等方式有效避免沉积物覆盖其表面(Gilmour, 2002;Bongaerts et al.,2012)。此外,波浪也是影响石芝珊瑚生长状况的因素之一。已有研究表明,波浪作用会削弱石芝珊瑚的浮浪幼虫在浅水区域的沉降能力(Ohara et al., 2021)。而石芝珊瑚成年个体普遍较小,在受到较强的波浪作用时,易被掀起、击碎或翻转致死(Dollar,1982)。因此,适宜的波浪作用将有助于石芝珊瑚的存活与生长。
4 结论与展望
本文从物种多样性、生活史和空间分布特征3个方面综述了目前石芝珊瑚的相关研究进展。石芝珊瑚是珊瑚礁生态系统框架的主要构建者之一,具有丰富的物种多样性、独特的生活史策略和广阔的生物地理分布范围。最新基于形态学和分子分类学的研究确定石芝珊瑚科现包括17 个属(约55 种)。石芝珊瑚是具有非典型性别特征的物种之一,其可通过性别转变的方式提高自身的繁殖成功率,并增强石芝珊瑚种群在应对环境压力与资源限制时的适应能力。此外,超过70%的石芝珊瑚物种具有独特的生活史特征,即幼年固着生活和成年自由生活。成年自由生活阶段的石芝珊瑚所具备的独特的生活史策略——移动性,会促使其在不同空间尺度上呈现差异分布特征,并影响其种群应对气候变化的适应性与恢复力。此外,石芝珊瑚是全球性珊瑚物种,广泛分布于印度-太平洋珊瑚礁区系,并能在岩石、沙地以及淤泥等多样化的生境中存活,其物种丰富度遵循从赤道向两极随纬度的增加而降低的规律,且满足单峰结构的跨大陆架生物地理分布模式。但目前国内对石芝珊瑚的研究还比较少,仅局限于部分珊瑚共/附生微生物的相关研究涉及到该物种(Qin et al.,2019,2021)。石芝珊瑚现有的分类系统缺乏进化生物学对分子钟的标定,其起源与进化分歧的时间及其与历史气候事件之间的关系尚不明确。此外,珊瑚以浮浪幼虫的形式在不同珊瑚礁之间迁移,是珊瑚应对气候变化的潜在生存策略。然而,目前鲜有研究从群体遗传学的角度分析石芝珊瑚的迁移扩散机制及其驱动因素。
南海珊瑚礁星罗棋布,总面积约为37 935 km2,占世界珊瑚礁总面积6.2%(王丽荣等,2014),对维持南海的生物多样性和生态平衡具有极其重要的作用(许红等,2021)。但是,自20世纪80年代以来,在气候变化和人类活动不断加剧的影响下,全球珊瑚礁生态系统受到了不同程度的损害(Silverstein et al., 2015; Heron et al., 2016; Hughes et al.,2017)。南海珊瑚礁作为连接印度—太平洋珊瑚礁区系的重要桥梁,面临着更为急剧的退化(余克服,2012,2018)。因此,探索石芝珊瑚在南海珊瑚礁生态系统中的物种多样性演变规律、空间分布特征、遗传连通性与环境适应潜力,将为全面的揭示南海珊瑚应对全球气候变化的潜力、策略与机制提供证据。结合当前研究现状,建议从以下几个方面对石芝珊瑚开展进一步研究:
1)采用形态学与分子分类相结合的技术手段,深入分析石芝珊瑚科下不同属、种的系统发育关系,系统厘定南海石芝珊瑚科的谱系,并结合化石证据与分子钟,标定石芝珊瑚各属、种的进化分歧时间,揭示地质历史时期的气候事件对石芝珊瑚物种多样性演变的影响与驱动机制。
2)借助珊瑚礁生态学的调查手段,统计南海不同纬度、岛礁和地貌带之间石芝珊瑚的丰度(科或属级)与覆盖度的空间分布特征,阐明南海石芝珊瑚多样性的变化规律与优势类型,揭示南海石芝珊瑚环境适应性的属、种间差异。
3)利用群体遗传学的相关方法,选择南海典型的广布种与区域种石芝珊瑚,从基因型的角度探讨南海石芝珊瑚的种群历史动态、遗传多样性、遗传分化以及基因交流情况,阐明多类型的地理(空间距离、地貌差异等)与环境要素(温度、光照强度、营养盐等)对南海石芝珊瑚遗传结构和联通性的生态影响,揭示南海石芝珊瑚种群的迁移扩散路径与环境适应潜力。
