细胞焦亡的生物学机制及其在乳腺癌中的研究进展
2022-12-03窦赫马爽邾月刘宇琪肖敏
窦赫,马爽,邾月,刘宇琪,肖敏
0 引言
近年来,恶性肿瘤的发病率呈上升趋势,中国每年恶性肿瘤的发病率和死亡率居全世界首位[1]。乳腺癌已经成为女性最常见的恶性疾病,每年我国新发现乳腺癌患者为40万例,占女性恶性肿瘤的16.5%。乳腺癌目前已成为严重影响女性身体健康的一种恶性肿瘤[2]。对于乳腺癌,我们提倡尽量做到早发现、早诊断、早治疗的“三早”预防。乳腺癌的治疗主要分为以手术和放疗为主的局部治疗和以化疗、内分泌治疗、靶向治疗为主的全身系统治疗。
细胞死亡普遍存在于生物界中,细胞死亡形式主要包括细胞坏死、细胞凋亡、细胞自噬、内源性死亡、坏死性凋亡等[3]。除坏死与凋亡两种常见的死亡形式外,随着研究的不断进展,细胞焦亡也引起了越来越多的关注,不同于其他细胞死亡形式,细胞焦亡可以更加迅速地引起炎性反应[4],它不仅与人体的免疫系统紧密相连,在肿瘤的发展转归中也起到了重要作用,本文将就细胞焦亡的生物学机制及其在乳腺癌中的研究进展作一综述。
1 细胞焦亡的定义
细胞焦亡的发现要追溯到二十世纪80年代。1986年,Friedlander发现,在小鼠的巨噬细胞中加入炭疽致死毒素,可使其快速裂解死亡并发生炎性反应[5]。1992年,Zychlinsky等发现了志贺氏菌和沙门氏菌感染巨噬细胞的细胞毒性机制,可诱导宿主细胞死亡,囿于当时知识的缺乏,最初将此种死亡形式归类于凋亡,随后发现此过程特异性依赖Caspase-1介导,并且介导释放白细胞介素IL-1β,引起炎性反应[6],这与既往所认知的凋亡是不同的。2001年,Cookson和Brennan将这种新的细胞程序性死亡命名为“Pyroptosis”,希腊语中“pyro”意指火与热,“ptosis”意指凋零[7]。2015年,研究[8]发现,消皮素Gasdermin-D(GSDMD)是细胞焦亡的最关键因素,Caspase-1、Caspase-4、Caspase-5和Caspase-11通过切割GSDMD使细胞裂解并释放炎性内容物。2018年,细胞死亡命名委员会(nomenclature committee on cell death,NCCD)正式将由Gasdermin家族蛋白介导的质膜膜孔形成的可控性细胞死亡命名为“细胞焦亡”[9]。细胞焦亡是一种新发现的细胞死亡形式以及被越来越多的研究人员熟悉并应用于肿瘤治疗中。
2 细胞焦亡的特点
2.1 细胞焦亡与细胞凋亡的区别
细胞焦亡是一种由半胱天冬氨酸蛋白酶-1(Caspase-1)介导的程序性死亡,与细胞凋亡有着本质区别。细胞凋亡是细胞程序性死亡的主要类型,已被人们熟知,在形态学上表现为细胞萎缩、细胞核破裂,并伴随着凋亡小体的形成[10],在凋亡过程中由Caspase-2、8、9、10识别信息,识别后由Caspase-3、6、7执行凋亡,细胞凋亡是一种生理性的基因调控,一般过程中不涉及炎性反应。焦亡同样是源于细胞的程序性死亡,由病理性刺激诱发,依赖Caspase-1、3、4、5、11介导切割GSDMD蛋白使细胞膜孔形成,细胞呈现充气球样,进而细胞破裂并释放炎性介质达到抗炎和抗菌的作用[11],在肿瘤和遗传病方面也扮演着重要的角色。
2.2 Gasdermin家族蛋白在细胞焦亡中的作用
Gasdermin家族蛋白是细胞焦亡过程中最重要的“媒介”,广泛存在于不同细胞中。Gasdermin家族成员包括GSDMA、GSDMB、GSDMC、GSDME和Pejvakin,除了Pejvakin蛋白,其余蛋白均参与细胞膜孔形成[12],诱导细胞焦亡,近年来已经证实GSDMD是细胞焦亡的关键底物,GSDMD约由480个氨基酸组成,相对分子质量为53 kDa,拥有两个结构域-氨基酸效应域[13],GSDMD在静息状态下保持自抑状态,当受到半胱天冬氨酸酶刺激后,两个效应域则会裂解为GSDMD-N端片段和GSDMD-C端片段,并发生显著的构象改变,其中,GSDMD-N端片段高度亲和心磷脂、磷脂酸等脂质成分,具有固有的细胞膜毒性作用。细胞膜脂质双分子层存在磷脂酰丝氨酸和磷酸肌醇等脂质成分,GSDMD-N端片段可以与之结合破坏细胞膜的完整性,使其形成12~14 nm的蛋白孔样结构,细胞膜上的孔隙使细胞外侧和内侧形成了通道,细胞膜的离子浓度梯度消失,破坏了渗透压[14],水分子涌入细胞,导致细胞肿胀,进而破裂,GSDMD具有多效性,同时发挥促炎和抗炎作用,使其成为抗菌和抗炎治疗的潜在靶点,释放大量的炎性因子引起炎性反应。
3 细胞焦亡的生物学机制
3.1 经典通路
3.1.1 炎性小体复合物的组成 经典通路是细胞焦亡最主要的发生方式,当机体受到刺激或被病原菌等其他因素感染威胁健康时,会迅速做出免疫应答,组装成炎性小体复合物,激活Caspase-1,切割GSDMD。炎性小体主要由凋亡相关斑点样蛋白(apoptosis-associated speck like protein,ASC),模式识别受体(pattern recognition receptor,PRR)和半胱氨酸蛋白酶-1前体(procaspase-1)组成[15]。其中,ASC是一种接头蛋白,是由热蛋白结构域(pyrin domain,PYD)和半胱天冬氨酸蛋白酶募集结构域(caspase activation and recruitment,CARD)组成,PYD属于N端,CARD属于C端。PRR主要分为四种,核苷酸结合寡聚化域养受体(nucleotide-binding oligomerization domainlike receptor,NLR)、C型凝集素受体(C-type lectin receptors,CLR)、黑色素瘤缺乏因子2样受体(absent in melaroma 2 like receptor,ALR)和Toll样受体(toll-like receptor,TLR),与procaspase-1前体共同组装成炎性小体。
3.1.2 Caspase-1介导细胞焦亡 Caspase-1在细胞焦亡的经典通路中起着至关重要的作用。炎性小体中的PRR共有两种分子模式,识别细胞内容物的模式称为病原体相关分子模式(pathogen associated molecular pattern,PAMP),识别细胞释放的危险信号的模式称为危险相关分子模式(damage associated molecular pattern,DAMP)[3],PAMP和DAMP不仅可以与细胞膜上的Toll样受体结合,从而触发炎性小体复合物及其靶物质的转录,还可以被炎性小体感受器识别,与转换器形成炎性小体复合物。作为机体的第一道防线,PRR率先识别危险信号并做出反应,机体受到PAMP和DAMP的刺激后,为了遏制入侵的微生物,与N端的PYD相结合,释放CARD,ASC再通过反平行二聚作用,形成Caspase-1酶原激活平台,Caspase-1在通常情况下是一种惰性酶原,当激活位点与酶原激活平台相接近时,Caspase-1会自动激活,这是细胞焦亡经典通路最具特点的部分[16],激活的Caspase-1可以特异性的切割GSDMD,使其分为N端和C端,前者可以通过脂质相互作用破坏细胞膜,形成质膜孔,不仅使水分子进入细胞,导致细胞肿胀进而裂解,还释放了白细胞介素IL-1β(interleukin-1β,IL-1β)和IL-18等免疫因子,招募炎性细胞,进一步引起炎性反应[17]。这种依赖Caspase-1介导切割GSDMD的细胞死亡方式则成为细胞焦亡的经典通路,见图1。
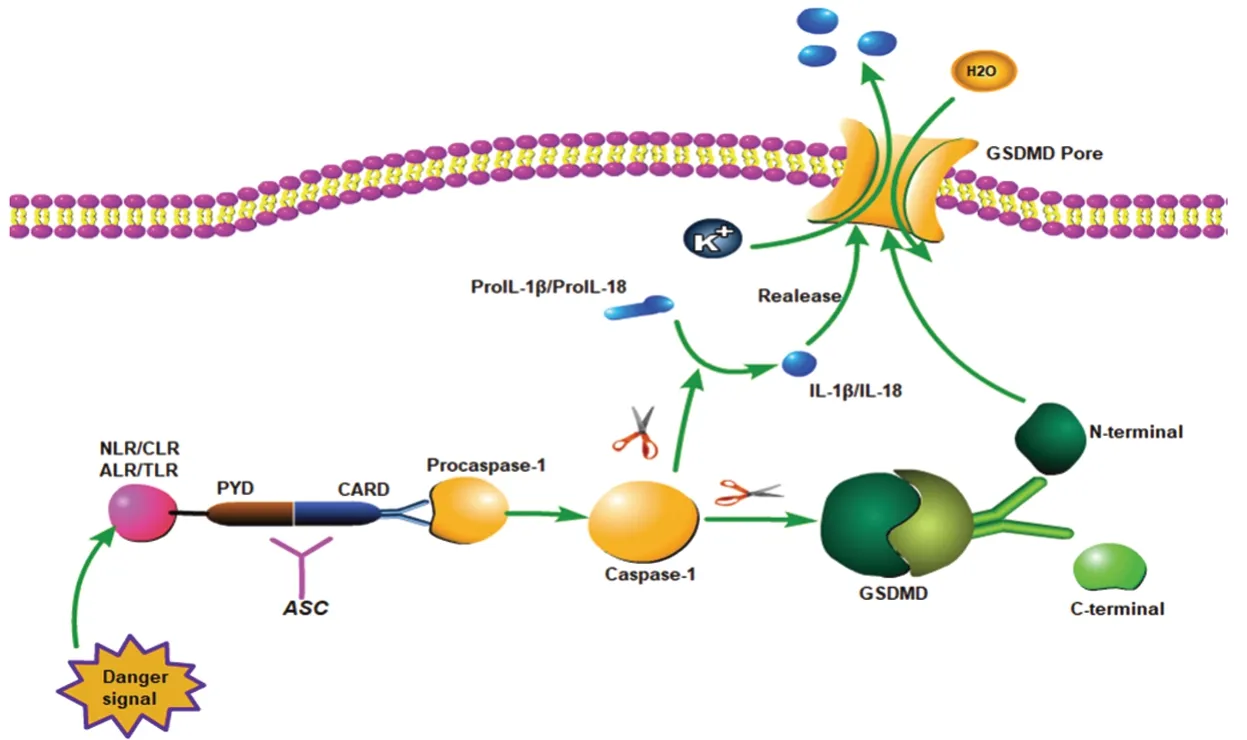
图1 细胞焦亡的经典通路Figure 1 Classical pathway of cell pyroptosis
3.2 非经典通路
与经典通路不同的是,非经典通路是由Caspase-4、Caspase-5和Caspase-11介导的。研究[18]发现,当小鼠受到革兰阴性细菌感染后,被感染的细胞进入囊泡中,被感染的细胞胞膜上的干扰素受体结合通过与γ干扰素结合,使囊泡破裂释放出脂多糖(lipopolysaccharide,LPS)。革兰阴性菌细胞壁上的LPS可以激活小鼠体内的Caspase-11(人体内存在Caspase-4和Caspase-5),Caspase-4、Caspase-5和Caspase-11被激活后,可以特异性地切割GSDMD,从而产生GSDMD-N端致使细胞膜成孔、肿胀、溶解,诱导焦亡的发生。除此之外,激活的Caspase-4、Caspase-5和Caspase-11也可以在ACS的作用下完成炎性小体复合物的构建,活化Caspase-1,还可以激活缝隙连接蛋白1(Pannexin-1,Panx-1),并引起ATP的释放、和K+的外流。刺激经典通路的发生[19],同时,Caspase-1还可以活化并分泌 IL-1β前体和IL-18前体,进一步扩大炎性反应,见图2。

图2 细胞焦亡的非经典通路Figure 2 Non-classical pathways of cell pyroptosis
3.3 其他通路
Wang等[20]研究发现,除了Caspase-1、Caspase-4、Caspase-5和Caspase-11可以介导细胞焦亡,Caspase-3和Hela细胞也可以介导细胞焦亡,他们将GSDME的Hela细胞经过放线菌酮(cycloheximide,CHX)处理后,可以将细胞凋亡转变为细胞焦亡,不仅如此,活化后的Caspase-3也可以作用GSDME的DMPD位点,特异性的剪切GSDME,使GSDME同样生成N端和C端,介导细胞焦亡。Shen等[21]研究发现,GSDME也是一种新定义的焦亡执行者,顺铂和阿霉素均以浓度和时间依赖性的方式诱导了GSDME的裂解,从而促进细胞发生凋亡;Kambara等[22]研究发现,在老化的中性粒细胞中,中性粒细胞弹性蛋白酶(ELANE)从胞质颗粒释放到胞质中。ELANE介导的GSDMD裂解位于Caspase裂解位点的上游,并产生完全活性的ELANE衍生N片段,其诱导细胞死亡的效果与GSDMD方式相同,介导中性粒细胞发生焦亡。Sarhan等[23]研究发现,耶尔森氏菌在感染过程中与细胞死亡和炎性反应形成密切相关。致病性耶尔森氏菌通过效应分子YopJ抑制MAP激酶转化生长因子激活激酶1(TGFβ-activated kinase 1,Tak1),激活Caspase-8,介导细胞死亡的同时沉默细胞因子的表达。
4 细胞焦亡在乳腺癌中的研究进展
世界卫生组织数据显示,2020年全球乳腺癌新发病例高达226万例,超过了肺癌的220万例,乳腺癌已经取代肺癌,成为全球第一大癌症,而在我国,每年新发乳腺癌患者约为40万人[24]。对于乳腺癌,很多研究发现了细胞焦亡在其发生发展中扮演着重要的角色。石瑛等[25]研究发现,给予紫杉醇治疗时,人乳腺癌细胞MCF-7中的Caspase-3和GSDME的活性明显增加,LDH释放也会增加,通过诱导细胞焦亡发挥抗肿瘤作用,GSDME启动子区在大部分肿瘤细胞中处于甲基化状态,因而处于基因沉默状态,而当研究人员通过RNA干扰技术敲除MCF-7细胞中的GSDME片段,则紫杉醇的效果会大幅度降低。Jiao等[26]研究也发现,人脐带间充质干细胞(human umbilical cord mesenchymal stem cell,HUC-MSC)可作为细胞癌症治疗的新工具,通过将HUC-MSCs的分泌因子暴露于HUC-MSCs的条件培养基中来评估HUCMSCs分泌因子对乳腺癌细胞MCF-7的影响,发现其可以通过细胞焦亡导致MCF-7死亡,起到抑制肿瘤生长的作用。Huang等[27]研究发现,乳腺癌患者中,GSDME表达的增加使细胞更容易触发Caspase-3依赖的凋亡信号通路,将GSDME基因敲除后增加了体外细胞侵袭性,证明了GSDME与乳腺癌患者的淋巴结转移密切相关。Pizato等[28]研究发现,在乳腺癌MDA-MB-231细胞中补充二十二碳六烯酸(docosahexaenoic acid,DHA),并分析炎性反应细胞死亡。发现与未处理的细胞相比,DHA处理的乳腺癌细胞触发Caspasase-1和GSDMD激活增加,增强IL-1β分泌,发现了DHA诱导乳腺癌细胞的一种新的细胞死亡途径,并指出细胞焦亡是介导抗癌治疗的一个新的突出靶点,DHA可以触发MDA-MB-231三阴性乳腺癌细胞的焦亡,这为DHA的抗癌作用提供了新的线索。
乳腺癌被认为是免疫原性差的肿瘤类型,Elion等[29]研究发现,使用工程化的维甲酸诱导基因I(retinoic acid inducible gene I,RIG-I)激动剂治疗乳腺癌,导致RIG-I的上调以及促炎转录因子的活化,从而引发细胞焦亡,RIG-I激动剂还诱导淋巴细胞募集趋化因子的表达,乳腺肿瘤中的RIG-I活化增加了肿瘤淋巴细胞并减少了肿瘤的生长和转移。Li等[30]研究发现双氢青蒿素对乳腺癌也有抑制作用,研究人员建立了乳腺癌移植瘤模型,通过qRT-PCR和蛋白质印迹分别分析乳腺癌细胞mRNA和蛋白质水平,ELISA试剂盒用于评估IL-1β和IL-18的产生,发现双氢青蒿素激活了黑色素瘤2、Caspase-3和GSDME的表达,通过诱导乳腺癌细胞凋亡来抑制肿瘤发生,这突出了一种有前途的乳腺癌治疗策略。Li等[31]研究发现,P2X7受体的过表达与肿瘤生长和转移相关,研究人员将伊维菌素作为变构调节P2X4受体的原型药物,可以在乳腺癌细胞中嘌呤能信号转导的双重存活和细胞毒性功能之间取得平衡,激活Caspase-1,诱导细胞凋亡。Cheng等[32]研究发现,牙周炎性反应在转移的早期阶段招募髓源性抑制细胞(myeloid-derived suppressor cells,MDSC),通过细胞焦亡诱导的IL-1β生成来促进乳腺癌转移,此研究定义了IL-1β在乳腺癌转移进展中的作用,并强调了控制牙周炎性反应的必要性。Faria等[33]研究也发现,慢性炎性反应通过改变肿瘤的免疫微环境来影响乳腺癌的进展、转移潜力和治疗结果,导致急性和慢性炎性反应的关键途径是NLRP3炎性小体被激活,然后依赖Caspase-1激活释放IL-1β和IL-18促炎性细胞因子,研究人员发现当NLRP3炎性小体活化时,会促进乳腺癌生长,了解细胞焦亡的双重性,可能会极大地促进乳腺癌新治疗策略的发展。
5 小结与展望
既往人们对细胞焦亡的认知较少,主要集中在细胞凋亡,细胞焦亡是新近发现的一种细胞程序性死亡方式。细胞焦亡的经典通路是通过Caspase-1介导的,非经典通路是通过Caspase-4、5、11介导的,两种通路均可产生IL-1β和IL-18等内源性免疫因子,可以对肿瘤起到杀伤作用,但也会引起肿瘤的发生与发展,释放过度甚至会导致免疫性疾病和炎性反应,还有Caspase-3或Hela细胞介导的特殊通路。多个证据已经表明,细胞焦亡的生物学机制任何一个环节出现变化,都可能对肿瘤的发生和转归起到不同的影响。
经过多年的研究,细胞焦亡的生物学机制研究已经有了很大进展,并且发现了细胞焦亡与其他恶性肿瘤之间的关系,尤其是乳腺癌,已经将其应用在临床和基础研究上。但目前细胞焦亡在肿瘤上的具体机制还不完善,临床应用还面临着诸多考验,但细胞焦亡在肿瘤的治疗方面有着良好的前景,我们需要进行更多的临床试验和数据分析。
