基于生物打印技术的间接共培养体系的构建
2022-12-02毕效铭袁长永
毕效铭,王 雯,2,高 茜,袁长永,3
三维打印是一种以数字程序为基础,通过逐层打印的方式来构造物体的技术,被广泛应用于颌面部修复、关节和骨盆手术、器官再造等方面[1]。同时,在数字化正畸、数字化种植、颌骨重建等口腔领域,三维打印也发挥着重要作用[2]。三维生物打印是三维打印的一个分支,它以负载细胞的生物墨水为原料,按预设的路径打印结构,在牙再生[3]、皮肤修复[4]、成骨[5]、成软骨[6]、组织工程[7]等领域均有巨大的发展前景。
甲基丙烯酰化明胶(GelMA胶)是一种水凝胶材料,细胞相容性和组织相容性良好,且具有一定的机械强度,是理想的生物墨水材料[8]。牙髓干细胞(dental pulp stem cells,DPSCs)是一种间充质干细胞,在一定诱导条件下可以成骨和成血管[9-10],具有多向分化潜能和神经血管特性[11]。人脐静脉血管内皮细胞(human umbilical vein endothelial cells, HUVECs)具有一定的干细胞潜能,是一种常用的细胞模型。
目前存在的共培养体系大多是体外共培养。本实验计划利用生物打印技术,以GelMA30胶为原料,构建新型间接共培养体系。若实验成功,将为后期检测共培养体系下干细胞的成骨和成血管能力,建立既可以应用于体外、也能够体内移植的间接共培养体系奠定基础。
1 材料与方法
1.1 试剂与仪器
α-MEM培养基(Gibco,美国),ECM培养基(ScienCell,美国),胎牛血清(天杭生物,湖州),胰酶细胞消化液、青霉素-链霉素溶液、4%多聚甲醛溶液(微科曼得,徐州),1×PBS、1×D-PBS(凯基生物,中国),GelMA30水凝胶(EFL产业化公司,苏州),Calcein/PI细胞活性与细胞毒性检测试剂盒(碧云天,上海),HUVECs(中乔新舟,上海),DPSCs自行分离培养并经形态学鉴定。
三维打印机(Regenovo Bio-Architect®,捷诺飞,中国),Stellaris 5超高分辨激光共聚焦显微镜(徕卡,德国),BX43研究级正置荧光显微镜(Olympus,中国)。
1.2 配制GelMA溶液
1.2.1 配制0.25%引发剂 避光条件下,取GelMA30试剂盒中的光引发剂LAP 0.05 g,加入20 mL PBS,40~50 ℃水浴加热15 min,持续振荡,直至LAP完全溶解。
1.2.2 配制5% GelMA30 取1 g GelMA30胶置于50 mL离心管内,加入20 mL引发剂,37 ℃水浴锅内避光加热20~30 min并持续振荡,直至GelMA30胶完全溶解。将配好的GelMA30胶过滤灭菌。
1.3 出丝测试和可打印性测试
控制室温23 ℃,出丝速度5 mm/s,压强0.04~0.08 MPa。将配制好的GelMA30胶置于4 ℃摇床上,孵育20 min,再置于一定温度的喷头上孵育20 min,然后出丝。低温喷头分别控温15、17、19、21、23、25 ℃,检测不同温度下的出丝情况,由此确定喷头的最适温度为21~23 ℃。
在最适温度下,打印一根连续不间断的丝,置于间隔分别为1、2、3、4、5、6 mm的支架上,观察丝的塌陷程度并测量丝的下垂距离。
配制GelMA30胶,置于5 mL光固化料筒中,4 ℃摇床孵育20 min。预设三维打印机的参数,平台控温5 ℃,低温喷头控温21 ℃,室温控制23 ℃;构建圆形网格状模型,每层0.2 mm,共5层,断丝抬高1 mm,两丝间距1 mm。将料筒从摇床转移至低温喷头上,控温20 min。试出丝,出丝速度5 mm/s。待出丝顺畅后,按预设路径开始打印。打印完成后光固化2次,每次20 s。在正置荧光显微镜下拍摄上层、中层、下层的孔隙照片,用Image J分别测量孔隙的周长(L)和面积(A),运用公式计算模型的可打印性(printability,Pr)[12]。
1.4 细胞活死检测
1.4.1 DPSCs活死检测 在三维打印机上构建同心圆模型,直径8 mm,每圈间隔1 mm,共7圈,如图1所示。每层高0.2 mm,共5层,总层高1.0 mm。

图1 同心圆模型路径图
以10% MEM培养基代替PBS配制GelMA30胶。在无菌环境下,将1 mL 5% GelMA30与2×106个DPSCs混合均匀,置于5 mL光固化料筒中,4 ℃摇床孵育20 min,低温喷头控温20 min。出丝顺畅后,按预设路径开始打印。所有模型均打印在60 mm培养皿中。
打印完成后,光固化2次,每次20 s。24孔板中加入1 mL 10% MEM培养基,用无菌镊子将模型转移至培养基中,放入37 ℃、5% CO2培养箱培养。使用Calcein/PI细胞活性与细胞毒性检测试剂盒进行活死染色。避光条件下,向1 mL染色缓冲液中加入10 μL Calcein AM和10 μL PI配制染色剂。于模型培养的第1天和第7天,吸弃24孔板中的培养基,加入PBS冲洗3次,吸弃PBS,加入0.5 mL染色液,使其覆盖模型。避光条件下,将24孔板移入培养箱内培养45 min。染色结束后,PBS冲洗模型3次并吸弃。用激光共聚焦显微镜观察活死情况,计算细胞存活率。
1.4.2 HUVECs活死检测 以10% ECM培养基代替PBS配制GelMA30胶。将1 mL 5% GelMA30与2×106个HUVECs混匀,打印同心圆结构,打印参数和方法同上。在24孔板内加入1 mL ECM培养基,移入固化后的模型,放入培养箱培养。在第1天和第7天,活死染色45 min,D-PBS反复冲洗后,用激光共聚焦显微镜观察,并计算细胞存活率。
1.5 构建共培养模型
1.5.1 构建DPSCs-HUVECs直接共培养模型(M组) 用1∶1混合的MEM培养基和ECM培养基代替PBS配制GelMA30胶。将1 mL GelMA30胶与2×106个增强型绿色荧光蛋白(enhance green fluorescent protein, EGFP)基因转染的DPSCs细胞(EGFP-DPSCs)和2×106个负载表达mCherry质粒的慢病毒转染HUVECs细胞(mCherry-HUVECs)混合均匀(细胞总密度为4×106个/mL),置于5 mL料筒中,4 ℃摇床孵育20 min,移至21 ℃控温喷头控温20 min,打印同心圆模型并进行光固化。24孔板内加入MEM培养基与ECM培养基各500 μL,混合均匀后将模型移入。
1.5.2 构建单纯DPSCs培养模型(D-D200组) 以不含细胞的GelMA30胶作为间隔物,将含细胞的胶分隔开,此时DPSCs的间距为200 μm。用MEM培养基代替PBS配制GelMA30胶。将1 mL GelMA30胶与4×106个EGFP-DPSCs混合,打印D-D200模型并固化。24孔板内加入1 mL MEM培养基,移入模型。
1.5.3 构建单纯HUVECs培养模型(H-D200组) 使用mCherry-HUVECs和ECM培养基,步骤同1.5.2,构建间距为200 μm的单纯HUVECs培养模型。
1.5.4 构建DPSCs-HUVECs间接共培养模型(M-D0组) 分别配制细胞密度为4×106个/mL的EGFP-DPSCs和mCherry-HUVECs的GelMA30胶,步骤同上。将两个料筒分别置于2号、3号低温喷头,使其交替打印同心圆结构,并进行光固化。24孔板内加入MEM与ECM各500 μL,混合均匀后将模型移入。
1.5.5 构建DPSCs-GelMA30胶-HUVECs模型(M-D200组) 配制细胞密度为4×106个/mL的EGFP-DPSCs胶、4×106个/mL的mCherry-HUVECs胶和不含细胞的GelMA30胶。以不含细胞的GelMA30胶作为间隔物,间距为200 μm。将三个料筒置于2号、3号、4号低温枪头,交替打印同心圆结构,并进行光固化。24孔板内加入MEM与ECM各500 μL,移入模型。
1.5.6 构建DPSCs-GelMA30胶-HUVECs模型(M-D400组) 步骤同1.5.5,打印间距更改为400 μm。
以上6种模型均在37 ℃、5% CO2培养箱中培养24 h,使用激光共聚焦显微镜观察荧光细胞分布情况并拍照。
2 结 果
2.1 出丝试验和打印参数
低温喷头控温15~19 ℃时,出丝粗糙,有颗粒感;21~23 ℃时,出丝连贯顺滑;>25 ℃时,出丝呈液滴状(图2)。因此,低温喷头宜控温21~23 ℃。打印参数见1.3部分。

图2 不同温度下的出丝状况
2.2 可打印性测试
出丝塌陷试验:出丝可顺利悬挂在支架上而不发生明显塌陷,下垂距离为0.2 mm,证明5% GelMA30胶有一定的支持强度(图3)。打印圆形网格状模型:根据孔隙的面积和周长计算出Pr平均值为0.97±0.02。综上,证明5% GelMA30胶具有良好的可打印性。

图3 出丝塌陷试验
2.3 DPSCs和HUVECs细胞存活率
细胞存活率=活细胞数/总细胞数×100%。在5%的GelMA中,细胞存活状况良好(图4),并可以进一步伸展(图5)。具体结果见表1。
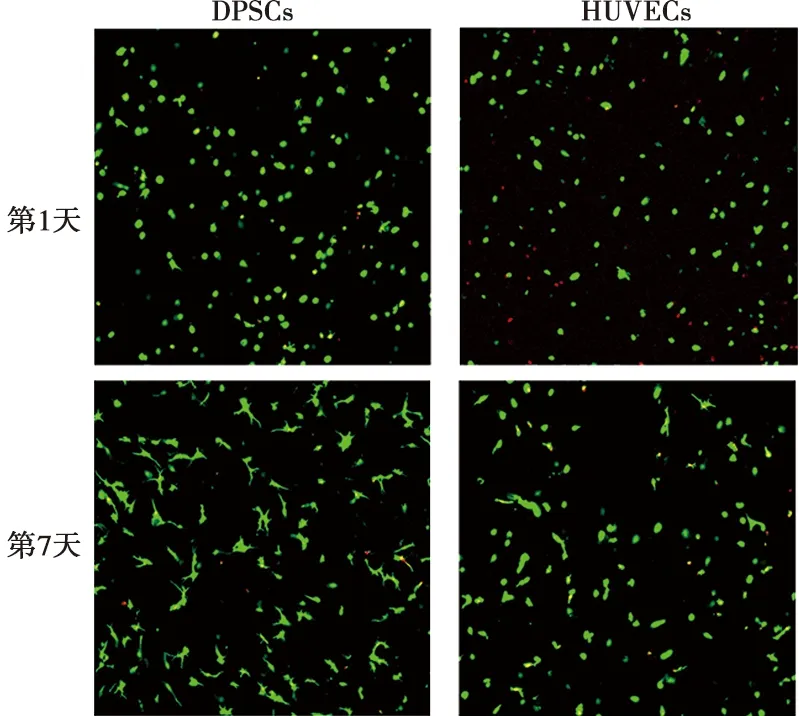
图4 DPSCs与HUVECs活死染色平面图( ×40)
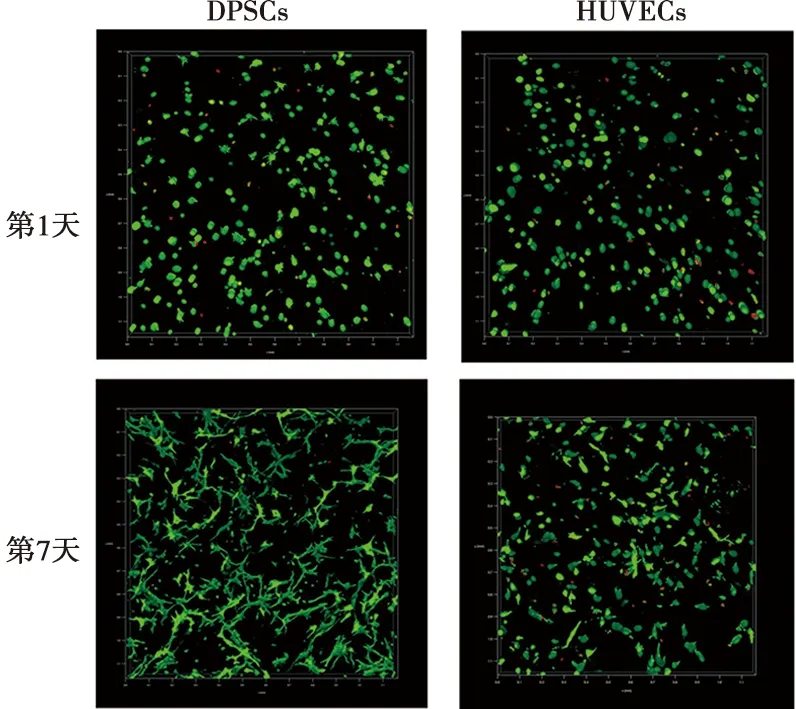
图5 DPSCs与HUVECs活死染色三维空间图( ×40)

表1 DPSCs与HUVECs活细胞率
2.4 6种同心圆共培养体系的构建
6种共培养体系的三维打印模型、三维打印路径和激光共聚焦显微镜下照片见图6。实验结果表明,可以顺利打印出6种预期的模型结构。

图6 同心圆共培养模型
3 讨 论
随着牙髓再生(regenerative endodontic procedures,REPs)技术的进一步发展,共培养体系逐渐成为近些年的研究热点[13]。Liu等[14]的实验结果表明,HUVECs培养液可以影响DPSCs的分化。吴一梦等[15]发现,在牙本质提取液中,HUVECs与DPSCs共培养,可促进DPSCs成血管并向成牙本质细胞分化。提示HUVECs可通过共培养促进DPSCs的各向分化,从而恢复牙髓的部分功能。Dissanayaka等[16]发现,共培养条件下,DPSCs不仅可以增加血管内皮生长因子(vascular endothelial growth factor,VEGF)的表达,还能促进HUVECs的迁移,进而促进早期血管网的形成。安莉等[17]的研究表明,HUVECs与DPSCs共培养可以促进体外血管再生。因此,负载DPSCs和HUVECs的GelMA水凝胶可用于临床牙髓血运重建治疗[18]。本实验以加入DPSCs和HUVECs的5% GelMA30作为生物墨水,成功打印出同心圆状间接共培养结构,为共培养提供了全新的打印模板。
本实验旨在为构建体内外均可应用的共培养体系奠定基础,为共培养体系的口腔应用提供新思路。后续可在不同共培养环境中,研究同心圆模型成骨、成牙本质、成血管潜能,以期构建可用于REPs的共培养体系;也可将该共培养体系与不同种类的支架材料相结合[19],构建出功能完整、更多样化的牙髓支架[20];还可将这种共培养体系植入动物体内,观察其REPs的效果。将DPSCs植入外伤的年轻恒牙的治疗已有成效[21],共培养体系的体内应用也有望实现。此外,还可以拓宽生物打印的应用范围,推动生物打印与口腔领域、组织细胞培养等多个领域的融会贯通。
