K2FeO4氧化页岩气压裂返排液动力学及机理研究
2022-12-01刘文士熊兴洋
刘 钰,刘文士,肖 笑,熊兴洋,王 波
(西南石油大学化学化工学院,四川 成都 610500)
随着页岩气产业的快速发展,页岩气压裂返排液废水的有效管理已成为紧迫的环境和工程问题。页岩气压裂返排液含有高浓度的盐、固体悬浮物、重金属、微生物和从页岩地层释放的难降解有机物,或作为添加以增强水力压裂的化合物的化学残留物[1]。针对有机物去除的传统技术研究,主要包括生物法、吸附法、氧化法(O3氧化、Fenton氧化)等。由于返排液的难降解及高盐等特性限制,生物处理法中耐高盐菌株筛选成本高、生物降解制约;吸附材料在实际水样中效果欠佳;O3氧化易与返排液中氯离子发生反应,生成毒性更大的溴代副产物;Fenton氧化虽能有效降解有机物,但在工程上需要反复调节pH[4]。因此,有机物的高效处置方法一直备受关注。
近年来,高铁酸盐(K2FeO4)作为绿色氧化剂具有高氧化还原电位,兼具氧化-混凝-杀菌等功能,已引起学者的广泛关注。此外,K2FeO4由于不与氯离子反应、氧化能力强、不产生新的污染物等优点[6],被推荐用于页岩气压裂返排液的高盐复杂有机废水处理。杨元林[7]发现K2FeO4对压裂返排液中COD的去除可达59.9%。但是对于K2FeO4氧化技术用于氧化处理页岩气压裂返排液的动力学及机理鲜见报道。
在本研究中,我们考察K2FeO4对页岩气压裂返排液中有机物的氧化降解,对其反应条件进行了考察和优化同时, 提出了该降解的有机物动力学,深入探索了该反应的反应机理,最后,利用气相色谱-质谱(GC-MS)分析特征污染物DBP的降解中间产物,推测了其可能的降解途径, 以期为实际工艺应用提供理论依据。
1 实 验
1.1 实验装置与方法
将固体K2FeO4(科龙,成都)加入磷酸盐缓冲液(pH=9)中制备K2FeO4溶液,并快速使用。在500 mL锥形瓶中用水浴磁力搅拌器进行了一系列的试验实验。初始溶液的pH值用1M NaOH或H2SO4调节。将压裂返排液中(300 mL)加入锥形瓶中,随后加入K2FeO4以启动反应。在规定的时间间隔内,加入1 M硫代硫酸钠进行淬灭,并分析水样COD。此外,K2FeO4氧化DBP实验程序与此类似,每间隔一定时间,从锥形瓶取样,分析样品的中间产物等。
1.2 测试方法
1.2.1 常规测试方法
COD采用快速消解分光光度法测定,pH由pH计(PHS-3C,雷磁,上海)测定。
1.2.2 GC-MS的测定
GC-MS的测定,采用GC-MS(Agilent 7890B-5977A,Aglient, USA)测定废水中有机物及特征污染物,进样口温度25 ℃,分流比(10:1),升温程序柱温30 ℃保持6 min,以4 ℃/min升至60 ℃保持1 min, 以10 ℃/min升至110 ℃保持5 min,再以20 ℃/min升至150 ℃保持1 min。质谱采用电子电离源,电子能量70 eV,灯丝电流200 μA,电子倍增器1200 V。
1.3 氧化反应动力学
K2FeO4体系去除 COD可以分为两个阶段,一个是初始快速反应阶段,一个是缓慢降解阶段,该反应过程不符合一级动力学和二级动力学规律,因此采用一个可以描述两个反应阶段的动力学方程,该方程被证实可以很好的来对反应进行拟合[8]。动力方程如式(1)所示:
(1)
式中:[COD]t——在反应时间为时的浓度
[COD]0——初始浓度
1/k——理论最大去除率
1/b——表观速率常数(kobs)
对式(1)变形得(2):
(2)
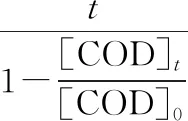
2 实验结果与讨论
2.1 K2FeO4氧化反应动力学
如图1所示,根据式(2)动力学方程拟合的相关系数R2>0.9,计算得到COD降解反应的速率常数。
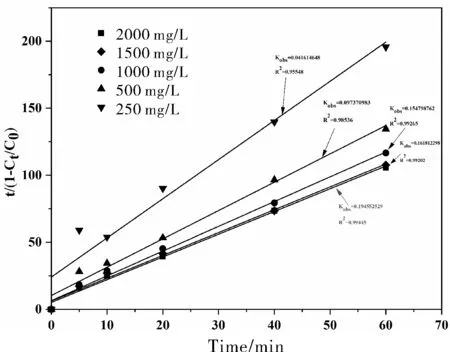
图1 不同高铁酸盐浓度反应的COD去除动力学拟合图
如图1所示,当K2FeO4的浓度分别为250、500、1000、1500、2000 mg/L时,COD去除时的速率常数分别为0.04162、0.09737、0.1548、0.1618、0.1946 min-1。结果表明随着氧化剂K2FeO4浓度的提高,反应速率逐渐增大。
此外,如表1所示,通过式(2)得到的COD的理论最大去除率,由250 mg/L增加到1500 mg/L时,去除率明显提升,由34.23%增至58.72%,再升高K2FeO4浓度(2000 mg/L)去除率几乎不再增加。根据先前的研究,K2FeO4能通过多种机制与有机污染物发生反应。当K2FeO4浓度较高时,由于K2FeO4的自我分解,去除率没有明显提高,如公式(3)所示[10]。根据成本等因素,选择K2FeO4浓度为1500 mg/L为最佳条件。
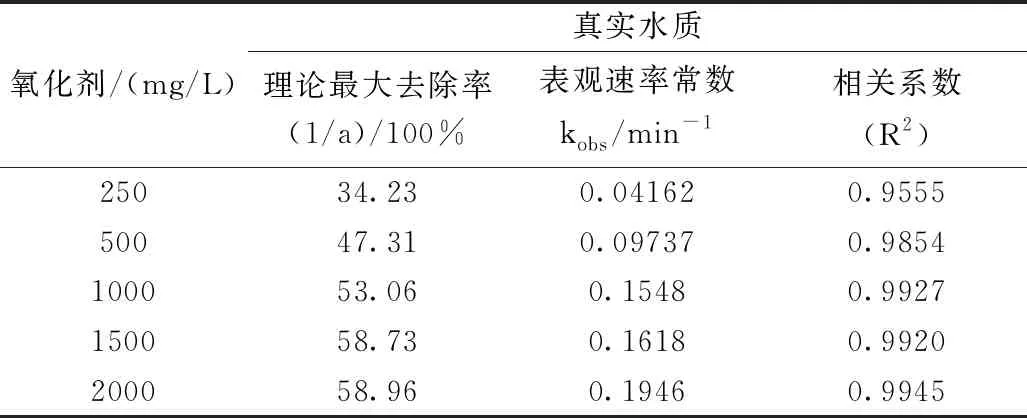
表1 不同投加量氧化动力学模拟参数结果
(3)
类似地,如图2所示,根据式(2)动力学方程拟合的相关系数R2>0.9,计算得到在不同初始pH条件下COD降解反应的速率常数。

图2 不同pH反应的COD去除动力学拟合图
如图22所示,当不同初始pH分别为7、8、9、10、11 mg/L时,COD去除的速率常数分别为0.1493、0.1565、0.07587、0.1064、0.1079 min-1。结果表明,在初始pH为中性条件下(pH=7、8),COD去除的反应速率常数高;相反在碱性条件下,COD去除的反应速率常数低,尤其是在pH=9的条件下。这可能的原因是,在pH=9时高铁酸盐虽然仍具有较高的氧化还原电位(0.7 V),但在此pH条件下K2FeO4稳定不易产生活性物质,导致氧化时反应速率常数最低[11]。
此外,根据表2所示,通过式(2-11)得到的在不同pH条件下COD的理论最大去除率,在初始pH 8时去除率最大,达59.30%再升高pH去除率降低,pH=9时最低仅为44.42%。说明氧化反应的初始pH不仅会影响COD氧化去除速率同时也影响着COD的去除率,其两者的规律具有相似性。最终确定初始pH=8为最佳反应pH值。
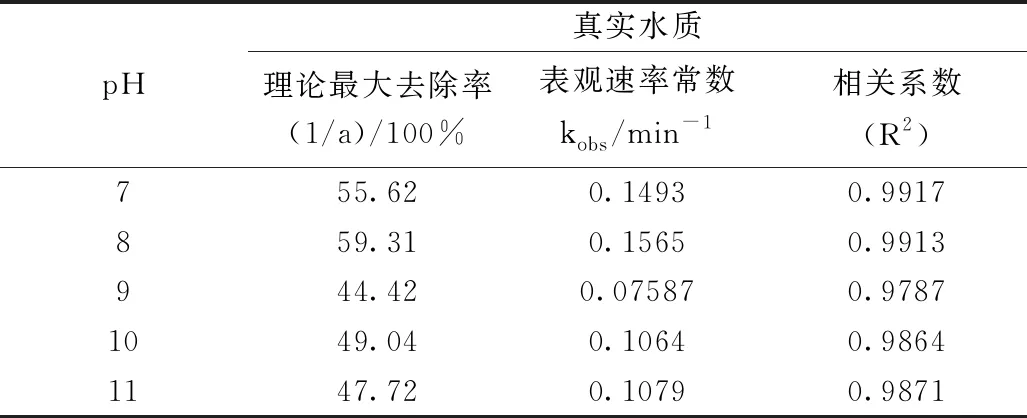
表2 不同pH氧化动力学模拟参数结果
同样地,对不同温度条件下氧化反应进行动力学拟合,其结果如图3所示。根据式(3)动力学方程拟合的相关系数R2>0.9。

图3 不同温度反应的COD去除动力学拟合图
在不同温度分别为15 ℃、20 ℃、25 ℃、30 ℃时,COD去除的速率常数分别为0.0707、0.1385、0.1618、0.1623 min-1。结果表明随着反应温度的提高,反应速率逐渐增大。
如表3所示,通过式(2)得到的COD的理论最大去除率,不同温度(15 ℃、20 ℃、25 ℃、30 ℃)时分别为45.99%、50.85%、58.72%、54.33%。随着反应温度的升高,COD氧化去除速率一直在提高,而COD的去除率先升高在降低。因此,最佳反应温度选择25 ℃。
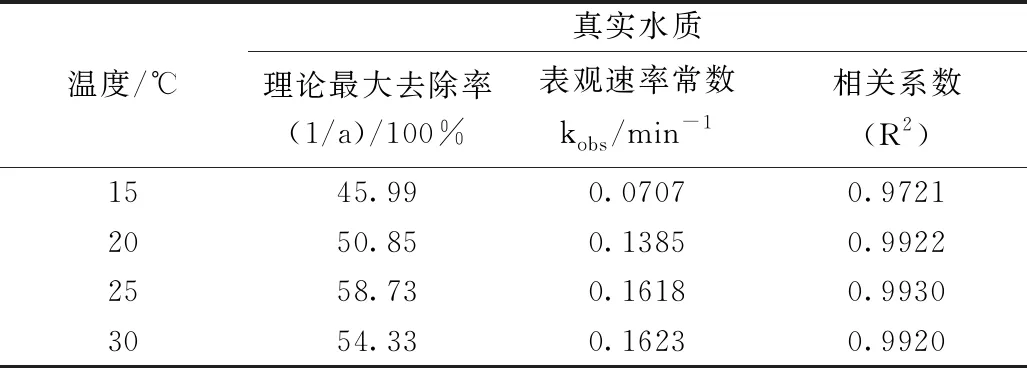
表3 不同温度氧化动力学模拟参数结果
2.2 高铁酸盐对废水中有机物的机理
K2FeO4通过水解途径容易转化为Fe(Ⅲ)、Fe(V)、Fe(IV),并且可以产生·OH,之后Fe(V)、Fe(IV)和·OH进攻废水中有机物的不同位点,从而氧化降解有机物(4-5);大部分的·OH重新聚合形成H2O2,Fe(II)可以进行类芬顿反应,进而产生更多的·OH,促进有机物的氧化(6-8)[10]:
(4)

(5)

(6)

(7)

(8)
为了进一步支持压裂返排液去除COD的效率,在最佳条件下,利用GC-MS光谱获得了K2FeO4氧化处理前后压裂返排液的有机组成。如图4所示,返排液中含有各种类型的复杂有机物,其中以苯系物、胺类、酯类和杂环类化合物为主,并含有有毒有害持久性有机污染物,如邻苯二甲酸二丁酯(DBP)。在最佳操作条件下,在K2FeO4氧化过程中,苯系物、酚类、酯类和杂环类化合物的相对丰度显著降低。残余有机物以环氧硅烷、烃类等直链有机物为主;它们的起源和归宿值得进一步探究。综上所述,这些信息表明K2FeO4氧化处理可以有效氧化页岩气压裂返排液中的大部分有机污染物。
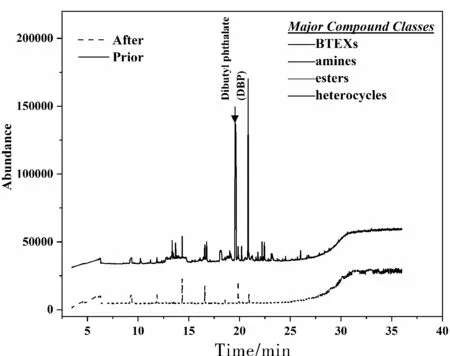
图4 高铁酸钾反应前后返排液内有机物的GC-MS谱图
2.3 特征污染物DBP可能降解途径
在页岩气压裂返排液中含有大量有毒有害、持久性污染物。虽前文已经分析了氧化前后有机物含量及种类的变化,但是仍缺少对单个有机物氧化降解路径的深刻认识。特别是,其中的邻苯二甲酸二丁酯(DBP)同时是中国水环境优先污染物和美国环境优先控制污染物。且已有报道称,邻苯二甲酸类物质作为内分泌干扰素,若未进行处理直接排放,会以多种形态、高风险性存置于环境中,对生物体造成持久性危害[14-15]。因此阐明DBP的降解机制很有意义。
2.3.1 中间产物识别
为了更好地了解 DBP 和K2FeO4的相互作用过程,使用 GC-MS 分析研究了 DBP 的降解产物,详细结果如表 4 和图 5 所示。结合GC-MS对中间体鉴定的分析要求,实验在较高的DBP浓度(500 mg/L)和较长的反应时间(30 min)下进行。
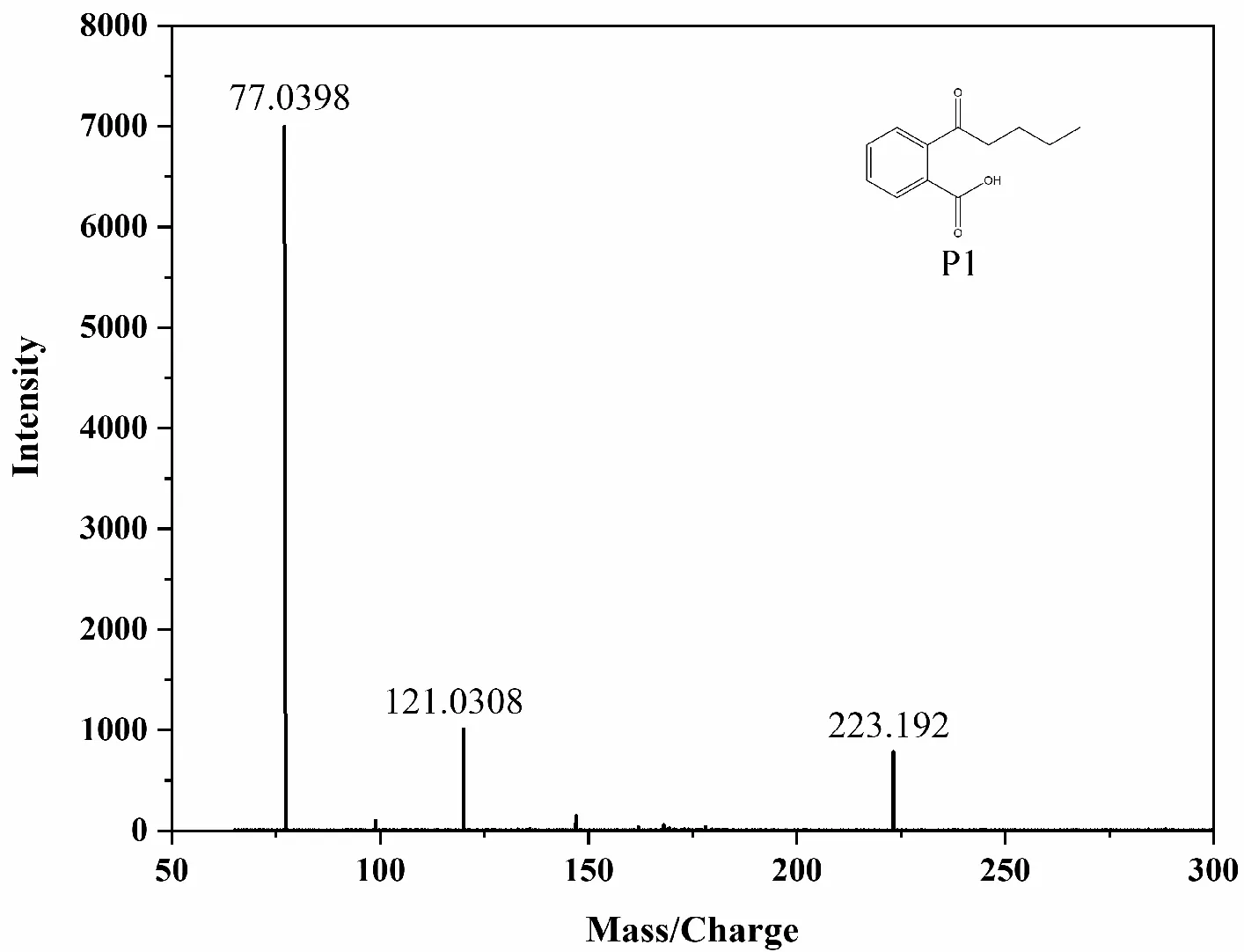
图5 Fe(VI)体系中DEP降解中间体(P1~P6)的MS/MS谱及其所提出的裂解途径和裂解模式
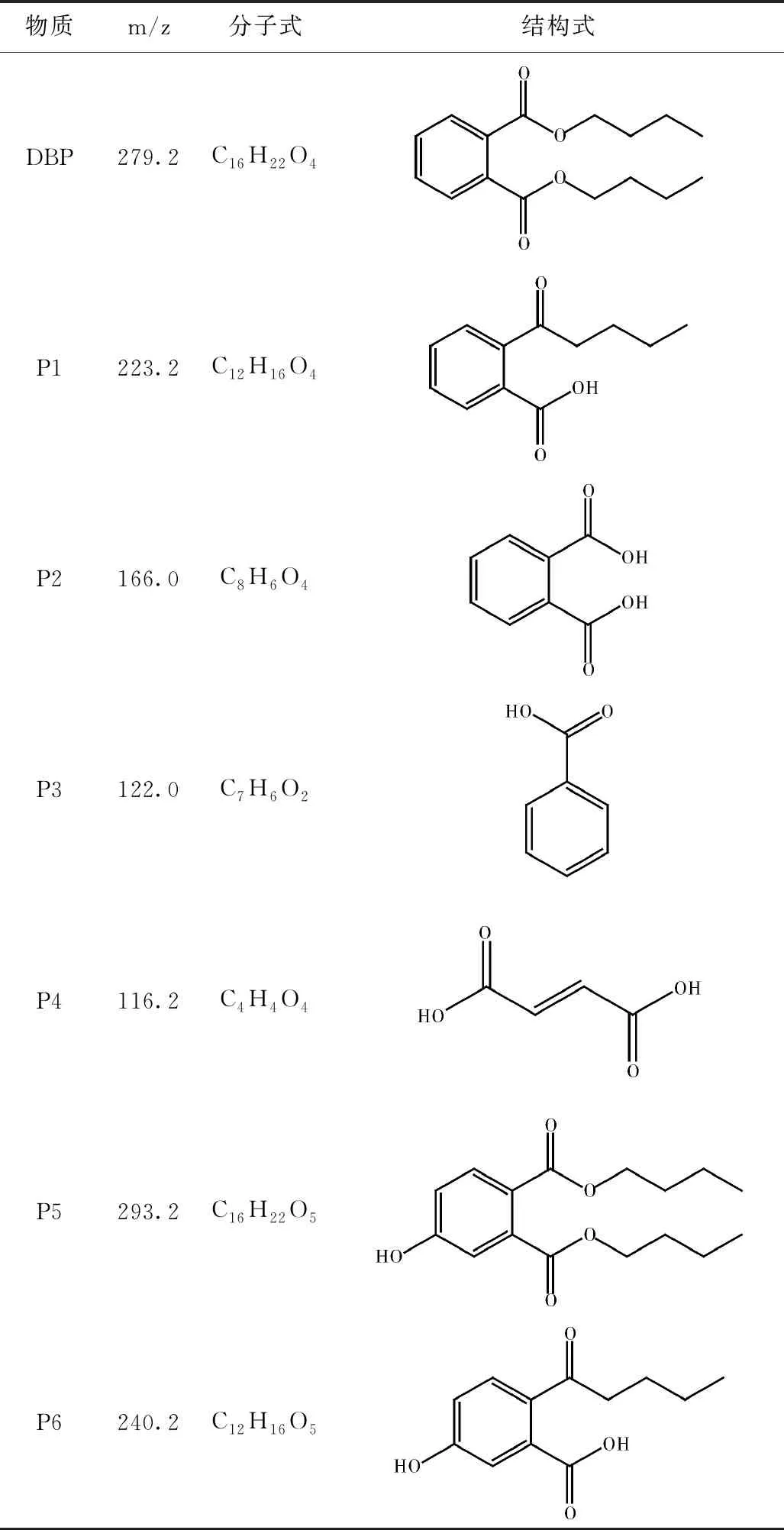
表4 DBP降解主要中间产物
DBP通过与 K2FeO4的相互作用转化为多种中间物质。通过K2FeO4氧化在 DBP 降解过程中发现了六种产物(P1~P6)。
基于已鉴定的降解产物,图 6 中提出了K2FeO4对 DBP 的两种可能的降解途径[6]。途径 I 由水解反应引发。DBP中烷烃链的酯基团的裂解导致形成单酯化合物 (P1)。邻苯二甲酸 (P2) 通过 P1 的持续水解形成。途径II被认为是由K2FeO4介导的羟基化反应。该途径表明苯环首先被K2FeO4攻击形成羟基加合物。通过从 Fe(VI) 转移氧,DBP被转化为中间产物DBP-OH (P4)。如图 6 所示,两种可能的降解途径互相独立,水解反应产生的中间体也可以沿着途径II继续被K2FeO4羟基化(即 P5 和 P6 的产生)。类似地,羟基化产物(P4)也可以发生水解反应生成P5。

图6 Fe(VI) 对 DBP 的两种可能的降解途径
2.3.2 可能的氧化降解机制
在途径 I 中,DBP可通过逐步水解降解,产生邻苯二甲酸单乙酯 (P1)、醇类和邻苯二甲酸 (P2)。K2FeO4介导的水解机理如图7所示。通过前沿电子密度 计算表明, K2FeO4倾向于攻击酯基的C=O桥键,伴随着碳和氧原子之间的直接相互作用在 K2FeO4分子中。氧转移机制详细描述,如图 7 所示,产生邻苯二甲酸单乙酯 (P1) 和·OH,同时,K2FeO4被还原为 Fe(IV)[12]。以类似的方式,P1可以发生水解反应生成邻苯二甲酸(P2)。 DBP 的另一侧链进一步受到 K2FeO4的攻击,导致产生K2FeO4物种的2-e-转移机制。随后,P2脱羧生成P3,发生羟基化反应生成P6。

图7 途径 I降解机制
途径 II 呈现了由 K2FeO4介导的羟基化反应。K2FeO4在水溶液中自分解形成·OH[16],然后DBP被这些·OH攻击形成单羟基化的DBP (P4)。 P4 的结构是从前沿电子密度计算推导出来的。另一种羟基化方式如图8所示。首先,K2FeO4攻击DBP分子苯环上的碳原子,随后产生以碳为中心的自由基,K2FeO4被还原为Fe(V)。然后 K2FeO4的O原子通过氧转移机制与苯环上的活性H相连随后苯环上的缺电子氧原子从 K2FeO4中提取了氢原子,导致形成 OH-加合物产物并将 Fe(V)还原为 Fe(IV)。此外,P1可以通过苯环上的羟基化形成OH-加合物(P5)。同样,通过途径 I 形成的P3也可能发生羟基化,从而产生P6[18]。
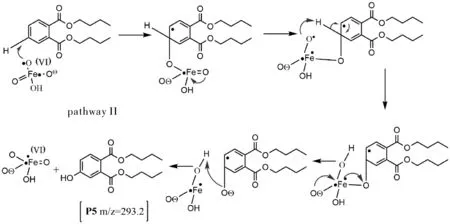
图8 途径 II降解机制
3 结 论
(1)K2FeO4氧化页岩气返排液过程中COD去除符合两阶段反应动力学,即:
通过分别拟合过程中K2FeO4浓度、初始pH、温度单因素,得出最佳反应条件为K2FeO4浓度1500 mg/L,初始pH=9.0,温度为25 ℃;
(2)K2FeO4氧化不能将页岩气产出水完全矿化成二氧化碳和水,只是将水样中复杂的有机物分子转化为结构简单的直链烷烃或者羧酸类物质,需与其他氧化方式相结合才可将有机物完全去除;
(3)DBP在K2FeO4氧化中检测到6种氧化中间体,产物分析表明DBP的转化主要通过水解和羟基化反应两种途径,其中可能是由K2FeO4的氧原子转移过程介导的。DBP的两个酯基容易被K2FeO4攻击,并且羟基加成倾向于发生在苯环上一个酯基的对位。
