肝脏病变患者血清HLA-G5和外周血T淋巴细胞亚群分布的变化及意义
2022-12-01易祯禛宫黎明贺敏文德学王兴林任真奎
易祯禛 宫黎明 贺敏 文德学 王兴林 任真奎△
(1.黔西南布依族苗族自治州人民医院检验科,贵州 兴义 562400;2.遵义医科大学附属医院生殖中心,贵州 遵义 563099)
慢性乙型肝炎病毒(chronic hepatitis B virus ,HBV)的感染在我国处于高发状态,而肝细胞癌(Hepatocellular carcinoma,HCC)的发生主要与HBV感染密切相关[1,2]。由于每年的HBV感染率逐渐增加,导致HCC的发病率也呈逐年上升的趋势,肝硬化也是乙肝患者转为肝癌的一个中间阶段。HCC是临床常见的恶性肿瘤之一,部分肝癌患者在发病后就已经为晚期,失去最佳手术治疗的机会,其死亡率一直居于消化系统恶性肿瘤的前三位。因此,能够尽早评估发现肝癌对提高患者的预后和治疗效果具有重要的临床意义。当前的临床方法使用血清学指标,例如乙型肝炎病毒脱氧核糖核酸(hepatitis B virus deoxyribonucleic acid ,HBV-DNA),核心启动子突变和肝硬化”(core promoter mutations and cirrhosis,GAG-HCC), “乙型肝炎e-抗原血清清除后肝细胞癌”( hepatocellular carcinoma after hepatitis B e-antigen seroclearance,HCC-ESC)等评分,来用于预测HCC的发展[3-5],但这些对于5年期的HCC发展评估不理想。目前,缺乏对预测肝癌发展的高度准确,且真正有效地,可识别和操作的方法。近年来,在各种肿瘤研究报告中HLA-G(human leukocyte antigen-G ,HLA-G)分子存在显著差异,其在HCC中也有报道。研究已指出,HLA-G是机体内重要的参与免疫耐受的分子,包含三种可溶性的HLA-G5(sHLA-G5)、HLA-G6、HLA-G7分子及四种模型HLA-G1-G4[6-7]。 HLA-G的全基因片段含6个外显子,外显子1~4以及内含子4表达HLA-G5,翻译过程终止于此区域终止密码子处,导致外显子5和6不翻译,跨膜区和胞质区缺失[8]。在HLA-G分子的3个可溶型亚型中,表达丰度与功能研究最多的是HLA-G5。HLA-G5在免疫中表现出的作用在移植免疫、肿瘤免疫和生殖免疫领域备受关注,具有广泛的基础研究和临床应用前景[9-10]。以往研究皆显示出肿瘤的整个病程与肿瘤宿主的免疫状况密切相关,而T淋巴细胞介导的细胞免疫在机体抗肿瘤免疫中起着主导作用[11]。T细胞亚群是机体进行免疫监视、抗肿瘤及抗感染中的重要组成部分,可以分为CD3+、CD4+和CD8+三类细胞,其中CD3+细胞是全T细胞标志,CD4+细胞具有辅助前细胞的功能,CD8+细胞则具有抑制诱导及细胞毒性功能[12]。T淋巴细胞亚群分布指示的机体免疫功能状态是研究治疗肝病的重要因素,然而目前仅有的这些指标对疾病的预判远远不够,寻求更新且有效的指标是目前研究的重要方向。因此,本研究尝试结合HLA-G5与T淋巴细胞亚群来联合判断患者的细胞免疫功能状态,对确定相应的治疗方案、观察疗效及评估预后提供参考。报告如下。
1 材料与方法
1.1材料 (1)材料与试剂:患者标本由黔西南州人民医院经患者知情同意后采集获得;ELISA检测试剂盒由江苏科特生物科技有限公司获得;丙氨酸氨基转移酶(ALT)检测试剂盒、甲胎蛋白(AFP)检测试剂盒和天门冬氨酸氨基转移酶(AST)检测试剂盒购自罗氏诊断产品(上海)有限公司;抗CD3+、CD4+和CD8+的单克隆抗体购自深圳迈瑞生物医疗电子股份有限公司;酶标仪(Addcare ELISA 600),流式细胞仪(BriCyte E6),高速离心机(14D)、超低温冰箱(DW-25L262)。
1.2方法
1.2.1患者标本的分组及采集 整个实验分为3个组,分别为乙肝组、肝硬化组和肝癌组,随机抽取2018年8月至2020年2月本院收治的肝病患者作为本次实验的研究对象,每组约40份标本,经知情同意后,每位患者采集全血2~3 mL,高速离心分离血清,冰冻保存,待标本全部收集完成进行检测。同上,用抗凝管采集患者1~2 mL全血用于流式检测。
1.2.2全自动生化分析仪检测血清中ALT、AST含量 将检测试剂装载上机后,血清标本ALT和AST的检测在本院检验科生物化学组进行,保存结果。
1.2.3全自动化学发光仪检测血清中AFP含量 将检测试剂装载上机后,血清标本放在化学发光仪自动进行AFP含量检测,保存结果。
1.2.4ELISA法检测血清中的HLA-G5变化情况 按试剂盒步骤将标准品和稀释液按一定比例进行稀释,并将以上患者血清标本分组排好序,将标准品与待测样本加入孔板中,在450 nm波长处测各孔吸光度(OD值),根据标准物浓度与OD值导出标准曲线和函数方程,将样品OD值输入该方程,计算出相应样品中的HLA-G5浓度,再乘以稀释倍数,本实验中稀释倍数为5倍。每个样品设置3个复孔,空白孔为无检测试剂与样品,样品孔和标准孔OD值均以空白孔调零。
1.2.5流式细胞术检测T细胞亚群分布情况 将采集的抗凝全血混匀,取100 μL于试管中,分别加入CD4+CD4+和CD8+单克隆荧光抗体10 μL,混匀后室温避光静置15 min。接着用溶血素溶解红细胞,同样混匀后避光放置15 min,待溶解结束后1 000 rpm离心5 min收集细胞沉淀。细胞用PBS缓冲液反复洗3次,尽可能洗掉前面所用试剂。最后同样条件离心收集细胞用稀释液重悬细胞,上机检测。

2 结 果
2.1各组肝病患者血清中的AFP、AST和ALT的含量 检测结果显示,与乙肝组相比,肝癌组的AFP、AST和ALT含量明显升高(P<0.05),肝硬化组含量有升高趋势,差异无统计学意义(P>0.05)。见表1。

表1 不同肝病患者AFP、AST和ALT的含量
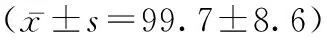
2.3各组肝病患者外周血中的T淋巴细胞亚群分布情况 流式结果显示,与乙肝组相比,肝硬化与肝癌组CD3+百分比均减少,而CD4+ /CD8+比值均增加,肝癌组的CD4+百分比上升),肝硬化组CD4+百分比呈上升趋势,但是未具统计学意义,肝硬化组的CD8+百分比减少,差异均有统计学意义(P<0.05),而肝癌组的CD8+百分比也有下降趋势,差异无统计学意义(P>0.05)。见表2。

表2 不同肝病患者T淋巴细胞亚群分布
3 讨 论
我国乙肝一直处于高发状态,同时肝病患者比例也相应增多。由乙肝到肝癌的过程复杂且长久,在临床治疗中面临着诸多困难,例如对肝癌患者的早发现早治疗就是一大问题。临床上对疾病的诊断依据目前还是血清学常规检查等,并结合相应的临床指标作出治疗对策,这些指标虽能对疾病状态进行评估,但是不能更好地反映患者的具体病理状态,进而不能很好地指导临床进行救治。而在肝病患者治疗过程中发现,了解其免疫功能的具体情况对疾病进程的认知以及诊治有很大的帮助。因此,寻求真正有效地和可识别的指标是研究的方向。有研究发现HLA-G在许多免疫相关疾病中可被诱导,起到免疫耐受作用[13,14]。在研究的大多数组织学类型的癌症中均观察到不同程度的HLA-G表达,并且强调了HLA-G相关的信号通路在癌症生物学中作为免疫检查点的重要性[15]。HLA-G 关联的信号通路可抑制NK细胞,T和B淋巴细胞的增殖以及树突状细胞的成熟和抗原呈递,抑制细胞的细胞毒和杀伤作用,B细胞的免疫球蛋白产生等[16-18]。
在本次研究中,我们拟通过结合检测患者血清HLA-G5和全血T细胞亚群分布,来研究不同肝病患者细胞免疫功能的改变情况及其之间的相互联系,进一步评估患者免疫功能的紊乱程度,为临床研究肝病患者的免疫疗法补充材料。本次研究结果显示,首先指示肝脏的AFP、AST和ALT指标的升高说明此次研究的患者的病程判断正确,AST和ALT指标升高表明就诊患者肝脏功能受损加重。接着在我们本次研究中各组肝病患者血清中的HLA-G5呈现的升高变化,与之前的报告一致[19-21]。流式结果显示,肝病患者的T淋巴细胞亚群明显超出正常范围值。肝硬化与肝癌组CD3+百分比均减少,而CD4+ /CD8+比值均增加,肝癌组的CD4+百分比增加,肝硬化组的CD8+百分比下降,说明患者免疫功能处于对病毒的清除阶段,机体还未发展严重的到免疫细胞毒性阶段。肝硬化与肝癌组的HLA-G5明显升高,且肝癌组明显比肝硬化HLA-G5表达高,根据之前的研究,HLA-G在免疫T细胞中显示出不同的调控作用[22],说明在肝病患者的体内HLA-G5的表达与免疫状态存在重要的调控关系。大量研究表明,癌症中HLA-G的异常表达与疾病进展和较差的临床预后有关[23]。HLA-G与T淋巴细胞亚群的联合结果更能进一步地观察到肝病患者体内机体的免疫状态,更能细致区分机体免疫的动态过程,为评估患者治疗提供新的支撑,当然这也需要更多的进一步的临床试验来将二者之间的关系进行归纳。
