miR-367-3p靶向ZEB2抑制NSCLC细胞增殖、迁移和侵袭生物学功能研究
2022-11-30苏延军张华
苏延军 张华
肺癌是临床上最为常见的恶性肿瘤,而非小细胞肺癌(non-small cell lung cancer, NSCLC)占整体肺癌发病率的80%左右[1]。流行病学研究[2,3]显示,肺癌在男性发病率为第一位,女性为第二位。在所有肿瘤导致的死亡原因中,无论男性和女性,肺癌均为第一位的肿瘤相关死亡原因[2]。然而,NSCLC的确切发病原因、侵袭转移等生物学行为及其分子机制并未完全阐明。然而,越来越多的研究[4-6]显示微小RNA(microRNA)在肿瘤的发生发展、侵袭转移和表观遗传领域发挥重要的作用。
miR-367-3p的前体为hsa-miR-367,定位于人4号染色体chr4:112647874-112647941[7]。近年来研究[8,9]显示miR-367-3p在人多种肿瘤中存在差异表达,并参与肿瘤细胞的恶性表型。然而,miR-367-3p在NSCLC中的研究报道较少,其生物学功能及相关分子机制不明。
1 资料与方法
1.1肺癌患者及健康查体者选取22例NSCLC患者的组织样本和配对正常肺组织为研究对象。同时选取22例健康查体者,留取外周静脉血。NSCLC患者纳入标准:NSCLC明确病理学诊断且接受手术治疗者。相关影像学检查除外远处转移者。排除标准:小细胞肺癌患者;接受新辅助放化疗或免疫治疗者。切除的肺癌组织均经过天津医科大学肿瘤医院病理科验证为NSCLC。所有肺癌组织存放在液氮中冷冻,并储存于-80oC冰箱,直到RNA提取。22例NSCLC患者年龄46岁-74岁,平均年龄(59.3±16.2)岁,男性14例,女性8例;腺癌13例,鳞癌9例。
1.2Real-time PCR试验采用RNA提取试剂盒,提取上述组织和血液学标本中的总RNA,采用M-MLV逆转录试剂盒合成cDNA。采用Real-time PCR法检测miR-367-3p和锌指e-box-binding同源盒2(Zinc finger E-box binding homeobox 2, ZEB2)相对表达水平,引物序列见表1。反应体系和条件如下,按20 μL体系进行基因表达水平检测:SYBR premix 10 μL,GAPDH上游引物或miR-367-3p上游引物1 μL;GAPDH下游引物或miR-367-3p下游引物1 μL;cDNA 1 μL,灭菌去离子水8 μL。扩增条件为:95oC、5 min;95oC、30 s,58oC、30 s,72oC、30 s,循环40次;72oC、10 min。以 2-ΔΔCt(Ct为循环阈值)法来表示Real-time PCR结果的相对表达量。
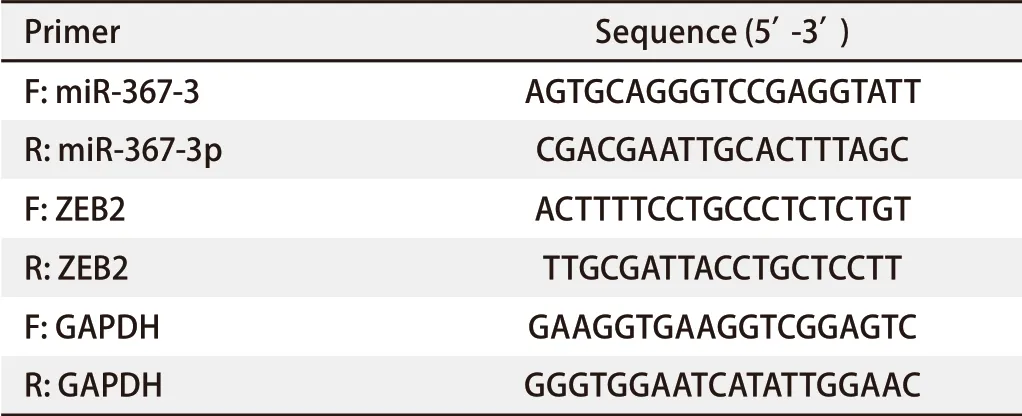
表 1 miR-367-3p表达水平检测Real-time PCR引物Tab 1 Primer of miR-367-3p detected by Real-time PCR
1.3转染外源性miR-367-3p培养A549细胞,应用RMPI-1640+10%FBS完全培养基,置于37oC培养。细胞传代两次至生长状态良好后,消化细胞形成细胞悬液,包含细胞数为5×105个,轻轻摇动6孔板,细胞混合均匀后,继续培养。待生长3 d后,开始进行转染。miR-367-3p模拟物及无义对照序列(miR-NC)均委托苏州吉玛基因股份有限公司合成。采用Lipofectamine 3000转染试剂进行转染,转染方法按试剂盒说明进行。转染设置4组:空白对照组(细胞未经处理)、Mock组(细胞中仅加入转染试剂Lipofectamine 3000模拟转染过程)、NC组(细胞转染miR-NC无义序列,作为miR-367-3p阴性对照)、实验组(细胞转染miR-367-3p模拟物)。
1.4MTT试验消化培养瓶中的A549细胞,吹散并进行细胞计数,调整细胞浓度为1×104个/mL,向96孔板中每孔加入200 μL细胞悬液,即2,000个细胞/孔。待细胞密度至70%,进行细胞转染。转染设置4组,每组设置6个副孔,分别为空白对照组、Mock、NC和实验组。细胞转染6 h后,更换新的完全培养基,继续培养。培养分别于转染0 h、24 h、48 h、72 h、96 h后,弃去各孔培养基,PBS清洗3次,加入200 μL新鲜完全培养基,并加入5 mg/mL MTT溶液20 μL,继续将培养板置于37oC、5%CO2培养箱中培养4 h,4 h后弃去上清,每孔加入150 μL DMSO,结晶物溶解后,测量OD490 nm吸光值,上机时设置调零孔。以时间梯度为横坐标(X轴),吸光值为纵坐标(Y轴)绘制曲线图。
1.5Transwell试验消化培养瓶中的A549细胞,吹散并进行细胞计数,细胞浓度为5×105个/mL,向24孔Transwell板中上室每孔加入100 μL细胞悬液,即5×104个细胞/孔,下室加入600 μL完全培养基。待细胞密度至70%,进行细胞转染。细胞转染6 h后,更换新的完全培养基,置于37oC、5%CO2培养箱中继续培养。培养48 h后,弃去上室培养基,刮去上室膜上贴壁细胞,PBS清洗3次,甲醇固定30 min,将小室晾干后,用0.1%结晶紫染色20 min,PBS清洗3次,显微镜下随机观察9个视野细胞,并计数。
1.6Western blot试验 提取细胞中的总蛋白,分别进行制胶、垂直电泳、转膜、封闭等操作。然后进行一抗孵育:配制一抗溶液各4 mL并加入孵育盒中,4oC过夜。二抗孵育:回收一抗溶液,配制辣根酶标记的山羊抗兔和山羊抗小鼠的二抗溶液,注入孵育盒中,于常温慢摇1 h。孵育结束后漂洗NC膜3次,曝光及蛋白条带分析。
1.7生物信息分析microRNA靶基因预测数据库Targetscan(http://www.targetscan.org/vert_72/)和StarBase(http://starbase.sysu.edu.cn/starbase2/)对miR-367-3p下游靶基因进行预测。癌症基因组图谱(The Cancer Genome Atlas, TCGA)数据库中(https://www.cancer.gov/),根据ZEB2中位表达水平,将NSCLC患者分为ZEB2高表达组(肿瘤组织中ZEB2表达≥中位表达水平)和低表达组,采用Log-rank检验比较高低标的组NSCLC患者无疾病进展生存(disease free survival, DFS)和总生存(overall survival, OS)有无差异。TIMER数据库(https://cistrome.shinyapps.io/timer/)分析ZEB2基于表达与NSCLC免疫细胞浸润情况。
2 结果
2.1miR-367-3p在NSCLC患者及健康者中的表达水平比较应用RT-PCR方法检测22例患者癌组织和正常组织中的miR-367-3p表达水平,结果表明癌组织中miR-367-3p表达水平是明显低于正常组织(图1A),差异具有统计学意义(P<0.05),说明肺组织中miR-367-3p的低表达可能与肺癌发生具有一定的相关性。22例肺癌患者血清和22例健康人血清中的miR-367-3p表达水平表明肺癌患者血清中miR-367-3p表达水平明显低于健康人(图1B),差异具有统计学意义(P<0.05),说明外周血清中miR-367-3p的低表达与肺癌发生具有一定的相关性。
2.2miR-367-3p诊断NSCLC的临床价值分别以组织和血清中miR-367-3p的相对表达水平为参考,诊断NSCLC受试者工作特征(receiver operating characteristic,ROC)曲线下面积分别为0.95(95%CI: 0.89-1.00)和0.85(95%CI: 0.74-0.97),见图2。
2.3miR-367-3p在细胞系中的表达水平分析miR-367-3p在A549细胞系中的表达水平显著低于正常支气管上皮细胞BEAS-2B(P<0.05)(图3A);转染外源性miR-367-3p后,实验组miR-367-3p mRNA表达水平明显高于空白对照组、Mock组和NC组(图3B)(P<0.05)。
2.4上调miR-367-3p表达后肺癌细胞增殖能力减低MTT结果表明,实验组细胞增殖能力明显低于空白对照组、Mock组和NC组(图4),差异具有统计学意义(P<0.05)。说明miR-367-3p模拟物可明显抑制A549肺癌细胞的增殖能力,其抑制能力与时间梯度呈正相关。
2.5上调miR-367-3p后肺癌细胞侵袭能力减低Transwell结果表明,实验组A549细胞迁移数量明显低于空白对照组、Mock组和NC组(图5),差异具有统计学意义(P<0.05),说明转染miR-367-3p模拟物可明显抑制A549细胞的迁移能力。
2.6miR-367-3p靶基因预测及表达水平分析microRNA靶基因预测数据库Targetscan和StarBase对miR-367-3p下游靶基因进行预测,结果显示ZEB2基因于miR-367-3p的3’UTR特异性结合,提示ZEB2可能为miR-367-3p的靶基因。实验组ZEB2蛋白表达水平明显高于空白对照组、Mock组和NC组(图6),差异具有统计学意义(P<0.05),说明miR-367-3p模拟物可调节ZEB2蛋白的表达水平。

图 1 miR-367-3p在组织和血清中表达水平比较。A:miR-367-3p在NSCLC患者癌组织和癌旁组织中的表达比较;B:miR-367-3p在NSCLC患者和健康查体者血清中的比较。Fig 1 Comparison of miR-367-3p expression in tissues and serum. A: comparison of miR-367-3p expression in cancer tissues and adjacent tissues of NSCLC patients; B: comparison of miR-367-3p expression in serum of NSCLC patients and healthy subjects. NSCLC:non-small cell lung cancer.

图 2 miR-367-3p诊断NSCLC的ROC曲线。A: 组织; B:血清。Fig 2 ROC curve of miR-367-3p in diagnosis of NSCLC. A: tissue; B: serum. ROC: receiver operating characteristic.
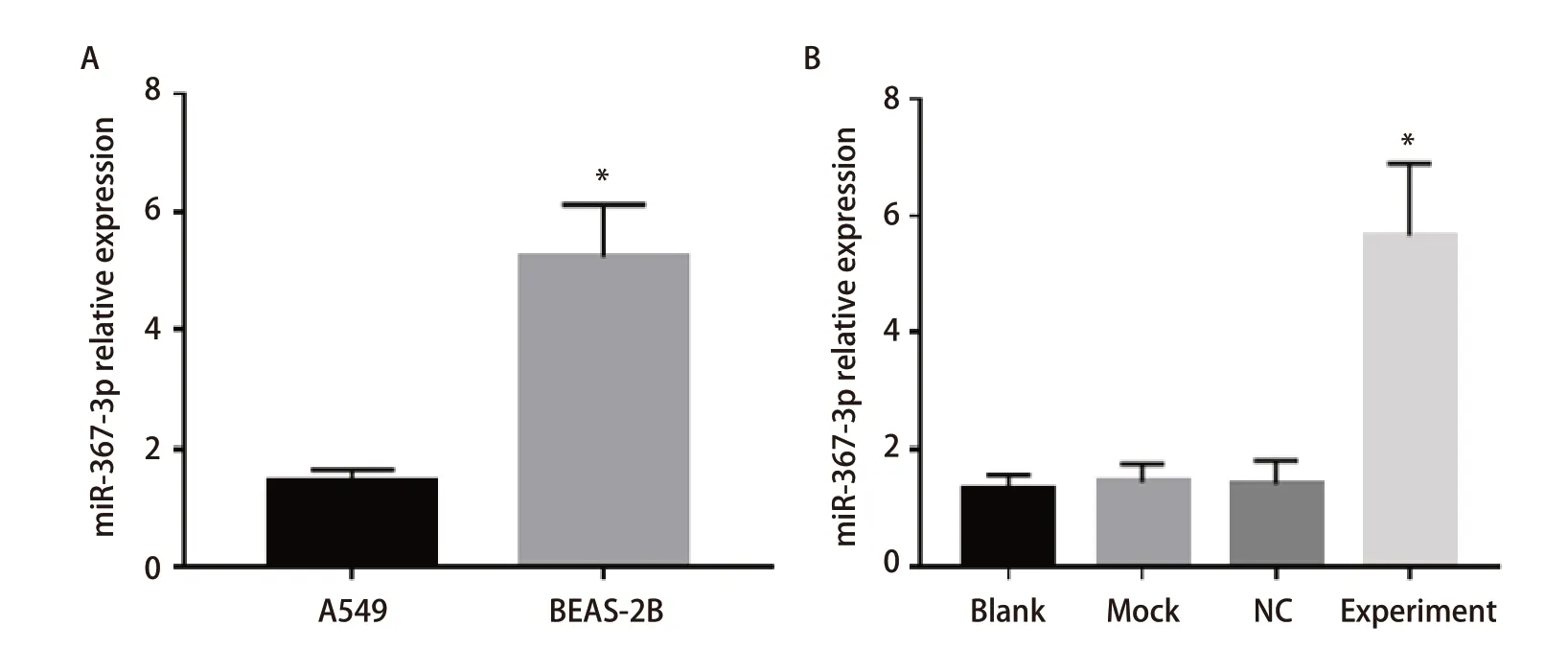
图 3 miR-367-3p在细胞系中的表达水平。A: miR-367-3p在肺癌细胞系A549和正常支气管上皮细胞BEAS-2B中的表达;B: miR-367-3p在经不同处理的A549细胞中的表达。Fig 3 Expression level of miR-367-3p in cell lines. A: Expression of miR-367-3p in lung cancer cell line A549 and normal bronchial epithelial cell line BEAS-2B; B: Expression of miR-367-3p in A549 cells after different treatments. *P<0.05.
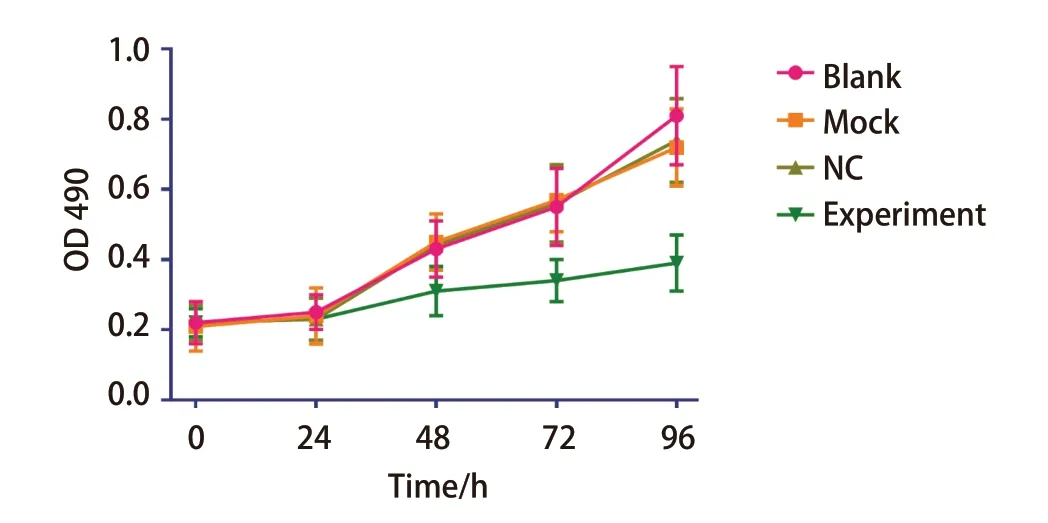
图 4 过表达miR-367-3p后肺癌细胞增殖能力变化Fig 4 Changes in proliferation of lung cancer cells after overexpression of miR-367-3p
2.7miR-367-3p靶基因ZEB2表达与NSCLC患者预后TCGA数据库中(https://www.cancer.gov/),根据ZEB2中位表达水平,将NSCLC患者分为ZEB2高表达组(肿瘤组织中ZEB2表达≥中位表达水平)和低表达组,采用Logrank检验比较高低标的组NSCLC患者DFS和OS有无差异。结果显示,ZEB2高表达组NSCLC患者OS和DFS与低表达组NSCLC差异无统计学意义(P>0.05),但高表达组显示出了OS及DFS降低的趋势,图7。

图 5 过表达miR-367-3p后肺癌细胞侵袭能力。A:空白组;B:Mock组;C:NC组;D:试验组;E:侵袭能力柱状图。Fig 5 Invasion ability of lung cancer cells after overexpression of miR-367-3p. A: blank group; B: Mock group; C: NC group; D:experimental group; E: invasiveness histogram.

图 6 miR-367-3p靶基因ZEB2表达水平分析。A:ZEB2在不同处理A549细胞中的mRNA表达情况;B:ZEB2在不同处理A549细胞中的蛋白表达情况。Fig 6 Expression of miR-367-3p target gene ZEB2. A: mRNA expression of ZEB2 in A549 cells in different groups; B: Protein expression of ZEB2 in A549 cells in different groups. *P<0.05.
2.8ZEB2表达与免疫细胞浸润 TIMER数据库中分析ZEB2基于表达与NSCLC免疫细胞浸润情况,ZEB2表达与B淋巴细胞(r=0.32,P<0.05)、CD8+T细胞(r=0.44,P<0.05)CD4+T细胞(r=0.46,P<0.05)、巨噬细胞(r=0.65,P<0.05)、中性粒细胞(r=0.73,P<0.05)和树突状细胞(r=0.71,P<0.05)浸润均存在正向关系。
3 讨论
本研究采用生物信息分析联合细胞分子实验探讨微小RNA在肺癌的发生发展及生物学表型中发挥重要作用。分析miR-367-3p在NSCLC患者中的表达及其对NSCLC细胞增殖、迁移和侵袭的影响。研究中我们通过检测NSCLC患者及健康查体者癌组织、癌旁肺组织、血清中miR-367-3p的表达水平发现,NSCLC患者癌组织miR-367-3p水平显著低于癌旁组织,而NSCLC患者血清中miR-367-3p水平显著低于健康查体者。进一步细胞系中也发现,miR-367-3p在肺癌细胞系A549中的表达水平显著低于正常支气管上皮细胞。上述结果在人体组织、血液及细胞系中均证实miR-367-3p在NSCLC中表达下调。同时已发表的文献也证实,在大多数肿瘤中,miR-367-3p表达下降,这些肿瘤包括胃癌、宫颈癌和睾丸生殖细胞肿瘤等[10-12]。
进一步的生物学功能研究显示,上调肺癌细胞株A549中miR-367-3p的表达后,细胞的增殖和迁移能力均明显降低。提示miR-367-3p可能通过参与细胞增殖和侵袭相关信号通路,影响A549细胞的增殖和迁移能力改变。国内杜宁等[13]探讨miR-367-3p在NSCLC组织中的表达及对细胞功能的影响,通过检测NSCLC组织中miR-367-3p的水平,也证实其在癌组织中的表达水平明显高于癌旁组织,与本研究结果一致。同时研究还发现,miR-367-3p可能通过靶向下游FBXW7的表达,而影响细胞增殖和细胞周期[14]。在本研究中,我们通过生物信息分析,预测了miR-367-3p与ZEB2基因mRNA能特异性结合,提示ZEB2为其下游靶基因。进一步的分析显示,上调miR-367-3p表达后,A549细胞的增殖和迁移能力明显降低,而上调miR-367-3p后ZEB2基因mRNA和蛋白表达水平均明显降低,进一步提示miR-367-3p可能通过靶向ZEB2基因表达而发挥生物学功能。
同时,我们选取TCGA数据库中NSCLC患者的预后资料作为研究对象,分析ZEB2基因表达水平与NSCLC患者预后的关系,结果虽然显示ZEB2高表达组NSCLC患者OS和DFS与低表达组差异无统计学意义(P>0.05),但高表达组显示出了OS及DFS降低的趋势。因此,我们研究结果显示,miR-367-3p在NSCLC患者中表达下调,并通过靶向ZEB2基因参与NSCLC的增殖和侵袭生物学过程,提示miR-367-3p可能成为NSCLC患者靶向治疗和靶向药物研发的新靶点[15]。
Author contributions
Su YJ conceived and designed the study. Zhang H performed the experiments. Su YJ and Zhang H analyzed the data. Su YJ and Zhang H provided critical inputs on design,analysis, and interpretation of the study. All the authors had access to the data. All authors read and approved the final manuscript as submitted.
