术前HALP评分对老年非小细胞肺癌手术病人预后的预测价值
2022-11-30袁梦依王培山孟瑞霞杨建军周成茂焦钟雨
袁梦依 王培山 孟瑞霞 杨建军 周成茂 焦钟雨
肺癌是世界范围内高发病率及高致死率的肿瘤之一,病理类型主要分为小细胞肺癌(small cell lung cancer,SCLC)和非小细胞肺癌(non-small cell lung cancer, NSCLC),其中以NSCLC为主,占比约为85%。由于肺癌诊断时多为中晚期,其5年生存率较低,约为10%~15%[1]。目前,外科手术切除治疗仍是主要的治疗方式。影响肺癌手术病人预后的因素包括年龄、基础疾病史、TNM分期等,此外,营养免疫、炎症等亦有一定影响。术前营养免疫状态不仅可以影响病人对手术的耐受程度及术后短期机体恢复,对长期生存预后亦有一定影响[2]。临床常见反映营养状态的指标为血红蛋白、白蛋白等。研究证明,炎症反应与肿瘤的发生与发展密切相关,但病人术前营养免疫状态与炎症反应二者联合对预后的综合影响,相关研究尚不多见。本文主要研究术前血红蛋白(H)、白蛋白(A)、淋巴细胞(L)、血小板(P)组合免疫炎症评分(HALP评分)及术后3 d HALP评分与术前差值(ΔHALP)对老年NSCLC全麻手术病人生存情况的预测价值。
1 对象与方法
1.1 研究对象 收集新乡市中心医院2015~2019年收治的年龄≥60岁的NSCLC手术病人270例。其中男166例,女104例。年龄60~94岁,平均(68±6)岁。截止到随访终止时间2021年7月30日,中位随访时间为32个月,共有72例(26.7%)病人死亡。纳入标准:行手术治疗且于术前或术中病理诊断确诊为NSCLC;未行术前新辅助放化疗;年龄≥60岁;一般资料及临床资料完善并可随访。排除标准:合并肝肾功能障碍、骨髓造血系统异常或血液系统疾病;围术期死亡;存在术前感染或长期慢性炎症;长期糖皮质激素用药史;长期慢性肝炎病毒感染。
1.2 方法
1.2.1 资料收集:通过临床病例系统及手术室手术麻醉系统提取病人相关资料,包括住院号、性别、年龄、体质量、吸烟史、术中出血量、术中尿量、手术时长、麻醉时长、麻醉药物、肿瘤部位、肿瘤分期、肿瘤分化程度、术前及术后血液学检测指标、术后住院时间等信息。根据HALP=H×A×L/P计算HALP评分及ΔHALP评分。
1.2.2 术后随访:随访从病人出院开始至随访终止日期(2021年7月30日)或病人死亡日期。主要随访方式包括门诊及电话随访等,随访内容包括影像学检查(CT、MRI等)、血液学检查(血常规、肿瘤标志物等)及临床症状等。
1.3 观察指标 主要观察指标为总生存期(overall survival,OS)、无疾病进展生存期(progression-free survival,PFS)等,次要观察指标为术中出血量、术后住院时间、术后并发症等。OS指病人从确诊疾病日期起,至病人死亡或随访终止的时间。PFS指病人手术治疗日期至肿瘤复发或转移的时间。
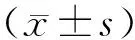
2 结果
2.1 HALP评分的最佳截断值 利用X-tile 3.6.1软件,当检验结果P值达到最小值且P<0.05时确定HALP评分截断值为39.0(P=0.013)。以该值为临界点,将病人分为高HALP组和低HALP组,以同样方法确定ΔHALP评分及血红蛋白、白蛋白、淋巴细胞、血小板的最佳截断值分别为9.0分(P=0.011)、116 g/L(P<0.001)、38.3 g/L(P=0.046)、1.8×109/L(P=0.0237)、139×109/L(P=0.044)。将体质量、手术时长、麻醉时长等资料以中位数为截断值划分为高低2组,进行组间生存资料比较分析。
2.2 影响病人OS和PFS的单因素分析 将所有收集的观察指标纳入单因素分析,绘制Kaplan-Meier生存曲线,计算中位OS和中位PFS。结果显示,HALP评分、ΔHALP评分、肿瘤分化程度、肿瘤TNM分期、白蛋白水平、吸烟史、肿瘤部位、手术时长、麻醉时长、术中出血量均与病人术后OS和PFS显著相关(均P<0.05),此外,血红蛋白、白蛋白水平也与PFS显著相关(均P<0.05)。见表1。
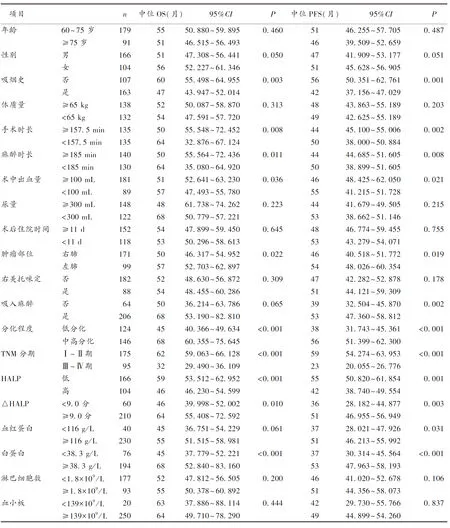
表1 影响病人PFS和OS的单因素分析结果
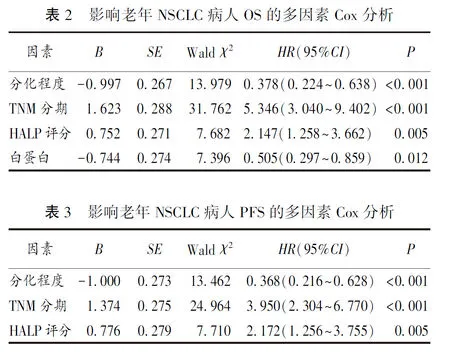
2.3 影响OS和PFS多因素分析 将单因素分析中有统计学意义的指标纳入多因素Cox回归分析,结果显示,HALP评分、肿瘤TNM分期及肿瘤分化程度、术前白蛋白水平为病人术后OS 的独立影响因素。术前HALP评分、肿瘤TNM分期及肿瘤分化程度是PFS的独立影响因素(均P<0.05)。见表2、3。
3 讨论
研究证实,炎症反应与肺癌的发生、发展息息相关,营养免疫状态与肺癌病人的短期及长期生存亦关系密切[2-3]。炎症免疫细胞是肿瘤微环境的重要组成成分,肺癌组织中浸润的炎性细胞多为慢性炎症细胞,包括淋巴细胞、巨噬细胞、血小板等。淋巴细胞主要在抗肿瘤免疫过程中发挥作用,可以通过再循环作用增强免疫细胞与抗原、抗原提呈细胞接触,肿瘤浸润性T淋巴细胞可诱导细胞毒性死亡。炎症免疫细胞与肺癌细胞的相互作用,是通过激活固有免疫和适应性免疫,根据消除、平衡、逃逸3个肿瘤发展阶段发挥作用[4]。临床观察性研究结果表明,免疫炎症细胞在癌症进展中发挥双重作用,既可以通过消除癌细胞抑制肿瘤生长,也可以通过协助逃避免疫监测促进肿瘤生长[5]。研究认为,血小板亦是肿瘤病人预后不良的显著影响因子,可能的机制为血小板含量的增加可刺激生成血管内皮生长因子(VEGF、PDGF)、转化生长因子-β等生物活性因子,促进肿瘤细胞的增殖和血管生成,同时成团的血小板细胞可以包裹肿瘤细胞以躲避免疫系统的攻击,避开机体免疫监测作用发挥促肿瘤作用[6-7]。另有研究发现,血小板可以通过TNF介导发挥抑制肿瘤细胞坏死的作用[8]。在本研究中,以1.8×109/L、139×109/L分别为术前淋巴细胞数、术前血小板计数的截断值,将病人分为高/低淋巴细胞组及高/低血小板组,建立生存曲线进行分析,结果发现2组病人术后生存情况并无明显差异,说明在肺癌发展过程中,淋巴细胞及血小板对肿瘤的影响并非独立发挥促进或者抑制作用,更多的为协同发挥作用。
肺癌为慢性消耗性疾病,可降低病人的营养状况并激活炎症持续状态。血红蛋白和血清白蛋白是临床反映营养状况的常见参数。血红蛋白的增加可调节机体氧环境,抑制肿瘤生长的缺氧环境,影响肿瘤生长,从而改善肿瘤病人的预后[9]。另有研究表明,贫血是肿瘤病人预后的独立影响因子[10]。有报道认为,肿瘤病人患贫血的概率为30%~77%[11]。但血红蛋白水平与生存预后之间的关联性研究目前较少,结论仍存在一定争议。白蛋白是血浆中含量最丰富的蛋白质,反映机体营养状态及免疫状态。研究认为,由于恶性肿瘤的慢性消耗性,导致机体营养不良,使白蛋白的合成受抑制,同时,低白蛋白血症亦可加剧肿瘤的不良预后[12]。白蛋白与肿瘤发展间的相关性及具体机制目前尚不明确,可能与伴随的肝功能及免疫功能下降导致肿瘤细胞复发与转移相关[13],也有可能与白蛋白水平降低时,易引起术后肺部感染及并发症有关。在本研究中,以116 g/L、38.3 g/L为血红蛋白、白蛋白的截断值,结果发现高血红蛋白组、高白蛋白组病人肿瘤复发及转移间歇期要明显长于低血红蛋白、低白蛋白组病人,说明肺癌手术治疗病人术前的营养及免疫状态是病人生存预后的良性影响因子,且良好的营养免疫状态可在一定范围内改善病人预后。
HALP评分是一项有关机体营养免疫与炎症状态的综合评分,目前已有研究表明其与多种肿瘤的生存预后显著相关,包括食管鳞状细胞癌[14]、结直肠癌[15]、胃癌[16]、膀胱癌[17]、肾细胞癌[18]等,但是与肺癌预后关系的研究多为观察其与化疗效果之间的关联,涉及老年手术治疗病人的研究相对较少。本研究中,HALP评分≥39.0分是老年肺癌手术治疗病人预后的独立影响因素,与其他研究结论类似,均认为高HALP评分病人有着更佳的生存预后[18]。此外,本文研究了术前与术后3 d HALP评分的变化对病人生存的影响,结果发现ΔHALP评分对病人术后OS、PFS影响价值有限,但在一定范围内,高ΔHALP评分组的预后要优于低ΔHALP评分组病人。多因素Cox回归分析结果显示,术前HALP评分、肿瘤TNM分期、分化程度等因素均为影响手术病人术后生存的独立影响因素,因此,术前HALP评分可作为老年NSCLC全麻手术病人预后的预测指标。
由于本文为回顾性研究,在病例选择上具有一定的选择偏倚,随访时间较短,且为单中心研究,病例数较少,使本研究具有一定的局限性。后期可增加多中心、前瞻性研究去验证研究结论。亦可从细胞分子水平进一步深入探讨其具体机制。
