11C-MET PET/CT筛查幕上较低级别胶质瘤IDH和1p/19q分子分型的应用价值
2022-11-29杨子皓李晓桐袁磊磊
张 姝 王 凯 杨子皓 乔 真 李晓桐 袁磊磊 艾 林
(首都医科大学附属北京天坛医院核医学科,北京 100054)
胶质瘤是颅内最常见的原发肿瘤。世界卫生组织(World Health Organization,WHO)根据肿瘤的组织病理学特征将胶质瘤分为Ⅰ~Ⅳ级。通常来说WHO Ⅱ级胶质瘤较WHO Ⅲ级胶质瘤预后好。2015年癌症基因图谱数据库对较低级别胶质瘤(lower-grade glioma, LrGG),包括WHO Ⅱ~Ⅲ级胶质瘤,进行全基因组分子数据分析,结果显示,与组织学相比,基因表型更能准确地反映肿瘤的生物学行为及预后,并且根据异柠檬酸脱氢酶(isocitric dehydrogenase, IDH)基因突变及1p/19q共缺失状态将较低级别胶质瘤分为3类:IDH野生型(IDHwild-type,IDHwt);IDH突变-1p/19q非共缺失型(IDHmutant 1p/19 intact type,IDHmut1p/19qint)以及IDH突变-1p/19q共缺失型(IDHmutant 1p/19q co-deleted type,IDHmut1p/19qdel)。其中IDH野生型胶质瘤预后较差,与IDH野生型胶质母细胞瘤具有相似的基因表型和生物学行为,具有较高的疾病进展风险,其次为IDH突变1p/19q非共缺失型,IDH突变1p/19q共缺失型肿瘤因其对化学药物治疗(以下简称化疗)较为敏感而预后较好[1]。
分子分型的诊断主要依赖于活检或手术切除标本,准确性受肿瘤异质性的影响,而且对于无法手术的患者缺乏有效的评价手段,术前影像检查为无创性评估胶质瘤分子分型的重要的检查方法,有助于手术方案的制定以及临床诊疗决策。目前对于较低级别胶质瘤分子分型的影像学预测,主要集中于常规磁共振成像(magnetic resonance imaging, MRI)、功能MRI[2-5],PET相关的研究报道较少。既往研究[6-9]显示,正电子发射型计算机断层显像/电子计算机断层显像(positron emission tomography/computed tomography, PET/CT)和PET/MRI能够辅助诊断胶质瘤、预测病理分级及分子分型。18F-脱氧葡萄糖(18F-fluorodeoxyglucose,18F-FDG)是目前最常用的正电子显像剂,但是正常脑皮质及深部核团具有较高的生理性摄取,一定程度上影响对于病变摄取程度的判断以及轮廓的显示。氨基酸代谢类显像剂,包括11C-蛋氨酸(11C-methionine,11C-MET)、 O-(2-[18F]氟代乙基)-L-酪氨酸(O-(2-[18F]-fluoroethyl)-L-tyrosine,18F-FET),较18F-FDG对于胶质瘤的诊断更具有优势,尤其是较低级别胶质瘤。既往研究[7,10]显示,IDH野生型胶质瘤对于11C-MET、18F-FET的摄取较IDH突变型肿瘤摄取更高,这些研究大多纳入胶质母细胞瘤,缺乏针对IDH野生型较低级别胶质瘤代谢程度的研究。另外,低级别胶质瘤1p/19q共缺失对于氨基酸代谢的影响仍有一定的争议[9, 11]。幕上较低级别胶质瘤多见于成人,与幕下胶质瘤存在临床和分子分型的差异。因此,本研究以幕上较低级别胶质瘤为研究对象,评估11C-MET PET/CT在筛查分子分型中的价值。
1 对象与方法
1.1 研究对象
将2016年5月至2018年5月于首都医科大学附属北京天坛医院核医学科术前行11C-MET PET/CT,后经病理确诊为幕上LrGG的患者作为研究对象。纳入标准:①病理证实为WHO Ⅱ级或WHO Ⅲ级胶质瘤;②初诊未经治疗患者;③均行IDH基因突变检测,对于IDH突变型LrGG,均行1p/19q联合缺失检测。排除标准:①曾接受过治疗的复发病例;②分子检测结果不完整。根据IDHR132H抗体免疫组织化学染色结果评估IDH状态,若IDH检测为阴性,行焦磷酸测序确定IDH基因突变状态。采用荧光原位杂交技术对染色体1p/19q进行检测。最终纳入37例患者,其中男性23例,女性14例,平均年龄(41.7±18.1)(8~68)岁,其中WHO Ⅱ级胶质瘤23例,WHO Ⅲ级胶质瘤14例。
根据IDH基因以及1p/19q检测结果,将患者分为IDHwtLrGG、IDHmut1p/19qdelLrGG和IDHmut1p/19qintLrGG 3组。所有患者检查前均签署知情同意书。本研究利用的研究信息不含有使受试者的身份被直接识别或通过与其相关的识别物识别的信息,免除伦理审查。
1.2 11C-MET PET/CT显像
检查前无需特殊准备。静脉注射11C-MET 555-740 MBq(10~20 mci)后10~15 min行脑PET/CT显像。PET/CT扫描仪均采用 Discovery Elite机型(GE公司,美国)。扫描参数: 10 min/床位,采集1个床位。电压120kV,电流160 mA,层厚3.0 mm。采用CT图像对PET图像进行衰减矫正。采用有序子集最大期望值方法进行图像重建。
1.3 图像分析
将扫描得到的11C-MET PET/CT图像传至Advantage Workstation工作站,由2名有经验的核医学科医师共同阅片,对病灶进行半定量分析。所有病灶对11C-MET的摄取均高于背景摄取值。在病灶摄取增高区域,结合MRI图像上病灶的范围,基于42%最大标准摄取值(maximum standardized uptake value, SUVmax)进行半自动勾画[12],测量SUVmax、平均标准摄取值(mean SUV, SUVmean)以及标准摄取值峰值(peak SUV, SUVpeak)。在对侧正常额顶叶,勾画新月形的感兴趣区,包括灰白质,测量SUVmean,记录为正常组织标准摄取值(SUV of normal tissue,SUVnormal)。
计算最大肿瘤/正常组织摄取比值(maximum tumor/normal tissue uptake ratio, TNRmax):SUVmax/SUVnormal,平均肿瘤/正常组织摄取比值(mean TNR , TNRmean): SUVmean/SUVnormal, 以及肿瘤/正常组织摄取比值峰值(peak TNR, TNRpeak):SUVpeak/SUVnormal[13]。
1.4 统计学方法
2 结果
2.1 LrGG基因表达情况
37例入组患者中,IDHwtLrGG,共12例,其中间变星形细胞瘤10例,星形细胞瘤1例,间变少突胶质细胞瘤1例;IDHmut1p/19qdelLrGG,共14例,其中少突胶质细胞瘤13例,间变少突胶质细胞瘤1例;IDHmut1p/19qintLrGG,共11例,其中星形细胞瘤8例,间变星形细胞瘤3例。
2.2 不同种类LrGG对于11C-MET摄取的比较
IDHwtLrGG 组TNRmax、TNRmean、TNRpeak最高,其次为IDHmut1p/19qdelLrGG,IDHmut1p/19qintLrGG最低。TNRmax、TNRmean、TNRpeak在3组间差异均具有统计学意义(P<0.05)。详见表1和图1。各组患者典型图像见图2。
表1 不同种类较低级别胶质瘤对于11C-MET摄取程度比较Tab.1 Comparision of 11C-MET uptake in different types of LrGG
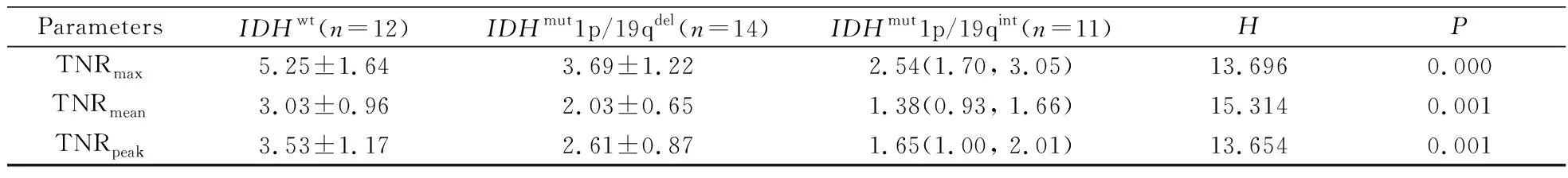
表1 不同种类较低级别胶质瘤对于11C-MET摄取程度比较Tab.1 Comparision of 11C-MET uptake in different types of LrGG
ParametersIDHwt (n=12)IDHmut1p/19qdel(n=14)IDHmut1p/19qint(n=11)HPTNRmax5.25±1.643.69±1.222.54(1.70, 3.05)13.6960.000TNRmean3.03±0.962.03±0.651.38(0.93, 1.66)15.3140.001TNRpeak3.53±1.172.61±0.871.65(1.00, 2.01)13.6540.001
11C-MET: 11C-methionine; LrGG:lower-grade glioma;IDHwt:isocitric dehydrogenase wild type; IDHmut1p/19qdel:IDH mutant-1p/19q co-deleted type;IDHmut1p/19qint:IDH mutant-1p/19q intact type;TNRmax: maximum tumor/normal tissue uptake ratio;TNRmean:mean tumor/normal tissue uptake ratio;TNRpeak :peak tumor/normal tissue uptake ratio.
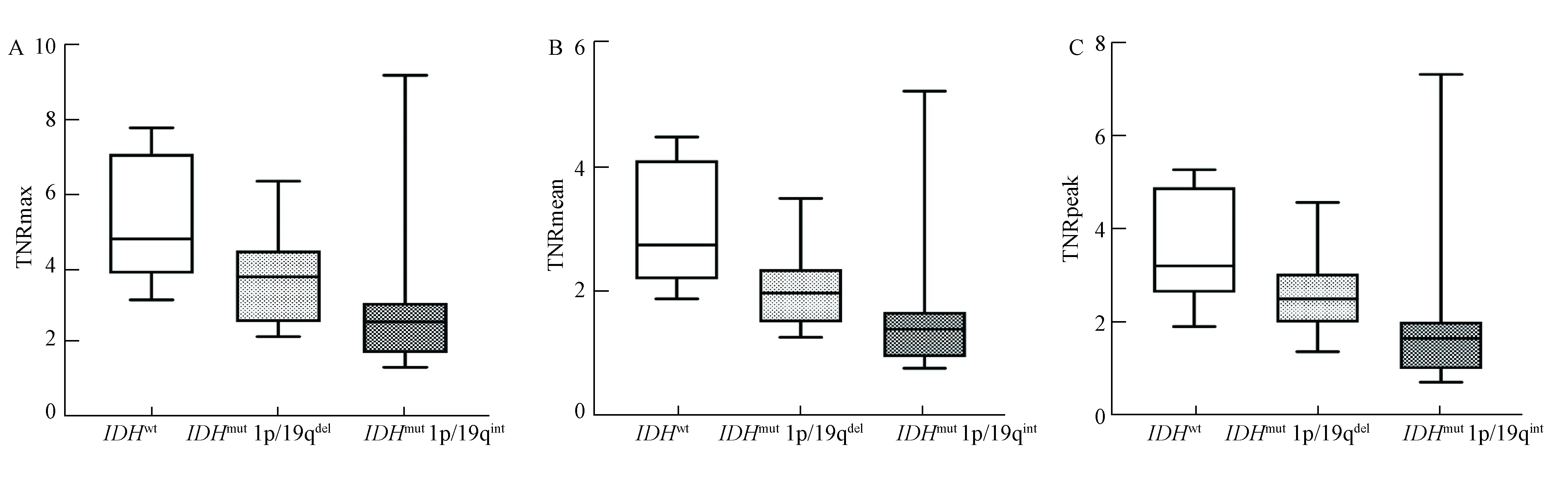
图1 不同分子亚型较低级别胶质瘤半定量参数比较Fig.1 Comparison of semiquantitative parameters in different molecular subtypes of lower-grade gliomas
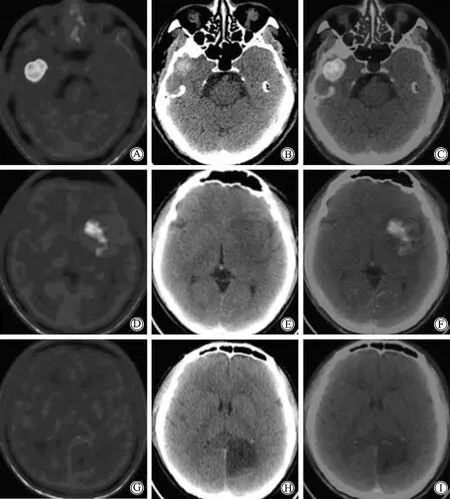
图2 不同分子分型较低级别胶质瘤的典型图像Fig.2 Typical images of lower-grade glioma with different molecular types
2.3 11C-MET PET/CT筛查 LrGG IDH基因突变的效果评价
IDHwtLrGG组的TNRmax、TNRmean、TNRpeak均高于IDHmutLrGG组,差异具有统计学意义(P<0.05),详见表2。ROC曲线显示,单参数中,TNRmean对IDH基因突变具有较高的筛查效能,曲线下面积(area under the curve, AUC)为0.847,以1.84为阈值,灵敏度、特异度和准确率分别为64.0% 100%和75.5%。以IDH基因突变为因变量,TNRmax、TNRmean及TNRpeak为自变量,通过Logistic多因素回归分析建立联合筛查模型,筛查模型为logitP=6.716+6.237TNRmax-25.832TNRmean+9.886TNRpeak,筛查的AUC值为0.943,灵敏度、特异度和准确率分别为100%、83.3%和94.6%,模型筛查结果明显优于各项指标单独使用的结果。详见表3、图3A。
2.4 11C-MET PET/CT筛查IDH突变型LrGG 1p/19q染色体共缺失的效果评价
IDHmut1p/19qdel的TNRmax、TNRmean、TNRpeak显著均高于IDHmut1p/19qint(P<0.05),详见表4。ROC曲线显示单参数中,TNRpeak筛查1p/19q染色体共缺失效能最佳,AUC为0.812,以2.02为阈值,灵敏度、特异度和准确率分别为78.6%、81.8%和80.0%。通过Logistic多因素回归分析建立联合筛查模型,筛查模型为logitP=-0.728+0.141TNRmean+0.318TNRpeak,筛查的AUC值为0.792,灵敏度、特异度和准确率分别为85.7%、72.7%和80.0%。与单参数TNRpeak比较,灵敏度提升,但特异度下降,准确率相近。详见表5、图3B。

表2 IDH野生型和突变型较低级别胶质瘤对于11C-MET摄取程度比较Tab.2 Comparison of 11C-MET uptake between IDHwt LrGG and IDHmut LrGG
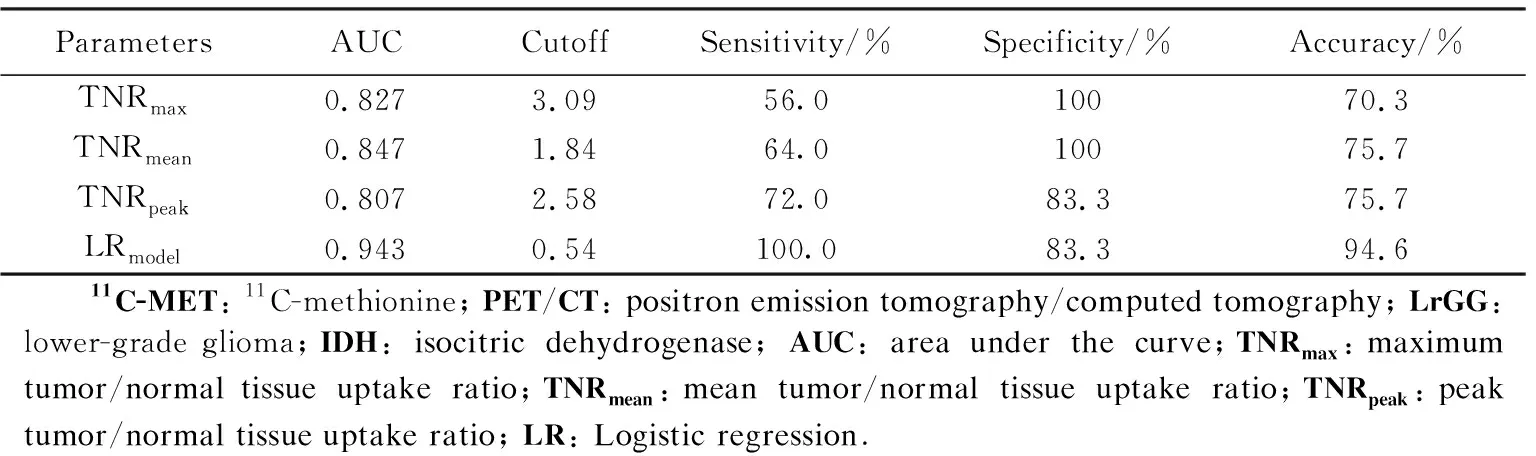
表3 11C-MET PET/CT筛查LrGG IDH基因突变的效能Tab.3 Performance of 11C-MET PET/CT in screening IDH gene mutation
表4 IDHmut1p/19qdel与IDHmut1p/19qint LrGG之间11C-MET摄取程度比较Tab.4 Comparison of 11C-MET uptake between IDHmut1p/19qdel LrGG and IDHmut1p/19qintLrGG

表4 IDHmut1p/19qdel与IDHmut1p/19qint LrGG之间11C-MET摄取程度比较Tab.4 Comparison of 11C-MET uptake between IDHmut1p/19qdel LrGG and IDHmut1p/19qintLrGG
Parameters IDHmut1p/19qdel(n=14)IDHmut1p/19qint(n=11)ZPTNRmax3.69±1.222.54(1.70, 3.05)-2.2450.025TNRmean2.03±0.651.38(0.93, 1.66)-2.4640.013TNRpeak2.61±0.871.65(1.00, 2.01)2.6280.008 IDH: isocitric dehydrogenase; IDHmut1p/19qdel:IDH mutant-1p/19q co-deleted type;IDHmut1p/19qint:IDH mutant-1p/19q intact type;LrGG: lower-grade glioma; 11C-MET: 11C-methionine; TNRmax:Maximum tumor/normal tissue uptake ratio;TNRmean:Mean tumor/normal tissue uptake rati-o;TNRpeak :peak tumor/normal tissue uptake ratio.
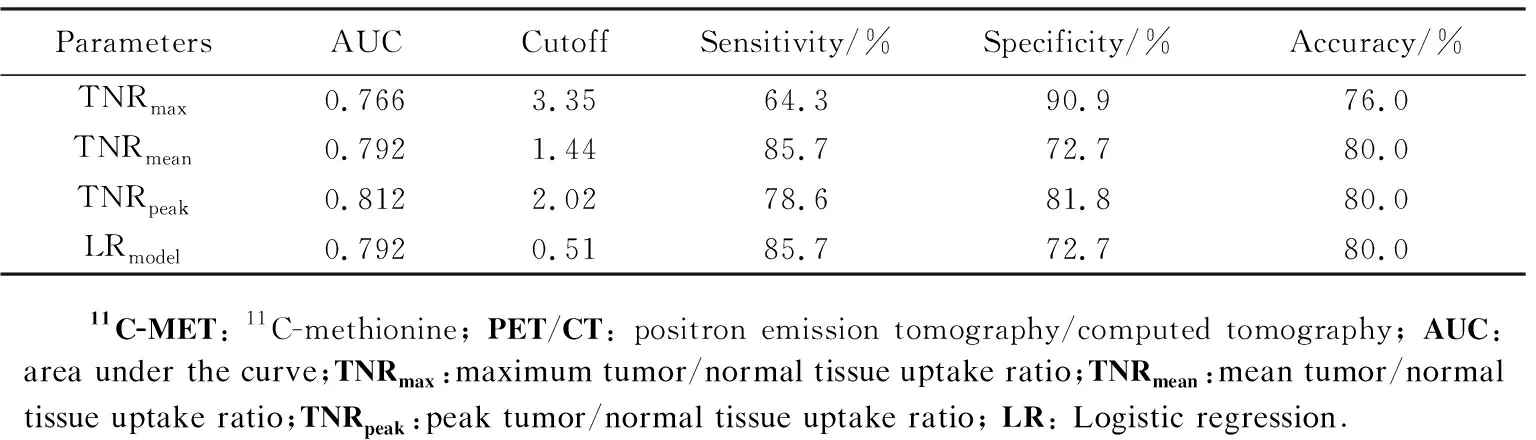
表5 11C-MET PET/CT筛查1p/19q共缺失的效能Tab.5 Performance of 11C-MET PET/CT in screening 1p/19q co-deletion

图3 单参数以及联合诊断模型的ROC分析Fig.3 ROC curves of single parameter and LR model
3 讨论
IDH基因突变以及1p/19q共缺失状态是与较低级别胶质瘤治疗、预后相关的重要分子标志。术前预测LrGG的分子分型有助于临床制定个体化治疗方案。本研究根据IDH基因突变以及1p/19q共缺失状态,对不同分子分型LrGG的11C-MET代谢程度进行比较,所使用的半定量参数为肿瘤/正常组织放射性比值,与SUV值比较,可以消除个体因素及不同显像仪器的影响。结果显示,IDHwtLrGG对11C-MET的摄取最高,其次为IDHmut1p/19qdelLrGG,IDHmut1p/19qintLrGG摄取最低,11C-MET PET/CT可用于筛查IDH突变以及1p/19q的共缺失状态。
IDH基因突变在成年人少突胶质细胞瘤和星形细胞瘤中的突变率>50%[14-15],本研究入组病例中,68%(25/37)的病例具有IDH突变,与既往文献[12-13]一致,同时发现IDH野生型LrGG在WHO Ⅲ级胶质瘤更为多见,因此LrGGIDH突变发生率与病理学分级可能存在一定的相关性。既往关于PET预测胶质瘤IDH突变的研究中,大多数研究对象包括胶质母细胞瘤。通常认为,IDH野生型胶质瘤对于18F-FDG、11C-MET、18F-FET、[18]F -L-6-氟-3,4-二羟基苯丙氨(6-[18F]fluoro-L-3,4-dihydroxyphenylalanine,18F-FDOPA)以及11C-choline的摄取均高于IDH突变型[7, 9-10, 16-18]。少部分研究[11,15]以较低级别胶质瘤为研究对象。如Okita等[15]纳入了40例较低级别胶质瘤,发现11C-MET 的摄取程度与IDH突变无相关性。Riva等[11]研究显示,在11C-MET PET/CT显像中,IDH野生型LrGG具有较高的SUVmax以及放射性摄取比值(SUVratio),本研究结果与后者相一致,IDHwtLrGG的TNRmax、TNRmean、TNRpeak均高于IDHmutLrGG。其中,TNRmean诊断效能相对较高,以1.84为阈值,AUC为0.847,准确率为75.7%,联合诊断模型能够进一步提高诊断效能,灵敏度、特异度和准确率分别为100%、83.3%和94.6%。既往文献[1,19]报道大部分野生型较低级别胶质瘤,比如具有EGFR扩增或TERT基因突变的肿瘤,与原发胶质母细胞瘤具有相近的生物学行为和分子表型,具有较高的侵袭性。目前常规及功能磁共振研究结果显示,IDH野生型较低级别胶质瘤血-脑脊液屏障破坏的比率更高,并且具有较高的细胞密集度和血流灌注,这些因素均与蛋氨酸的摄取相关,因此表现为更高的代谢活性[20-21]。
对于IDH突变型较低级别胶质瘤,1p/19q共缺失型少突胶质细胞瘤,对化疗更为敏感,预后较好。术前使用无创性影像评估1p/19q共缺失状态对于手术方案的制定、化疗和放射治疗(以下简称放疗)方法的选择以及预后评估具有重要意义,尤其是对于不能实现最大程度安全切除的肿瘤,具有更重要的参考价值。常规MRI的T2/Flair不匹配征对于1p/19q共缺失的预测具有一定的参考价值,特异度可达100%,但是灵敏度差,为10.9%~51%[4, 22-23]。11C-MET、18F-FET PET可用于预测1p/19q共缺失[9,11,24-26],如Jansen等[24]研究发现在18F-FET PET/CT显像中,1p/19q共缺失胶质瘤TNRmax、TNRmean以及生物肿瘤体积均显著高于1p/19q非共缺失的胶质瘤。11C-MET PET与1p/19q共缺失的相关性仍存在一定的争议,一些研究者[9, 25-26]认为具有1p/19q共缺失的低级别胶质瘤具有更高的代谢,并且在WHO Ⅱ级胶质瘤中差异更为显著。但是,Riva等[11]对96例术前接受11C-MET PET/CT显像的LrGG患者进行研究的结果显示,1p/19q共缺失型肿瘤具有更低的相对放射性摄取值,考虑可能受IDH基因突变的影响,1p/19q非共缺失LrGG具有更高的IDH野生型的概率,尤其是间变性星形细胞瘤,对11C-MET具有较高的摄取。本研究同时结合IDH基因突变和1p/19q共缺失状态进行分类,消除了IDH基因突变的影响,同样发现1p/19q共缺失型胶质瘤具有较高的相对放射性摄取值,在本研究中,IDHmut1p/19qdel型胶质瘤均为少突胶质细胞瘤,既往研究[26]显示,少突胶质细胞瘤较星形细胞瘤具有较高的细胞密集度和微血管密度以及L-氨基酸转运体的数量,导致其对于MET高摄取。需要指出的是,少突胶质瘤代谢增高并不意味着其细胞增殖活性增高。本研究中单参数TNRmean、TNRpeak具有相对较高的诊断效能,具有较高的准确率。但是多参数联合分析并不能提高对于1p/19q共缺失的诊断效能。PET/MRI为一种多模态、多参数成像方式,能够同时提供肿瘤的形态、弥散、血流灌注及代谢信息,有望成为提升1p/19q共缺失筛查效能的检查手段,可行进一步探索。
总之,对于较低级别胶质瘤,11C-MET PET半定量参数与IDH基因突变以及1p/19q共缺失状态具有相关性,具有较好的筛查效能,多参数联合分析能够提高对于IDH基因突变的诊断准确率。本研究样本量较小,对于11C-MET PET在筛查较低级别胶质瘤分子分型预测中的价值进行了初步探索,未来需要更大的研究队列验证本结果。
利益冲突所有作者均声明不存在利益冲突。
作者贡献声明张姝:提出研究思路,设计研究方案,数据分析,撰写论文;王凯:数据采集获取;杨子皓:数据采集获取;乔真:数据分析;李晓桐:数据分析;袁磊磊:审定论文;艾林: 审定论文,总体把关。
