电针心经/心包经穴对MCAO/R 大鼠MeCP2磷酸化影响的研究
2022-11-29李赛群
潘 江,曹 洋,2,陈 成,李赛群,章 薇*
(1.湖南中医药大学第一附属医院,湖南 长沙 410007;2.湖南中医药大学,湖南 长沙 410208)
脑缺血损伤后神经功能的重建与修复一直以来都是医学领域的研究热点[1],其中突触可塑性是脑缺血损伤后康复的主要机制之一[2]。 DNA 甲基化通过甲基化CpG 结合蛋白2(methyl CpG binding protein 2, MeCP2)磷酸化修饰途径调控目标基因的表达变化,在神经干细胞的自我更新、分化、可塑性调节中发挥关键作用[3]。 相关研究证实,MeCP2 磷酸化修饰及其信号途径参与了脑缺血损伤后神经细胞的分化与调节[4]。 针刺作为脑缺血疾病的一种重要的防治手段,被广泛应用于脑缺血疾病的不同临床时期,并取得了良好的疗效[5-8]。 本课题组前期研究发现,电针心经/心包经穴可以诱导神经营养因子(nerve growth factor, NGF)的释放[9],但其效应过程尚不明确。根据MeCP2 磷酸化修饰途径在诱导神经细胞特异性基因表达,促进NGF 释放、树突发生和棘突成熟等方面发挥的重要作用[10]。 本研究通过观察电针心经/心包经穴对中动脉先闭塞再灌注(middle cerebral artery occlusion/reperfusion, MCAO/R)大鼠神经功能缺损以及脑组织中MeCP2 磷酸化修饰变化的影响,验证电针心经/心包经穴改善脑缺血损伤的作用与MeCP2 磷酸化修饰途径密切相关,为“从心治脑”以及经穴特异性提供实验依据。
1 材料与方法
1.1 实验动物及分组
健康雄性SPF 级SD 大鼠200 只,体质量250~350 g,由湖南中医药大学实验动物中心提供,合格证号为SCXK(湘)2016-0002。所有动物均在SPF 级动物房喂养,自由摄食与饮水,饲养温度为20~25 ℃,湿度为40%~60%。 本实验所有操作都通过了湖南中医药大学动物实验伦理要求(伦理审批号:ZYFY20160513),并严格遵照中华人民共和国科技部2006 年颁布的《关于善待实验动物的指导性意见》中有关动物的使用及伦理学规定。
运用随机数字表法将200 只大鼠分为正常组(40 只)、假手术组(40 只)、造模组(120 只)。 造模后随机将120 只造模组大鼠分为模型组、心经穴组、心包经穴组,每组40 只;再随机将各组分为1 d、7 d、14 d、21 d 亚组,每亚组10 只。
1.2 主要仪器和试剂
SDZ-Ⅱ华佗电针治疗仪、华佗牌针灸针0.16 mm×13 mm(苏州医疗用品厂有限公司);ABI 7500 定量PCR 仪(美国ABI 公司);DYY-6C 电泳仪(北京六一仪器公司);蛋白电泳及转膜设备(美国Bio-Rad公司);实时荧光定量PCR 仪(7500Fast,美国Perkin Elmer 公司);J2-21 高速离心机、J6-HC 离心机(美国Beckman 公司);凝胶成像分析系统(美国Bio-Rad公司);DU 80 紫外分光光度计(美国Beckman 公司);定量PCR 试剂盒(广州复能基因有限公司);BCA蛋白定量检测试剂盒(上海东寰生物科技)。
1.3 大鼠MCAO/R 模型的建立
采用大鼠大脑中动脉先闭塞再灌注法[11]构建MCAO/R 模型。 造模后2 h 大鼠完全苏醒后参照Longa 评分法[12]对大鼠神经缺损进行评分:无偏瘫及神经功能缺损为0 分;梗死对侧前爪屈曲、伸直障碍为1 分;向偏瘫侧转圈追尾为2 分;爬行时向偏瘫侧倾倒为3 分;意识丧失、不能行走为4 分。 将评分为1~3 分大鼠视为造模成功,纳入实验观察。实验过程中,线栓未能成功插入及死亡大鼠2 只,将其进行剔除,所有剔除大鼠按实验要求进行随机补充。
1.4 干预方法
正常组:捆绑处理,不予电针;假手术组:血管分离后不插线缝合,捆绑处理,不予电针;模型组:MCAO/R,捆绑处理,不予电针;心经穴组:MCAO/R+电针心经穴;心包经穴组:MCAO/R+电针心包经穴。
电针方法:根据2010 版《实验针灸学》[13]确定腧穴位置,按照经脉“胸走手”的循行方向,选取瘫痪侧肢体不同节段常用穴位,心包经组取天泉、曲泽、内关、大陵为代表穴,心经穴组取极泉、少海、灵道、神门为代表穴。大鼠造模成功后第2 天开始针灸治疗,15 mm、36 号一次性无菌针灸针刺入上述穴位3 mm左右后,分别连接电针仪的输出端,予以电针刺激。电针连接方式:心包经穴组曲泽与天泉相连,大陵与内关相连;心经穴组极泉与少海相连,灵道与神门相连。 电针刺激参数为连续波、20 Hz,强度以大鼠上肢轻微抖动为度,每次30 min,每日1 次。
1.5 检测指标及方法
1.5.1 大鼠神经功能缺损评分 各组治疗完成后第2 天采用改良神经功能缺损评分[14-15]评估电针对大鼠神经功能恢复的影响。总分为18分,分值越高,神经功能损伤程度越重。
1.5.2 大鼠脑梗死体积百分比测定 将标本放入脑槽中做冠状切片,4 刀将大鼠脑分为5 片。 第1 刀于脑前极和视交叉连线的中点,第2 刀于大脑视交叉处,第3 刀于漏斗柄处,第4 刀于漏斗柄与尾极之间,每片厚约2 mm。 将脑片放入2% TTC 磷酸缓冲液中进行染色,37 ℃避光恒温箱孵育30 min,正常脑组织为红色,而梗死部位呈白色。染色后进行拍照处理,并采用多媒体彩色病理图象分析系统测量每片的面积和梗死灶面积,然后乘以片厚(2 mm),即每片体积和梗死灶体积,脑梗死体积百分比即为梗死区体积与正常侧大脑半球体积的比值,再进行统计分析[16]。
1.5.3 大鼠海马区MeCP2 mRNA 表达的检测 取-80 ℃冻存的组织标本30 mg 于装有液氮中的研钵中研磨成粉末。采用Trizol-离心柱法提取总RNA,测定RNA 纯度,计算RNA 溶液浓度,判断RNA 提取质量,则可以满足后续RT-PCR 所需。 将提取到的总RNA 反转录后得到cDNA,-20 ℃保存。 利用实时荧光定量PCR 试剂盒配置扩增体系,标准实时PCR 反应体积为20 μL,实时PCR 条件为95 ℃1.5 min。 95 ℃15 s,60 ℃25 s,72 ℃30 s,以上3 步骤进行40 个循环。以beta-actin 用作对照。引物由广州复能基因有限公司合成,引物序列见表1。 使用2-△△Ct分析数据。

表1 引物序列
1.5.4 大鼠MCAO 大鼠海马区MeCP2、PMeCP2 蛋白表达的检测 取-80 ℃冰箱冻存的组织标本100 mg于装有液氮中的研钵中研磨成粉末。 加入RIPA 裂解,采用BCA 蛋白定量法测定蛋白浓度。 将蛋白样品和maker 加入上样孔,通过凝胶电泳制备样品并电转移到聚偏二氟乙烯膜上。 在含有5%无脂乳的PBS 中封闭1 h 后,加入一抗GAPDH(1∶1000)、MeCP2(1∶1000)、pMeCP2(1∶1000)24 ℃摇床过夜。隔天洗膜后加入二抗Rabbit-HRP(1∶8000)室温孵育2 h,洗膜后,放入化学发光凝胶成像系统曝光,采用Image J 图像分析处理系统将扫描后的图像进行灰度分析,以目的蛋白条带与beta-actin 条带灰度值的比作为目的蛋白的相对表达量。
1.6 统计学分析
采用SPSS 20.0 统计软件进行数据分析。 计量资料用“±s”表示,资料满足正态分布,多组间比较采用方差分析;不满足正态分布和方差齐性时采用Wilcoxon 秩和检验。 以P<0.05 表示差异有统计学意义。
2 结果
2.1 各组大鼠神经功能缺损评分的比较
与正常组及假手术组比,模型组、心经穴组、心包经穴组神经功能缺损在1 d、7 d、14 d、21 d 的评分明显升高(P<0.01),提示造模成功。与模型组比,心经穴组在14 d、21 d的评分明显降低(P<0.01);心包经穴组在7 d、14 d 的评分降低(P<0.05),21 d的评分也显著降低(P<0.01)。心经穴组、心包经穴组两组之间比较,差异无统计学意义(P>0.05)。 详见表2。
表2 各组大鼠神经功能缺损评分的比较(±s,分,n=10)

表2 各组大鼠神经功能缺损评分的比较(±s,分,n=10)
注:与正常组比较,★★P<0.01;与假手术组比较,●●P<0.01;与模型组比较,▲P<0.05,▲▲P<0.01。
组别正常组假手术组模型组心经穴组心包经穴组1 d 0.00±0.00 0.00±0.00 7.50±0.81★★●●7.40±0.51★★●●7.50±0.62★★●●7 d 0.00±0.00 0.00±0.00 7.10±0.82★★●●6.70±0.45★★●●6.50±0.68★★●●▲14 d 0.00±0.00 0.00±0.00 6.70±0.99★★●●5.30±1.27★★●●▲▲5.70±1.35★★●●▲21 d 0.00±0.00 0.00±0.00 6.10±0.85★★●●4.80±0.73★★●●▲▲4.60±0.67★★●●▲▲
2.2 各组大鼠脑梗死体积百分比的比较
与正常组、假手术组比较,模型组、心经穴组、心包经穴组在1 d、7 d、14 d、21 d 的脑梗死体积百分比均明显升高(P<0.01),说明造模成功。 模型组、心经穴组、心包经穴组脑梗死体积百分比各组组间比较,差异均无统计学意义(P>0.05)。 详见表3。
表3 各组大鼠脑梗死体积百分比(±s,%,n=3)

表3 各组大鼠脑梗死体积百分比(±s,%,n=3)
注:与正常组比较,★★P<0.01。 与假手术组比较,●●P<0.01。
组别正常组假手术组模型组心经穴组心包经穴组1 d 0.00±0.00 0.00±0.00 21.14±2.05★★●●20.35±2.16★★●●21.23±3.08★★●●7 d 0.00±0.00 0.00±0.00 21.18±3.04★★●●20.75±2.38★★●●21.41±3.76★★●●14 d 0.00±0.00 0.00±0.00 20.15±3.61★★●●20.54±3.67★★●●20.17±4.54★★●●21 d 0.00±0.00 0.00±0.00 19.67±5.10★★●●19.84±4.76★★●●20.36±6.13★★●●
2.3 各组大鼠海马区MeCP2 mRNA 表达的比较
与正常组及假手术组比较,模型组、心经穴组、心包经穴组在7 d、14 d、21 d 的MeCP2 mRNA 表达均升高(P<0.01);与模型组比较,心经穴组在14 d、21 d 的MeCP2 mRNA 均下降(P<0.01);心包经穴组 在7 d、14 d、21 d 的MeCP2 mRNA 表 达 下 降(P<0.05,P<0.01)。 与心经穴组比较,心包经穴组在14 d 时高于心经穴组(P<0.05),在21 d 时低于心经穴组(P<0.05)。 详见表4。
表4 各组大鼠海马区MeCP2 mRNA 表达的比较(±s,n=5)

表4 各组大鼠海马区MeCP2 mRNA 表达的比较(±s,n=5)
注:与正常组比较,★★P<0.01;与假手术组比较,●●P<0.01;与模型组比较,▲P<0.05,▲▲P<0.01;与心经穴组比较,◇P<0.05。
组别正常组假手术组模型组心经穴组心包经穴组1 d 1.00±0.02 1.33±0.90 1.44±1.17 1.40±1.12 1.92±1.79 7 d 1.00±0.01 5.31±3.05 27.65±12.06★★●●23.79±11.35★★●●21.93±14.38★★●●▲14 d 1.00±0.00 4.81±2.27 26.89±6.43★★●●13.76±2.96★★●●▲▲16.48±3.00★★●●▲▲◇21 d 1.00±0.01 1.91±0.96 21.37±1.26★★●●11.43±5.22★★●●▲▲5.94±3.01★★●●▲▲◇
2.4 各组大鼠海马区MeCP2、pMeCP2 蛋白表达的比较
与正常组及假手术组比,模型组、心经穴组、心包经穴组在7 d、14 d、21 d MeCP2 蛋白表达均升高(P<0.01)。与模型组比,心经穴组在7 d 时MeCP2蛋白表达增高(P<0.01);心包经穴组7 d 时MeCP2蛋白表达增高(P<0.01),在21 d 时降低(P<0.05)。与心经穴组比较,心包经穴组在7 d 时MeCP2 蛋白表达增高(P<0.05)。 详见图1、表5。
表5 各组大鼠海马区MeCP2 蛋白表达的比较(±s,n=5)

表5 各组大鼠海马区MeCP2 蛋白表达的比较(±s,n=5)
注:与正常组比较,★★P<0.01;与假手术组比较,●●P<0.01;与模型组比较,▲P<0.05,▲▲P<0.01;与心经穴组比较,◇P<0.05。
组别正常组假手术组模型组心经穴组心包经穴组1 d 1.00±0.01 0.85±0.80 1.35±0.61 1.86±0.59 1.43±0.42 7 d 1.00±0.02 2.56±1.57 26.89±10.93★★●●33.09±14.72★★●●▲45.56±10.94★★●●▲▲◇14 d 1.00±0.01 2.08±1.47 27.58±3.02★★●●29.41±4.29★★●●28.84±4.81★★●●21 d 1.00±0.03 0.83±0.54 22.37±4.57★★●●21.25±4.66★★●●19.06±6.73★★●●▲
与正常组及假手术组比,模型组、心经穴组、心包经穴组在7 d、14 d、21 d 的pMeCP2 蛋白表达均升高(P<0.01);与模型组比,心经穴组、心包经组在7 d、14 d、21 d 的pMeCP2 蛋白表达升高(P<0.01)。与心经穴组比较,心包穴经组在7 d、14 d、21 d 的pMeCP2 蛋白表达差异均无统计学意义(P>0.05)。详见图1、表6。
表6 各组大鼠海马区pMeCP2 蛋白表达的比较(±s,n=5)

表6 各组大鼠海马区pMeCP2 蛋白表达的比较(±s,n=5)
注:与正常组比较,★★P<0.01;与假手术组比较,●●P<0.01;与模型组比较,▲▲P<0.01。
组别正常组假手术组模型组心经穴组心包经穴组1 d 1.00±0.01 1.02±1.11 2.75±1.91 2.43±1.81 2.45±1.94 7 d 1.00±0.00 1.27±0.60 19.30±5.40★★●●28.41±5.80★★●●▲▲29.39±4.88★★●●▲▲14 d 1.00±0.02 1.05±1.43 12.76±3.21★★●●25.47±6.33★★●●▲▲24.32±7.11★★●●▲▲21 d 1.00±0.01 1.59±0.76 11.52±10.92★★●●25.24±10.31★★●●▲▲25.16±12.23★★●●▲▲
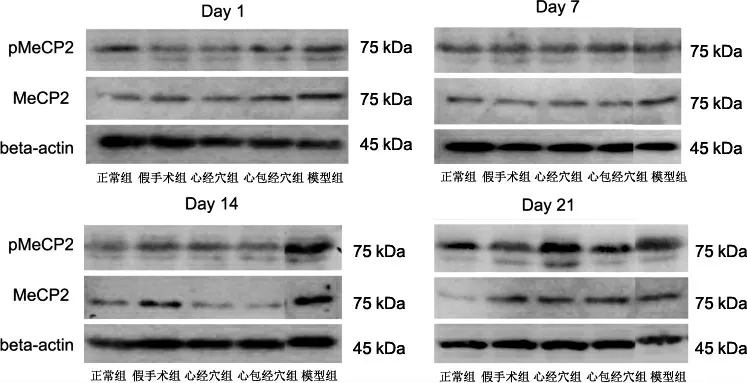
图1 各组大鼠海马区pMeCP2、MeCP2 蛋白条带图
3 讨论
脑血管疾病因其高发病率、高死亡率、高致残率及高复发率等特点越来越受到人们重视[17]。 针灸疗法作为脑缺血疾病的一种重要的防治手段已被公认,其作用机制一直都是研究的热点[18-19]。曹香玲等[20]采用电针曲池、足三里,黄金等[21]采用电针神庭、百会,均证实了电针的疗效。本研究干预思路源于中医经典原创理论“心主血脉、心主神明”,选取与心、脑密切相关的心经穴、心包经穴治疗脑缺血疾病,有“从心治脑”一说[22],目前两经对比的研究报道尚少见。为更好代表经脉特异性,本研究选穴依据具有以下特点:均为腕肘肩关节或其附近的特定穴,均是本经本脏临床治疗中的常用穴,均位于肢体相同的神经节段处。 本实验研究结果证实,电针心经穴与心包经穴均能有效改善神经功能缺损症状,疗效确切,且其作用呈现时间效应。 但是其脑梗死率改变不明显,考虑其可能与脑梗死区恢复期较长,且梗死损伤的不可逆相关。
脑缺血损伤后神经功能重建与修复是治疗该病的关键。 突触可塑性理论是脑损伤后神经修复的重要学说[2]。 诸多研究证实,电针可以调节脑缺血损伤后突触结构的可塑性以及突触的功能可塑性[2,23-24]。课题组前期研究发现,电针心包经穴也具有此效应[25-26],但是其具体作用途径及机制尚不明确。 MeCP2 磷酸化修饰途径调控目标基因的表达,从而影响神经干细胞的分化及可塑性改变可能是其发挥作用的关键。 MeCP2 具有转录激活子和抑制子的双重身份,通过组蛋白乙酰化和DNA 甲基化调节多个基因的表达水平[27]。 研究证实,MeCP2 特异性结合甲基化DNA参与神经发育的多个阶段[28],在神经突的形成和发育中扮演着重要角色。 MeCP2 对神经细胞的生物学调节作用与自身磷酸化状态(磷酸化或脱磷酸化)密切相关[27]。 李攀等[4]发现脑缺血诱导的MeCP2 磷酸化修饰及其介导的胞核-胞质转位在缺血性卒中后神经干细胞的分化调节中发挥至关重要的作用。 本研究也发现,缺血损伤急性期MeCP2 mRNA、MeCP2蛋白、pMeCP2 蛋白的表达增加,这一结果证实缺血损伤可诱导机体的应激反应,促使自身MeCP2 磷酸化机制的产生[29-30]。
此外,本研究发现心经穴、心包经穴电针刺激后,两经穴组均可在一定时间段先促进MeCP2、pMeCP2 表达,加速MeCP2 磷酸化的转变过程,延缓pMeCP2 下降,心包经穴比心经穴可以更早(7 d)、更强(14 d、21 d)地发挥延缓MeCP2 减少的作用。pMeCP2 脑损伤后开始增多,7 d 到达峰值后,逐步下降,而电针心经穴、心包经穴延缓其下降的作用大致相当。 综上所述,本实验结果证实电针心经穴、心包经穴可以促进MeCP2 磷酸化,延缓其下降过程,改善脑缺血损伤大鼠的神经功能缺损症状,两经效果大体相当。 本实验结果为临床运用心经、心包经穴治疗脑缺血提供了一定的理论依据与实验基础,但电针心经、心包经穴对MeCP2 磷酸化与突触可塑性以及神经修复之间的关系,以及具体的作用机制还需要进一步深入研究。
