羟丙基甲基纤维素对盐酸小檗碱肠道微环境调控效应的影响△
2022-11-27吴晨阳黎迎邹佩志郑婷婷张运董政起
吴晨阳,黎迎,邹佩志,郑婷婷,张运,董政起
中国医学科学院 北京协和医学院 药用植物研究所,北京 100193
盐酸小檗碱(BBR)是主要从黄连及黄檗中分离出来的生物碱,具有多重生物学功能。BBR 极性小、溶解度低、渗透性差、血药浓度极低、生物利用度低[1],但其在治疗胃肠道炎症[2]、代谢相关疾病[3](如2 型糖尿病[4])、阿尔茨海默病及帕金森症[5]等方面具有显著的药效。按照传统药理学观念,药物需靠有效成分入血并达到一定浓度才可发挥治疗作用,这个理论尚无法全面阐释BBR 的多种药理活性。目前的研究指出,除少量吸收入血以外,BBR发挥上述药效的另一关键原因可能是其吸收差而在肠道内大量富集所带来的菌群调节作用[6],如提高短链脂肪酸(特别是丁酸)产生菌的相对丰度等[7]。因此,充分发挥BBR 的菌群调节作用或可作为提高其药效的一种关键手段。
随着越来越多的研究聚焦在肠道健康,肠道菌群与外界及机体关系的黑匣子逐渐被打开[8],研究发现,肠道微生态的稳定与否[9]及日常饮食习惯[10]会对肠道功能产生多方面的影响,如肠道渗透性与肠道屏障功能。研究表明,肠道渗透性与多种疾病相关,关注肠道渗透性对于疾病预防及治疗至关重要。据报道,肠道屏障轻度受损会引起肠道弱炎症[11],促炎细胞因子表达量升高,机体易感程度变大,易于受到黏附侵袭性大肠埃希氏菌感染,从而导致肠道紊乱进一步加剧,肠道渗透性增强,有害小分子进入机体,加剧机体炎症[12]。其中肠道屏障功能受损的初始表现有肠道黏液层变薄[13],从而引起黏膜层结构等损伤,肠上皮出现囊肿的概率变大。
羟丙基甲基纤维素(HPMC)作为一种药用辅料记载于《中华人民共和国药典》2020 年版[14],在生物医药行业有多方面的应用,主要用于包衣材料、膜材料及缓释制剂的控释材料[15],如作为片剂中的黏附材料[16]、改进阿司匹林肠溶片的包衣材料[17]、药物缓释片的骨架材料[18-19]。一方面,作为最常用的亲水载体之一,HPMC在制剂研究中得到广泛青睐。研究表明,在口腔黏膜药物递送系统中,HPMC 可增强药物黏附于口腔黏膜的能力,从而增加药物与口腔黏膜接触的时间,以更好地发挥药效[20]。另有研究表明,作为原位凝胶的基质之一,随着HPMC F4M 浓度的增加,其凝胶黏性增加,同时延缓药物释放的程度也相应增加[21]。另一方面,作为不可发酵的膳食纤维,HPMC 被认为是一种潜在的益生元纤维[22],已有报道指出其可调节高脂喂养小鼠的肠道菌群Alpha多样性及菌群组成[23]。
目前,对药用辅料的功能认知逐渐深入,传统意义上选用药用辅料的标准不断被刷新,已经不局限于选择安全性高、生物相容性好、不与活性物质相互作用的辅料,其与肠道菌群的相互作用也逐渐被纳入考虑范畴,有研究报道多种药用辅料可通过调节菌群影响机体健康及药物治疗效果[24-28],同时,辅料自身的理化性质对药物的菌群调节作用的影响也应得到充分重视。与BBR 相似,HPMC 在人体内不易被代谢,同时具有高黏性,可使BBR 在肠道内滞留,这为药物与肠道菌群充分接触从而更好地发挥菌群调节作用创造了更为有利的条件。本研究以HPMC 为例,对其与BBR 物理混合使用时对肠道微环境的调控效应进行初步探索,也为类似性质的辅料(如果胶、卡波姆和海藻酸钠等)通过肠道菌群调控影响BBR药效方面的研究提供参考。
1 材料
1.1 实验动物
无特定病原体(SPF)级雄性C57BL/6 小鼠40只,体质量18~20 g,购自斯贝福(北京)生物技术有限公司,生产许可证号为SCXK(京)2016-0006,饲养于北京协和医学院药用植物研究所SPF级动物房,小鼠饲养条件为恒温恒湿,环境温度为(22±2)℃,相对湿度为(50±5)%,12 h/12 h 光暗交替,正常给予常规饲料及纯净水。本研究所涉及的动物实验均按照北京协和医学院动物伦理程序和规范处理,审批号为SLXD-20201221013。
1.2 仪器
Secura224-1CN 型电子分析天平(德国Satrorius公司);KQ-500DE 型数控超声波清洗器(昆山市超声仪器有限公司);SP131010-33Q型加热磁力搅拌器(美国Barnstead Thermolyne公司);L550型台式低速大容量离心机(德国Eppendorf 公司);TL-48R 型粉碎研磨仪(上海万柏生物科技有限公司);DYY-6C型电泳仪(北京市六一仪器厂);NanoDrop 2000型超微量分光光度计(美国Thermo Fisher公司);GeneAmp®9700 型聚合酶链式反应(PCR)仪(美国ABI 公司);Quantus™型微型荧光计(美国Promega 公司);Miseq PE300/NovaSeq PE250 平台(美国Illumina 公司);Aperio CS2 型紧凑型台式玻片扫描仪(德国徕卡显微系统)。
1.3 试药
HPMC F4M(批号:D180I8Q012,美国陶氏化学);BBR(批号:ZLSC2020072617,纯度>98%,南京泽朗有限公司);E.Z.N.A.®soil DNA kit(美国Omega Bio-Tek公司);AxyPrep DNAGel Extraction Kit(美国Axygen 公司);琼脂糖(西班牙Biowest 公司);Quantus™Fluorometer(美国Promega 公司);NEXTFLEX Rapid DNA-Seq Kit(美国Bioo Scientific公司);苏木精-伊红(HE)染色试剂盒(北京索莱宝科技有限公司);引物由北京易科拜德生物技术有限公司合成。
2 方法
2.1 溶液制备
配制HPMC 水溶液(40 mg·mL-1),经24 h 常温磁力搅拌,待溶胀至澄清透明黏稠状液体后备用;配制BBR 水溶液(15 mg·mL-1),超声30 min(100 W,40 kHz),得混悬液。先配制HPMC 的水溶液基质,再将BBR 加入基质中,得HPMC 质量浓度为40 mg·mL-1、BBR 质量浓度为15 mg·mL-1的混合溶液,经24 h常温磁力搅拌分散均匀后待用。
2.2 分组与给药
将24 只C57BL/6 小鼠进行1 周的适应性饲养,之后随机分组,分为对照组、HPMC(400 mg·kg-1)组、BBR(150 mg·kg-1)组、HPMC 与BBR 物理混合(H+B,400 mg·kg-1+150 mg·kg-1)组,每组6只。灌胃给药,每日给药1 次,对照组小鼠灌胃给予蒸馏水,共给药3 周。其中,BBR 的给药剂量由文献调研[29]得到,选取BBR 常用给药剂量区间内的中等值进行探索,HPMC 的剂量是预实验筛选出可口服给药的最大剂量。
2.3 结肠病理学检查
小鼠颈椎脱臼处死,取远端结肠组织,去除内容物,以4%组织细胞固定液进行固定,石蜡包埋,以梯度体积分数酒精进行洗脱,按照标准程序切厚度为3.5 μm 的薄片,采用HE 染色,每张切片随机选取3个视野于光学显微镜下进行观察。
2.4 肠道菌群高通量测序分析
药物干预3 周后收集各组小鼠新鲜粪便,放置于冻存管中,液氮速冻后置于-80 ℃冰箱保存,备用。取小鼠粪便,采用E.Z.N.A.®soil DNA kit 进行微生物群落总DNA 抽提,使用1%的琼脂糖凝胶电泳检测DNA 的提取质量,测定DNA 浓度和纯度。使用338F(5'-ACTCCTACGGGAGGCAGCAG-3')和806R(5'-GGACTACHVGGGTWTCTAAT-3')对16S rRNA 基因V3~V4 可变区进行PCR 扩增。将同一样本的PCR 产物混合后使用2%琼脂糖凝胶回收PCR 产物,利用AxyPrep DNA Gel Extraction Kit 进行回收产物纯化,2%琼脂糖凝胶电泳检测,并用Quantus™Fluorometer 对回收产物进行检测定量。使用NEXTFLEX Rapid DNA-Seq Kit 进行建库,利用Miseq PE300/NovaSeq PE250平台进行测序。
2.5 数据统计
因H+B 组1 只小鼠意外死亡,故参与数据统计的各组样本数目情况为对照组6 只,HPMC 组6 只,BBR 组6 只,H+B 组5 只。结肠组织切片观察及厚度标记使用CaseViewer 软件进行分析。菌群操作分类单元(OTUs)作图使用R 3.2.0 软件及GraphPad Prism 软件。菌群Alpha 多样性分析采用Observed-OTUs,Chao1 丰富度指数、Shannon 多样性指数、Simpson多样性指数、Beta多样性分析采用非度量多维标度(NMDS)分析。数据分析采用单因素方差分析(ANOVA)、非参数Tukey 检验。以P<0.05为组间差异具有统计学意义。
3 结果与讨论
3.1 HPMC和BBR对小鼠结肠组织的影响
结肠组织HE染色结果表明,各组小鼠结肠组织黏膜结构完整,肠绒毛无明显缺损,且未观察到明显水肿,说明各组小鼠均未出现明显炎症反应(图1)。
图1 各组小鼠远端结肠组织HE染色切片
对各组小鼠结肠组织黏膜层、黏膜下层及肌膜层(浆膜层与肌层的厚度总和)的厚度进行分析,结果表明,干预3 周后,各组中较为关键的结肠黏膜层厚度未发生显著变化(表1)。由结肠组织HE染色结果和对肠组织各部分厚度的分析,可得HPMC和BBR的干预未对结肠机械屏障造成显著影响。
表1 小鼠结肠组织黏膜层、黏膜下层及肌膜层厚度(, n=3)

表1 小鼠结肠组织黏膜层、黏膜下层及肌膜层厚度(, n=3)
注:与对照组比较,*P<0.05。
3.2 HPMC 和BBR 对小鼠肠道菌群多样性及组成的影响
3.2.1 样本OTUs 重叠情况 采用韦恩图(图2)对各组小鼠肠道菌群中特有OTUs和共有OTUs进行分析,结果表明,对照组、HPMC 组、BBR 组、H+B组OTUs分别为2026、2095、299、161条。HPMC组特有OTUs为323条,多于对照组(267条)、BBR组(96 条)、H+B 组(7 条)。HPMC 组与对照组共有的OUTs为1577条,BBR组与对照组共有的OUTs为7 条,BBR 组与H+B 组共有的OUTs 为22 条。说明从OTUs 数目和特有成分上来看,HPMC 组与对照组相似性更高,而BBR组与H+B组相似性更高。
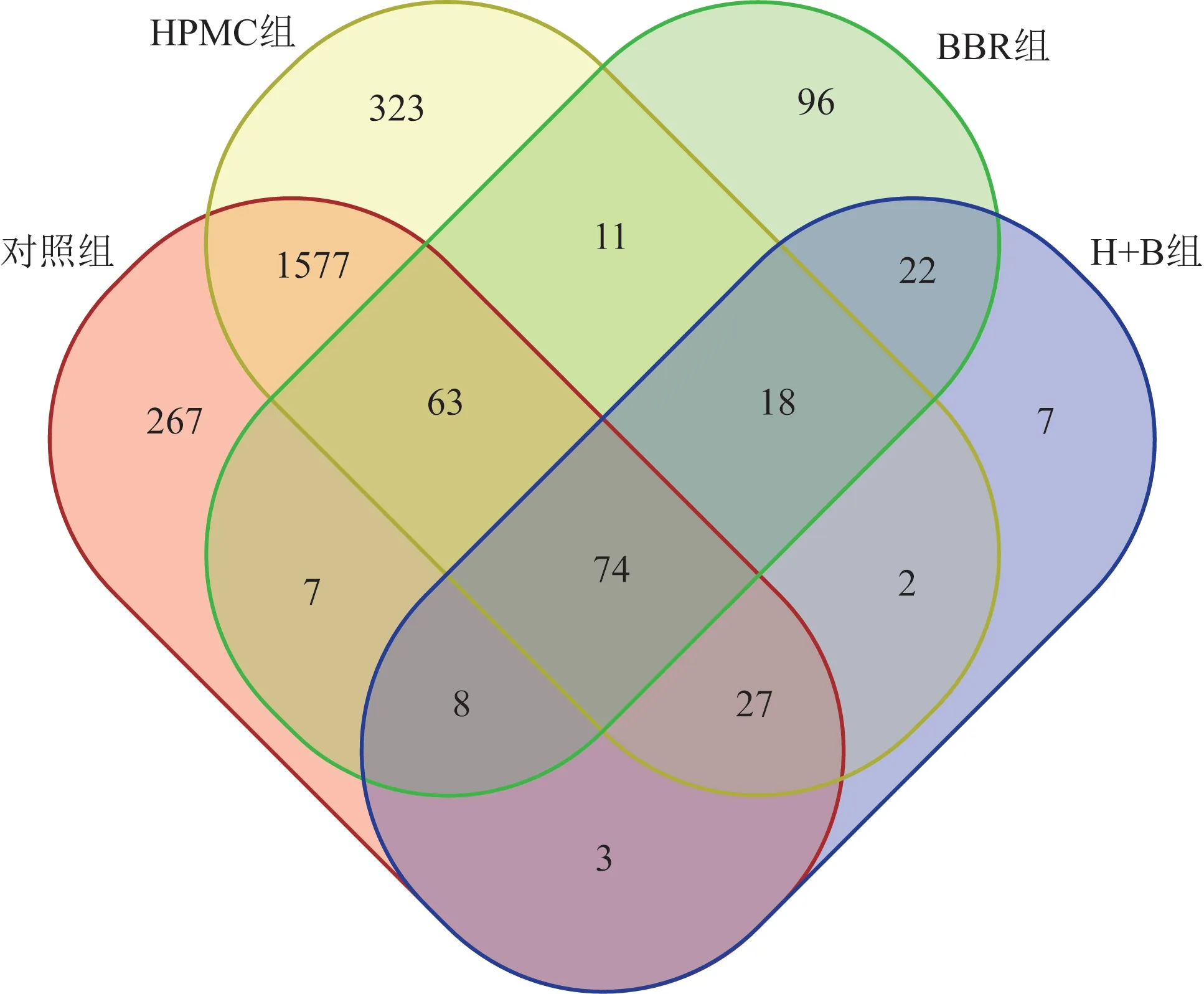
图2 各组小鼠肠道菌群样本OTUs重叠结果韦恩图(n=5~6)
3.2.2 Alpha 多样性 对各组小鼠肠道菌群测序所得的OTUs序列进行Alpha多样性分析(图3),BBR组和H+B 组可观察到的物种数显著低于对照组及HPMC 组(P<0.001)。对由OTUs 数量计算所得的Chao1、Shannon、Simpson 指数进行分析。与对照组相比,HPMC组除组内均匀度降低外,Shannon指数未发生明显变化;BBR 组组内均匀度较好,Shannon指数显著降低(P<0.001)。与BBR组相比,H+B 组Shannon 指数进一步降低,且差异具有统计学意义(P<0.05),Simpson 指数显著降低,差异有统计学意义(P<0.05),即与HPMC 合用增强了BBR 的抗菌能力。推测这与HPMC 的物理性质有关,如代谢惰性、高黏性、酶抑制和胶体保护等。其中,酶抑制的特性可以起到保持黏度稳定性的作用,使得HPMC 在不同的环境中均可以保持出色的黏度。经过长时间的物理混合,HPMC 充分溶胀,使BBR 分散均匀,防止其在溶液底部形成沉淀,HPMC 与水接触后可形成透明、柔韧的膜[30],当经过胃和小肠时对BBR 进行包裹保护,当到达结肠后,HPMC 与BBR 的物理混合体系使得BBR 与肠道菌群接触得更加均匀,因而促进了BBR 降低肠道菌群Alpha多样性的趋势。
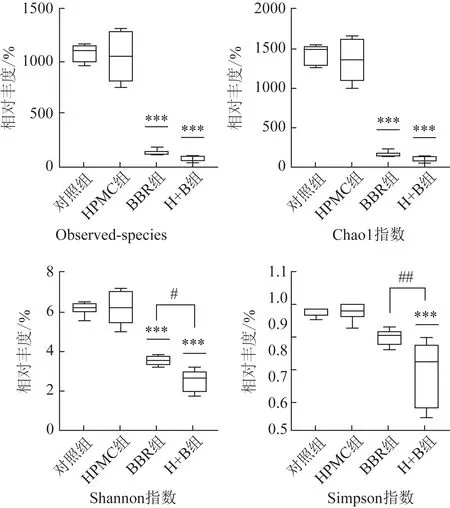
图3 各组小鼠肠道菌群OTUs序列Alpha多样性指数分析(n=5~6)
3.2.3 Beta 多样性 绘制NMDS 图分析对照组、HPMC 组、BBR 组及H+B 组的组间差异程度,进行Beta 多样性分析,不同组之间的分离程度越大,说明组间差异越明显。结果表明,HPMC 组与对照组距离较近;BBR 组、H+B 组与对照组距离均较远,差异较大;BBR 组与H+B 组距离较近,差异较小(图4)。BBR 组与H+B 组的菌群组成明显不同于其他2组,BBR干预有效发挥了菌群调节作用。

图4 各组小鼠肠道菌群OTUs序列Beta多样性分析(n=5~6)
3.2.4 肠道菌群在门水平上的组成 在门水平上,各组小鼠肠道菌群的组成中优势菌群包括拟杆菌门(Bacteroidetes)、厚壁菌门(Firmicutes)、放线菌门(Actinobacteria)、变形菌门(Proteobacteria)及疣微菌门(Verrucomicrobia)(图5A)。对照组拟杆菌门的相对丰度为57.11%,BBR 组为43.75%,H+B组为35.48%(图5B);对照组厚壁菌门的相对丰度为33.57%,BBR 组为24.22%,H+B 组为16.85%;对照组放线菌门的相对丰度为3.67%,BBR 组为0.01%(P<0.05),H+B 组为0.01%(P<0.05)。与之相反,BBR 干预可显著富集变形菌门及疣微菌门。对照组变形菌门的相对丰度为2.00%,BBR 组为11.99%(P<0.001),H+B组为14.65%(P<0.001);对照组疣微菌门的相对丰度为2.78%,BBR 组为19.63%(P<0.05),H+B 组为33.00%(P<0.001),H+B 组富集疣微菌门的能力优于BBR 组。在这几种优势菌门的变化中,疣微菌门的涨幅最为突出,推测这与属于疣微菌门的艾克曼菌属(Akkermansia)的相对丰度大幅提高有密切关联。
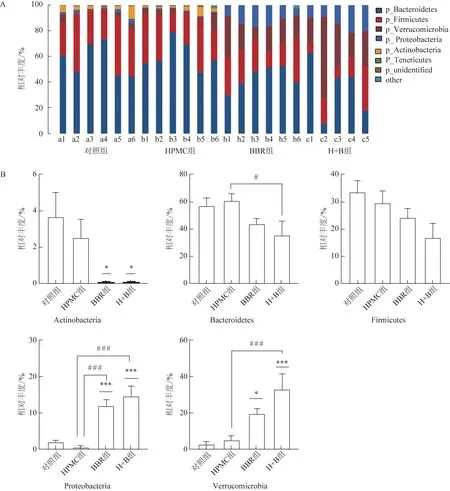
图5 各组小鼠肠道菌群在门水平的组成(n=5~6)
3.2.5 肠道菌群在属水平上的组成 在属水平上,对照组毛螺菌属(Lachnospiraceae)的相对丰度为1.219 0%,BBR组为0.003 0%(P<0.05),H+B组为0.0006%(P<0.05);对照组瘤胃菌属(Ruminococcaceae_UCG-014)相对丰度为1.430%,BBR 组为0.013%,H+B 组为0;对照组另支菌属(Alistipes)的相对丰度为1.319%,BBR 组为0.074%(P<0.05),H+B组为0;对照组其他unidentified 菌属的总相对丰度为70.92%,BBR 为34.73%(P<0.001),H+B 组为12.88%(P<0.001);与BBR 组相比,H+B 组显著降低(P<0.05)。对于以上各菌属,HPMC 组均未发生显著性变化,BBR 使其相对丰度产生不同程度的下降趋势,H+B 组与BBR 组变化趋势一致,整体来看,以上所提到的菌属除unidentified 菌属以外,其余菌属变化幅度均较小,不超过2%(图6)。

图6 各组小鼠肠道菌群在属水平的组成(n=5~6)
BBR 对部分菌属可产生富集作用,如布劳特氏菌属(Blautia)、艾克曼菌属和埃希氏菌-志贺菌属(Escherichia-Shigella)。对照组布劳特氏菌属的相对丰度为1.525%,BBR 为12.720%(P<0.001),H+B 组为8.717%(P<0.05)。布劳特氏菌属是产丁酸的主要菌种,属于短链脂肪酸产生菌,短链脂肪酸的产生可促进机体内肠道紧密连接蛋白的形成及肠道有益菌种的生长[31],可缓解因肠道渗透性增大引起的免疫炎症,起到良好的修复及保护肠道屏障功能的作用;对照组艾克曼菌属的相对丰度为2.776%,BBR 组为19.630%(P<0.05),H+B 组为33.000%(P<0.001),增强了BBR 富集艾克曼菌属的作用。作为一种明星菌属,艾克曼菌属属于疣微菌门,BBR 显著上调了疣微菌门和艾克曼菌属的丰度,这与先前的研究结果一致[32],艾克曼菌属是黏液定殖微生物中的主要菌属,与黏液层发挥对肠道组织的保护作用密切相关。有研究表明,克罗恩病及溃疡性结肠炎患者肠道内艾克曼菌属相对丰度下降,与疾病状态呈负相关[33],因此BBR 富集此菌可能是其修复黏液层厚度的关键原因[34]。对照组埃希氏菌-志贺菌属的相对丰度为0.002%,BBR 组为10.150%(P<0.001),H+B组为11.890%(P<0.001)。以上各菌属,HPMC 干预均未使菌属相对丰度差异有统计学意义。值得注意的是,对照组萨特氏菌属(Parasutterella)的相对丰度为0.961%,HPMC 组为0.116%(P<0.001),与对照组相比,BBR 组萨特氏菌属的相对丰度无明显变化,H+B 组则产生轻微下降趋势,萨特氏菌属的相对丰度为0.441%。副萨特氏菌属参与胆汁酸稳态代谢维持,其稳态失衡后或对肠道屏障带来不利影响[35],HPMC 组该菌相对丰度轻度下降,与BBR 合用后恢复正常,避免出现肠道微生态紊乱。
综合来看,无论是从Alpha 多样性的变化还是肠道菌群的组成变化来看,与HPMC 物理混合使用后,BBR 的菌群调节作用均得到正向促进,究其原因,很大程度上是由于HPMC 的高黏度,研究选用的HPMC F4M 在2% 的浓度下黏度即可达到4000 mPa·s,在本研究中,选取4%的HPMC。已有研究指出HPMC F4M 可使药物更好地黏附在口腔黏膜[20],推测4%的高黏性HPMC 与BBR 物理混合后,使BBR充分黏附于肠道黏膜,增加了BBR与定殖在肠道黏液层上的肠道菌群接触的概率和时间,从而直接促进了BBR 的菌群调节作用。同时,研究表明HPMC F4M 可延缓药物的释放[21],推测其可增加BBR 在肠道内的滞留,某种程度上也可促进其与肠道菌群的相互作用。另一方面,从BBR 吸收入血发挥作用的角度考虑,由于HPMC 是一种亲水性高分子,当其与溶解度较低的BBR 物理混合后,存在提高BBR 溶解度的可能,从而促进BBR 入血发挥药效。
4 结论
本研究对BBR与HPMC合用及BBR单独干预可能引起的小鼠肠道菌群及肠道微生态变化进行初步探究,分析得出,HPMC 单独使用未对小鼠肠道微生态产生明显影响,HPMC 与BBR 物理混合后起到对BBR自身功能的正向促进作用,可增强BBR的广谱抗菌能力,同时增强BBR 富集艾克曼菌属的作用,推测这与HPMC 与BBR 物理混合使用时增强其黏附于肠道黏膜及延缓BBR释放,从而促进BBR与肠道菌群充分接触以更好地发挥菌群调节作用密切关联。除此之外,还可考虑具有相同黏度,但甲氧基、羟丙基取代度不同的其他型号HPMC 如E4M、K4M 等对BBR 肠道微生态调控作用的影响的差异,从而探究黏性以外的作用机制。另外,果胶、卡波姆、海藻酸钠等可作为凝胶基质的药用辅料也存在影响BBR 肠道微生态调控效应的潜在可能,未来可开展相关实验对此进行探究,以从全新的角度考量制剂研究中药用辅料的选择标准。
