TET2 合并DNMT3A 突变及其他共存基因突变对急性髓系白血病患者预后的影响*
2022-11-27孔繁聪齐凌黄文锋喻敏周玉兰李菲
孔繁聪 齐凌 黄文锋 喻敏 周玉兰 李菲
急性髓系白血病(acute myeloid leukemia,AML)是造血干、祖细胞异常克隆性增殖导致的血液系统恶性肿瘤,临床表现及预后具有高度异质性。基因突变是导致其异质性的重要原因。超过70%的AML 患者中编码参与表观遗传学调控蛋白质的基因发生突变,这些基因突变影响造血细胞的自我更新和分化,促使其向髓系转化,在AML 发生发展中起重要作用[1]。DNA 甲基化是表观遗传学调控的重要组成部分,DNA甲基转移酶3A(DNMT3A)和甲基胞嘧啶双加氧酶2(TET2)是AML 中最常见的调控DNA 甲基化的基因。TET2 基因位于染色体4q24,编码的TET2 蛋白通过将5-甲基胞嘧啶(5-mC)转化为5-羟甲基胞嘧啶(5-hmC)参与DNA 去甲基化,下调DNA 甲基化水平[2]。TET2 发生功能缺失突变可促进启动子甲基化,从而导致造血干细胞异常增殖和分化,诱发髓系恶性肿瘤[3]。多种髓系肿瘤中均可检测到TET2 突变,常与不良预后有关。关于TET2 突变在AML 患者中的预后意义尚无共识,部分学者认为合并TET2 突变患者预后差[4],另有部分学者则认为TET2 突变不影响患者预后[5]。目前一致的观点为在合并CEBPA 双突变或NPM1 突变且FLT3 突变阴性的正常核型AML患者中,TET2 突变与不良预后相关,表现为无事件生存时间(event-free survival,EFS)、无病生存时间(disease-free survival,DFS)和总生存期(overall survival,OS)缩短[6-7],提示单独TET2 突变对AML 患者的预后价值有限,TET2 突变对预后的影响可能依赖与其共存的突变基因。DNMT3A 突变是TET2 突变常见的共存突变之一,该突变与高水平肿瘤负荷相关,是预后不良的分子标志[8]。然而,TET2 和DNMT3A 两种基因突变共存时对AML 患者预后的影响模式尚未明确。随着二代测序技术(NGS)在AML 领域的广泛应用,越来越多的突变基因被发现,这些突变基因与TET2 突变如何共同影响AML 患者预后值得进一步探索。本研究将对初治并行血液肿瘤相关突变基因外显子NGS 检测的AML 患者进行回顾性分析,探究TET2 合并DNMT3A 突变及其他共存基因突变对AML 患者预后的影响。
1 材料与方法
1.1 临床资料
回顾性分析2018 年1 月至2021 年9 月于南昌大学第一附属医院确诊的初治且行血液肿瘤相关突变基因外显子NGS 检测的512 例成人AML(非M3 型)患者的临床资料,纳入64 例合并TET2 突变患者为研究对象,其中TET2 合并DNMT3A 突变患者27 例,同时纳入同期46 例DNMT3A 单突变患者作为对照。男性50 例,女性60 例,中位年龄54(15~79)岁。年龄<60 岁患者74 例(67.3%),年龄≥60 岁患者36 例(32.7%)。原发AML 104 例(94.5%),继发AML 6 例(5.5%),其中5 例继发于骨髓增生异常综合征(myelodysplastic syndrome,MDS),1 例继发于慢性粒单核细胞白血病(chronic myelomonocytic leukemia,CMML)。根据中国急性髓系白血病诊疗指南[9]进行危险度分层:低危34 例(30.9%),中危32 例(29.1%),高危44 例(40.0%)。所有入组患者治疗前均经细胞形态学、免疫学、细胞遗传学、分子生物学确诊[10],另外抽取3 mL 骨髓(EDTA 抗凝管)送检血液肿瘤相关基因外显子NGS 检测。本研究检测的56 种血液系统肿瘤相关基因包括:ANKRD26、ASXL1、ASXL2、BCOR、BCORL1、CASP8、CBL、CCND1、CCDN2、CCDN3、CDC25C、CDKN1B、CEBPA、CSF3R、CUX1、DDX41、DNMT3A、ETV6、EZH2、FLT3、GATA1、GATA2、IDH1、IDH2、JAK1、JAK2、JAK3、KDM6A、KIT、KMT2A、KRAS、NF1、NPM1、NRAS、PHF6、PTEN、PTPN11、RAD21、RELN、RUNX1、SETBP1、SETD2、SF1、SF3B1、SMC1A、SMC3、SRP72、SRSF2、STAG2、TERT、TET2、TP53、U2AF1、WT1、ZBTB7A、ZRSR2。本研究经南昌大学第一附属医院伦理委员会批准且患者及家属均知情同意。
1.2 方法
1.2.1 血液肿瘤相关基因外显子NGS 检测方法 提取送检标本中基因组DNA,分析上述基因蛋白质编码区域的点突变和短片断插入/缺失突变。检测采用NGS 方法进行。使用Illumina 测序平台,靶向检测与血液肿瘤密切相关的56 个基因的外显子区,平均基因覆盖率>99%,平均检测深度为2 000×,测序原始数据采用Torrent Suitev 3.0 软件进行分析。
1.2.2 治疗方案 诱导化疗方案包括:标准剂量阿糖胞苷(Ara-C)联合伊达比星(IDA)或柔红霉素(DNR),IA 或DA 方案;去甲基化药物单药或联合预激方案(包括Ara-C、粒细胞集落刺激因子联合阿克拉霉素、依托泊苷或高三尖杉酯碱)。去甲基化药物包括阿扎胞苷或地西他滨。姑息治疗是以降低白细胞为目的,应用小剂量Ara-C 或羟基脲的最佳支持治疗。具体用药剂量参考中国成人急性髓系白血病(非急性早幼粒细胞白血病)诊疗指南(2017 年版)[9]。接受诱导治疗患者100 例(90.9%),其中IA/DA 方案77 例、去甲基化药物单药或联合预激方案21 例、其他方案2 例,姑息治疗10 例(9.1%)。
1.2.3 疗效评价 治疗间歇期(化疗间歇第14 天)、恢复期(化疗间歇第28 天)行骨髓穿刺评估化疗效果。疗效评估标准参照张之南《血液病诊断及疗效标准》[11]。包括:完全缓解(complete response,CR)、部分缓解(partial response,PR)、未缓解(non-response,NR)。
1.2.4 随访 随访方式以住院病历、门诊病历及电话为主。随访日期截至2021 年11 月或患者死亡日期,失访患者截至失访日期。中位随访时间19.9(16.4~23.4)个月,失访患者2 例(1.8%)。OS 定义为自诊断日期至患者死亡或随访截止日期。无复发生存(relapse-free survival,RFS)时间定义为患者达血液学CR 日期至患者死亡、首次复发或随访截止日期。
1.3 统计学分析
采用SPSS 25.0 软件进行统计学分析。以中位数(median,M)范围进行连续性变量描述,百分比(%)描述分类资料。计数资料组间比较采用χ2检验或Fisher 确切概率法。使用GraphPad Prism 8.0 绘制OS、RFS 生存曲线以及基因突变发生率柱状图。对于影响OS 的因素,行单因素和Cox 比例风险回归模型多因素分析。均采用双侧检验,以P<0.05 为差异具有统计学意义。
2 结果
2.1 TET2 突变患者的基因特征分析
512 例AML 患者中共检测到TET2 突变64 例,突变频率为12.5%(64/512),每例TET2 突变患者突变基因谱概况见图1(图中仅显示已知功能类基因,基因功能分类以文献[12]为参考)。基因突变数目为1、2、3 个及数目≥4 个的患者分别有1 例占1.6%(1/64)、6 例占9.4%(6/64)、8 例占12.5%(8/64)及49 例占76.5%(49/64),基因突变数目≥2 个的患者比例高达98.4(63/64),每例患者平均合并5.2 个突变基因。与TET2 共突变发生率最高的基因为NPM1 43.8%(28/64),其次为DNMT3A 42.2%(27/64)、FLT3-ITD/TKD 40.6%(26/64)、CEBPA 26.6%(17/64)、TTN 20.3%(13/64),K/NRAS、WT1 共突变率均为15.6%(10/64),KIT、TP53 共突变率分别为14.1%(9/64)和12.5%(8/64),IDH1/2、ASXL1 和MUC16A 共突变率均为10.9%(7/64),共突变发生率≥5%的基因见图2。
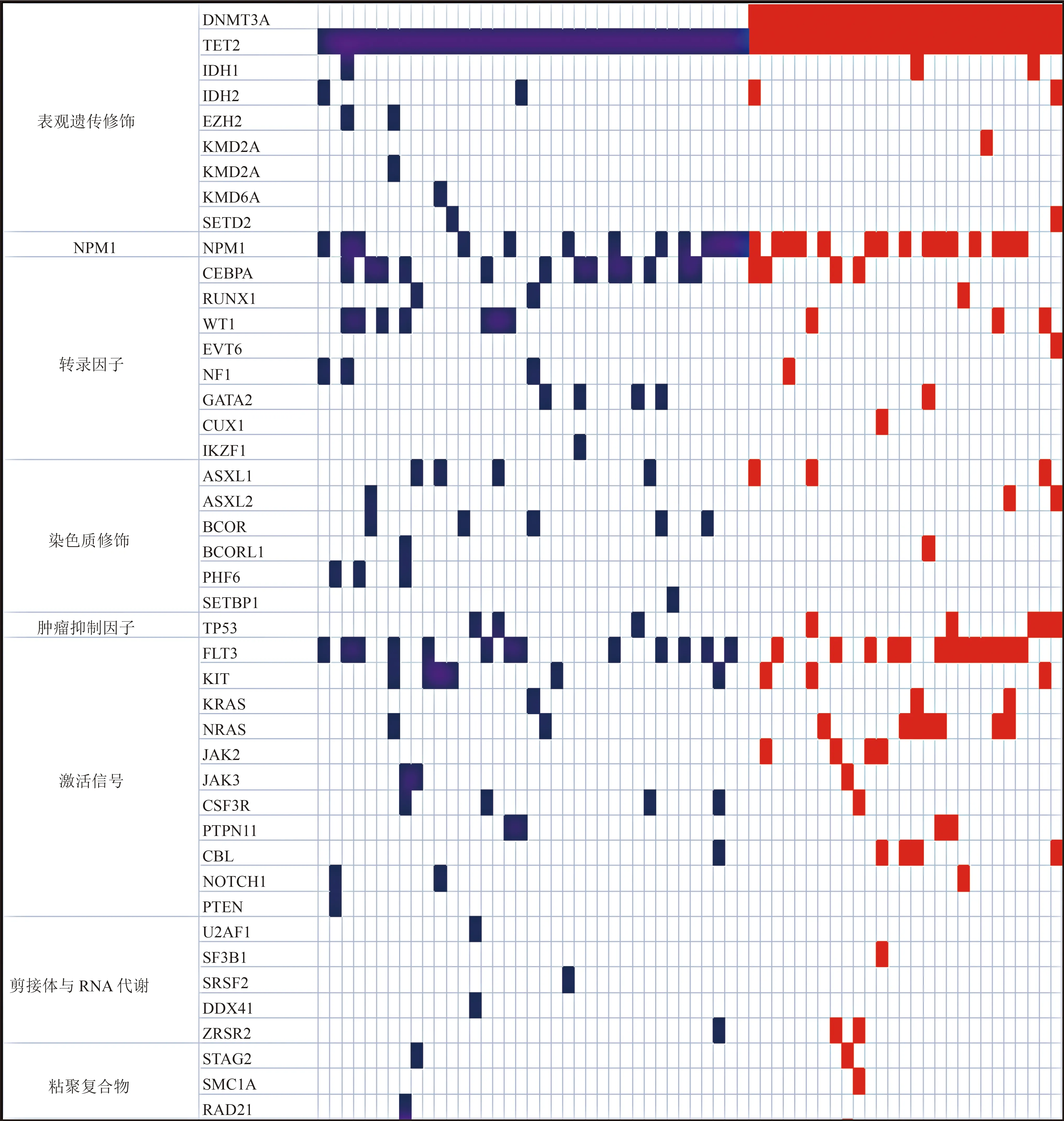
图1 64 例TET2 突变AML 患者突变基因谱概况
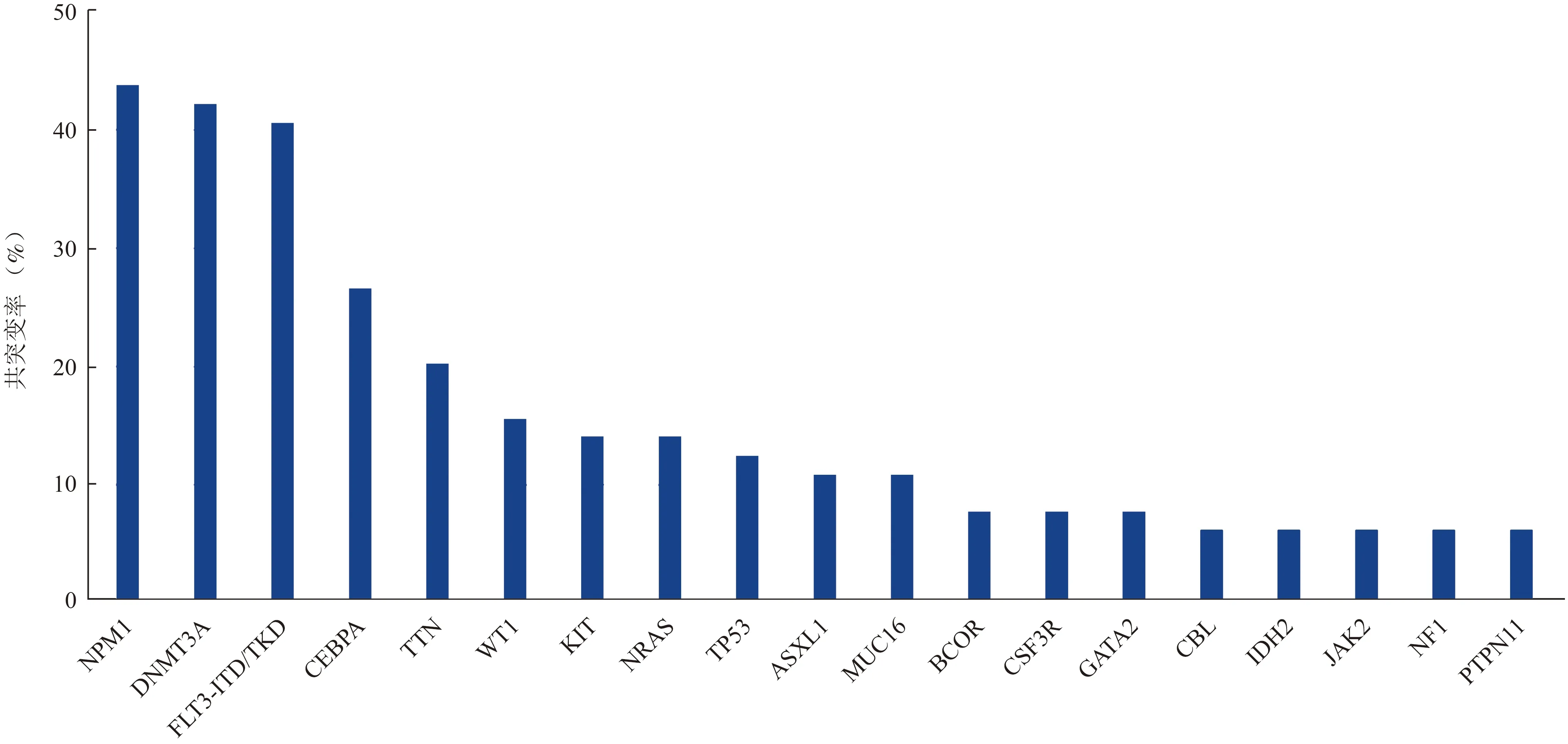
图2 TET2 共存突变基因发生率
2.2 TET2 及DNMT3A 突变对患者疗效及生存的影响
为排除不同治疗方案对预后的影响,本研究将接受IA/DA 方案诱导化疗且进行完整疗效评估、年龄≤65 岁的70 例原发AML 患者纳入疗效及生存分析。TET2 合并DNMT3A 突变患者初次诱导CR 率为46.2%,低于TET2 单突变患者的76.9%(P=0.077),与DNMT3A 单突变患者无显著性差异(P=0.952)。生存分析显示,TET2 合并DNMT3A 突变患者的中位总生存期(median overall survival,mOS)时间为9.5个月,2 年OS 率为21.4%(95%CI:0~46.7%),明显低于TET2 单突变患者[mOS:N/A,P=0.002;2 年OS率:60.6%(95%CI:38.8%~82.4%),P<0.05],而与DNMT3A 单突变患者的mOS 及2 年OS 率均无显著性差异[mOS:25.1 个月,P=0.414;2 年OS 率:50.5%(95%CI:31.7%~69.3%),P>0.05)],见图3A。TET2 合并DNMT3A 突变患者的中位RFS(median RFS,mRFS)为10.5 个月,2 年RFS 率为34.3%(95%CI:31.4%~65.5%);TET2 或DNMT3A 单突变患者的mRFS 均为N/A,2 年RFS 率分别为63.4%(95%CI :41.1%~85.7%)和59.4%(95%CI:22.2%~96.6%),三者之间mRFS 及2 年RFS 率差异均无统计学意义(均P>0.05,图3B)。

图3 患者的生存分析
2.3 TET2 与其他常见共存突变对患者疗效及OS 的影响
TET2 突变背景下,其他常见共存突变对疗效及OS 的影响见表1(受病例数限制,仅分析共存突变对OS 的影响)。伴K/NRAS 突变患者的CR 率为28.6%,明显低于无K/NRAS 突变患者的75.0%(P=0.030),而是否合并NPM1、FLT3-ITD、CEBPA 双等位基因突变(CEBPAdm)、TTN 或WT1 突变对CR 率均无显著性差异(均P>0.05)。在OS 方面,合并FLT3-ITD突变患者的OS 明显短于无FLT3-ITD 突变患者(P=0.030),而是否合并NPM1、CEBPAdm、TTN、K/NRAS 或WT1 突变对OS 差异均无统计学意义(均P>0.05)。
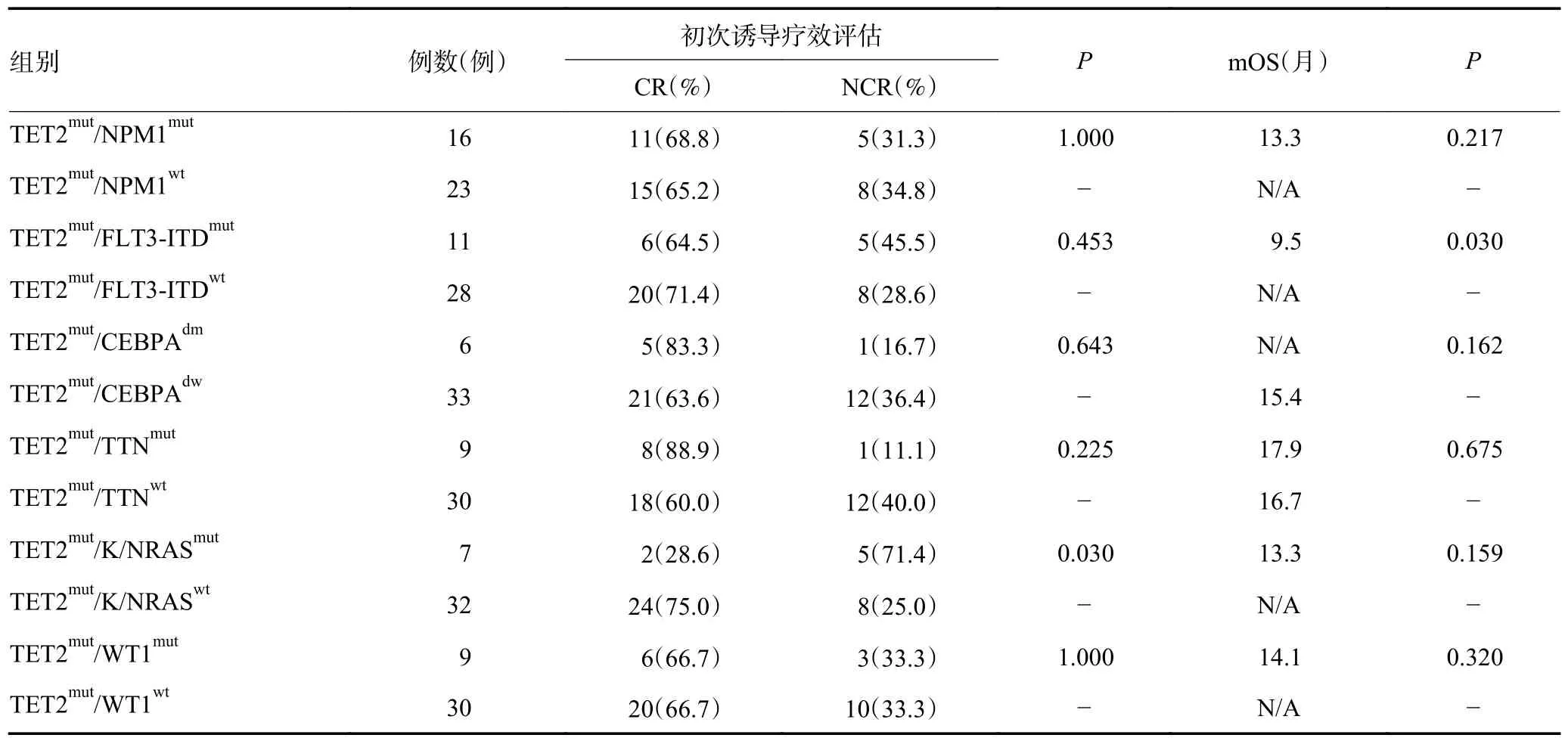
表1 TET2 与其他基因突变对AML 患者疗效及OS 的影响
2.4 影响TET2 突变AML 患者OS 的单因素及多因素分析
目前,已知初诊时年龄、外周血白细胞(white blood cell,WBC)计数、乳酸脱氢酶(lactic dehydrogenase,LDH)水平及某些基因突变对AML 患者预后有明确影响。前面已分析DNMT3A 和FLT3-ITD 突变对TET2 突变AML 患者的OS 有显著影响。为研究影响TET2 突变AML 患者OS 的独立预后影响因素,纳入DNMT3A、FLT3-ITD、年龄、WBC、LDH、骨髓原始细胞比例、预后分层等进行单因素分析,逐一筛选出有差异的影响因素。结果显示年龄≥60 岁、合并DNMT3A 突变、合并FLT3-ITD 突变、初次诱导疗效未达CR 是影响TET2 突变AML 患者OS 的预后不良因素(P<0.05),而其他因素对OS 无显著性影响(P>0.05,表2)。将单因素分析中有统计学意义者纳入Cox 比例风险回归模型进行多因素分析,结果表明年龄≥60 岁、合并FLT3-ITD 突变、初次诱导疗效未达CR 为影响TET2 突变AML 患者OS 的独立危险因素(表2)。
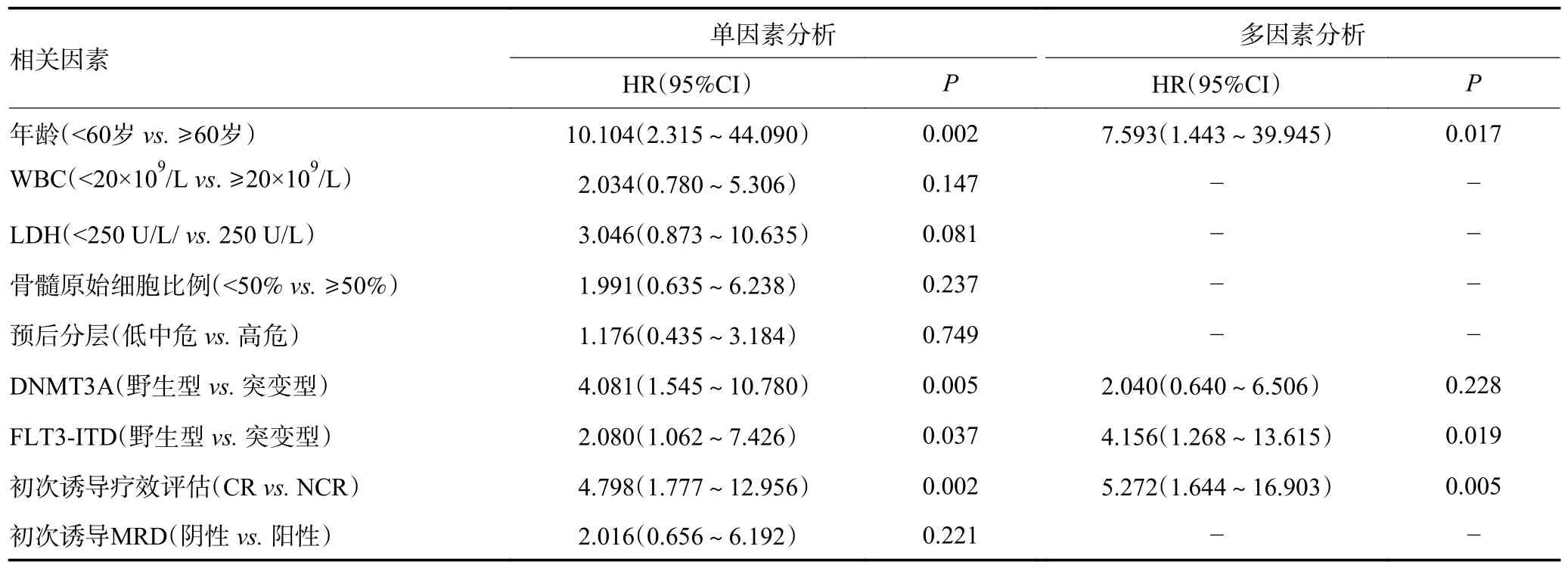
表2 影响TET2 突变AML 患者OS 的单因素及多因素分析
3 讨论
成人AML 是一类具有高度异质性的疾病,基于NGS 技术检测突变基因并进行危险度分层是实现精准治疗及改善预后的前提。随着NGS 技术在临床的广泛应用,越来越多的表观遗传调控相关基因突变被发现,这些突变基因通过改变染色质结构,促进癌基因异常激活和(或)抑癌基因失活,导致白血病细胞异常增殖和分化[13]。TET2 和DNMT3A 是常见的表观遗传调控基因,二者共同维持着DNA 甲基化与去甲基化的动态平衡。研究表明,TET2 和DNMT3A 突变均出现在白血病演变的前期[14],且TET2 或DNMT3A突变的造血干细胞均表现出相似的分化缺陷[15],这两种基因突变可能是白血病发生的始动突变,二者在白血病的发生过程中具有协同作用。DNMT3A 突变在AML 患者中预后不良[8],TET2 合并DNMT3A 突变是否影响AML 患者预后尚未明确。本研究结果发现TET2 伴DNMT3A 突变患者初次诱导CR 率(46.2%)低于TET2 单突变患者(76.9%),与DNMT3A 单突变患者(45.2%)无显著性差异。生存分析表明,TET2 合并DNMT3A 突变患者的mOS 及2 年OS 率显著低于TET2 单突变患者,而与DNMT3A 单突变患者无显著性差异,提示AML 患者在TET2 突变基础上合并DNMT3A 突变影响患者预后。刘洁等[16]研究发现,8 例TET2 合并DNMT3A 突变和33 例DNMT3A 单突变患者的初次诱导CR 率分别为83.3%和61.3%,高于本研究结果;Aslanyan 等[17]研究发现,与DNMT3A单突变者(18 例)比较,TET2 合并DNMT3A 突变者(9 例)的OS 有降低趋势(P=0.066)。上述研究与本研究结果有差异,可能与这两个研究中两组患者诱导化疗方案不同及样本量偏少有关;本研究中部分患者在完成诱导化疗后未接受后续治疗,亦会影响预后。上述研究表明,消除年龄及诱导方案等混杂因素后,TET2 突变在AML 患者中的预后可能更多地依赖与其相伴随的共存突变。
AML 患者常出现多个基因共存突变。Papaemmanuil 等[8]研究发现,86%AML 患者携带至少2 个突变基因。李剑雄等[18]应用高通量测序技术对93 例AML 患者行34 种血液肿瘤相关的基因检测发现53.8%的AML 患者携带至少2 个突变基因。本研究对512 例AML 患者进行基因突变检测,共检出64 例合并TET2 突变患者,突变频率为12.5%,与Chen 等[19]报道结果相符。其中,98.4% 的TET2 突变AML 患者携带≥2 个突变基因,半数以上(76.5%)携带≥4 个突变基因,平均每例患者合并5.2 个突变基因。本研究共存突变基因发生率高于上述文献报道,与本研究检测的突变基因种类更多及分析队列不同有关(针对TET2 突变患者),此外人种或生活环境的差异亦有影响。NPM1、DNMT3A、FLT3-ITD/TKD、CEBPA、TTN等突变为TET2 常见的共存突变,与相关研究结果[20-21]报道一致。除共存突变外,AML 患者中亦可检出互斥突变。也有研究发现,TET2 突变与IDH1 或IDH2为互斥突变,因为两者在AML 中的部分作用相互重叠[22]。本研究观察到TET2 突变与IDH1 或IDH2 突变共存,而未发现TET2 突变同时合并IDH1 和IDH2 突变,可能与IDH1 与IDH2 共突变率较低或TET2 突变背景下IDH1 与IDH2 突变相互排斥有关。上述研究结果表明,白血病的发生由多个突变基因综合作用的结果,契合白血病“二次打击”学说。
多种髓系肿瘤中存在TET2 突变,多与预后不良相关,而在CMML 患者中TET2 突变提示OS 较好[23]。在AML 患者中,TET2 单独突变对预后的影响尚存争议[5,24]。大部分研究认为其在细胞遗传学正常且ELN2017 危险度分层低危患者中提示不良预后,这部分患者EFS 明显缩短,而在ELN 中危患者中对预后无不良影响[7]。Liu 等[25]对8 项研究共2 552 例AML患者进行Meta 分析,结果提示TET2 突变对细胞遗传学正常和危险度分层为低危及中危的患者均有不良预后影响。提示大部分研究并未将年龄及诱导治疗方案进行分类分析,一定程度上影响了对结果的解读。尽管如此,这些结果仍然提示单个TET2 突变对AML的预后价值有限。基于此,有必要探索TET2 联合其他基因突变在AML 患者中的预后意义。
本研究在TET2 突变基础上联合其他突变基因对AML 患者进行预后分析,结果发现合并K/NRAS突变患者的CR 率明显低于无K/NRAS 突变患者。目前,K/NRAS 突变对AML 患者疗效及预后的影响尚未明确。Wang 等[26]对1 149 例初治AML 患者进行NGS 检测,NRAS 突变合并U2AF1 突变患者诱导缓解率低、预后差,证实了多基因联合突变在AML 预后评估中的价值。本研究未发现K/NRAS 突变对OS 具有不利影响,且因病例数少,未将KRAS 和NRAS 突变分开比较,可能是导致与文献报道结果差异的原因,后续可扩大样本量及延长随访时间进一步分析。FLT3/ITD 高频突变AML 患者CR 率低、OS 短、易复发[9],FLT3/ITD 突变合并其他基因突变亦提示预后不良。本研究发现TET2 突变合并FLT3-ITD 突变患者的OS 明显短于TET2 突变不合并FLT3-ITD 突变患者,但CR 率无显著性差异,可能与纳入的FLT3-ITD 突变患者中63.6%(7/11)为低频突变有关。
综上所述,TET2 突变常合并多种共存突变,共存突变影响患者疗效及预后。鉴于本研究纳入病例数及随访时间有限,结果存在一定局限性,未来可进行更大样本量的前瞻性研究进一步明确TET2 突变及其共存突变在AML 患者中的预后价值。
