帕金森病伴抑郁患者大脑复杂度的静息态脑功能成像研究
2022-11-27李海东王峻牛金亮
李海东,王峻,牛金亮
帕金森病(Parkinson's disease, PD)是常见于中老年人的神经系统退行性疾病[1],帕金森病伴抑郁(Parkinson's disease patients with depression,PD-Dep)是指确诊PD后出现的抑郁症状[2],是PD最常见的非运动症状之一,发生率高达40%[3],严重影响患者生活质量。基于血氧水平依赖(blood oxygenation level dependent, BOLD)的静息态功能磁共振成像(resting state functional magnetic resonance imaging, rs-fMRI)有高空间、时间分辨率、无创性研究脑高级功能等优势,广泛应用于神经精神类疾病。目前用于分析脑网络的功能连接模式及其自发活动的rs-fMRI 分析方法对BOLD 信号的研究仅限于使用传统的线性统计数据,缺乏对其非线性动态特性的分析及复杂度研究[4],与线性相比,非线性更接近客观事物本身性质,通过非线性方法研究能够反映动力学的不可预测性,反映某个系统可能发生的状态的概率分布,并且揭示了系统的复杂度,更适用于直接分析任意真实世界数据[5]。熵作为一种用于预测体系复杂程度非线性动力学参数[6],可以定量表征大脑区域中BOLD信号复杂度的动态变化。脑熵具有算法简单、抗干扰能力强、对突变信息有较强可识别性等优点[7-8],可以反映大脑处理传入或传出信息的能力[9],评估大脑状态和功能。通过对大脑的复杂性进行表征和分析,有助于更好地理解神经精神疾病导致大脑功能障碍的机制。既往研究显示PD-Dep患者存在大脑功能性活动及神经环路连接的异常[10-11],影响信息的传递及处理,可能存在大脑复杂度的改变。本研究拟采用排列熵(permutation entropy, PE)分析法对PD-Dep 患者、PD-NDep 患者与健康对照组(healthy controls, HCs)的fMRI 数据进行分析,研究PD-Dep 患者异常的脑区及其与临床评分的关系,进一步探索PD-Dep 的发病机制,以期为PD-Dep 的早期诊断和治疗提供影像学依据。
1 材料与方法
1.1 研究对象
本研究获山西医科大学第二医院伦理委员会审批[批准文号:(2021)YX第(156)号],所有受试者均签署知情同意书。前瞻性纳入2020 至2021 年在山西医科大学第二医院就诊的PD患者。纳入标准:(1)按中华医学会神经病学分会帕金森病及运动障碍学组的《中国帕金森病诊断标准(2016 版)》[12],纳入临床确诊的帕金森病;(2)患者临床资料详细真实,能完成相关量表的评测;(3)患者近2 个月未服用抗抑郁药物;(4)右利手;(5)无MRI扫描禁忌证。排除标准:(1)患者有严重认知功能障碍,患有焦虑、双相情感障碍、精神分裂症等其他精神类疾病或有精神疾病家族史;(2)患有严重躯体性疾病、脑外伤或器质性疾病;(3)酗酒、药物依赖、药物滥用。共纳入PD患者45例,男20例,女25例,年龄51~74(59.27±9.02)岁。
收集同期在本院就诊的23例年龄、性别、受教育程度匹配的健康受试者(男12 例,女11 例)作为HCs,纳入标准:(1)无中枢神经系统疾病史及头颅外伤史;(2)无严重其他系统疾病;(3)右利手。HCs 排除标准:(1)有焦虑、抑郁等精神类疾病或有精神疾病家族史的患者;(2)存在认知障碍的患者。
1.2 一般资料采集及临床量表评定
详细询问病史并记录患者一般资料及病程、首发症状等资料。PD 患者抑郁状态由受过培训的高年资精神科医师对患者进行测评。根据美国《精神疾病诊断与统计手册第4 版》(the Diagnostic and Statistical Manual of Mental Disorders, 4thedition, DSM-Ⅳ)抑郁发作诊断标准[13]将PD 患者分为PD-Dep 组22 例(男性11 例,女性11 例),PD-NDep组23 例(男性9 例,女性14 例)。抑郁评估采用汉密尔顿抑郁量表-24(24-item Hamilton Depression Scale, HAMD-24)。认知功能评估采用简易智能状态检查量表(Mini-Mental State Examination, MMSE)。
1.3 PE的计算
PE[14]是用于测量非平稳时间序列不规则性的新方法。PE 具有抗噪能力强、计算复杂度低、鲁棒性好等优点[14-15]。由于其可较好地识别突变信息[8],使用PE 分析BOLD 信号,可以发现BOLD 信号中的微小变化。其计算方法如下:
(1)对一维时间序列{X(i),1≤i≤N}进行相空间重构:

m为嵌入维数;λ为延迟时间;X(i)是重构矩阵的第i行分量。
(2)将X(i)的所有元素按升序排列:

当两个元素相等时,按j值从小到大排列。

为保证算法的意义和有效性,避免无法检测到时间序列的动态突变。本研究设置嵌入维数m=4,延迟时间λ=2进行计算分析。
1.4 MRI数据采集及预处理
1.4.1 MRI数据采集
使用美国GE SIGNA Pioneer 3.0 T 超导型MRI系统和8 通道相控阵头线圈。扫描前用软垫充分固定受试者头部,塞入耳塞减少噪声干扰,嘱其闭目、身体静止放松,不入睡。采集矢状面3D T1WI 高分辨结构MRI及静息态BOLD fMRI。矢状面3D T1WI高分辨结构MRI扫描参数:TR 6.7 ms,TE 2.9 ms,翻转角12°,带宽31.25 kHz,视野256 mm×256 mm,矩阵256×256,体素大小1 mm×1 mm×1 mm,层厚1.0 mm,零层间隔采集,扫描时间为4 min 41 s。静息态BOLD fMRI 扫描参数:TR 2000 ms,TE 30 ms,翻转角90°,带宽250 kHz,视野224 mm×224 mm,矩阵64×64,体素大小3.5mm×3.5mm×3.5mm,层厚3.5 mm,层间隔0.7 mm,共采集140个时相,扫描时间为280 s。
1.4.2 图像预处理
实验基于DPARSF V2.3(Data Processing Assistant for Resting-State fMRI)[16]工具,并在Matlab2014b上对图像进行预处理。针对每例数据的预处理流程为:首先去除被试所采集数据的前10 个时间点;然后将每个被试剩余的130幅图像进行时间层校正、头动校正;最后对头动校正后的图像使用平面回波成像(echo planar imaging, EPI)模板进行空间标准化。
1.5 fMRI数据PE计算
采用自动解剖标记(automated anatomical atlas,AAL)模板[17]将大脑分割为90 个感兴趣区(regions of interest, ROI),其中左右半脑各45个,提取90个脑区的时间序列。每个被试可获得一个90(脑区)×130(时间序列)的矩阵。根据各脑区的时间序列计算其PE。
1.6 统计学分析
符合正态分布的计量资料以xˉ±s 表示,非正态分布数据用M(Q1,Q3)表示。三组被试年龄、受教育年限及量表评分比较采用单因素方差分析及Kruskal-WallisH检验,性别等计数资料采用χ2检验。每个受试者的ROI的平均PE值采用单因素方差分析检验三组被试(HCs组、PD-Dep组和PD-NDep组)之间的差异,LSD-t检验两两比较组内有差异的脑区(P<0.05,cluster size>20)。对PD-Dep 患者组间显著差异脑区PE 值与量表评分进行Pearson 相关性分析。所有统计学分析均采用SPSS 25统计软件进行。
2 结果
2.1 三组人口统计学及临床资料的比较结果
纳入分析三组性别、年龄、受教育年限、MMSE 评分差异无统计学意义(P>0.05)。PD-Dep 组较另两组HAMD评分显著增高(P<0.01),具体内容见表1。
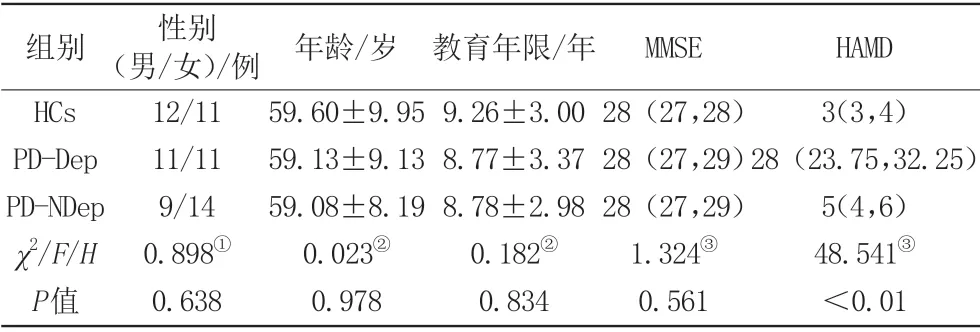
表1 人口统计学及临床资料评估结果Tab.1 Demographic and physiologic data of studied cohort
2.2 三组PE差异分析
HCs 组、PD-Dep 组及PD-NDep 组平均PE 值有3 个脑区存在明显差异(P<0.01,表2,图1),包括:右侧颞下回、左侧前扣带回、右侧扣带回中部。组间分析结果如图2 所示,PD-Dep 组及PD-NDep 组右侧颞下回PE 值较HCs 组增高(P=0.022,P=0.004),PD-Dep 组与PD-NDep 组PE 值差异无统计学意义(P=0.515)。PD-Dep 组及PD-NDep 组左侧前扣带回PE 值较HCs 组减低(P=0.007,P<0.01),PD-Dep 组与PD-NDep 组PE值差异无统计学意义(P=0.114)。PD-Dep组及HCs组右侧扣带回中部PE 值较PD-NDep 组增高(P=0.007,P=0.019),HCs 组与PD-Dep 组PE 值差异无统计学意义(P=0.738)。

表2 帕金森病伴/不伴抑郁患者组及健康对照组显著差异的脑区信息Tab.2 Brain regions with differences between HCs,PD-Dep and PD-NDep
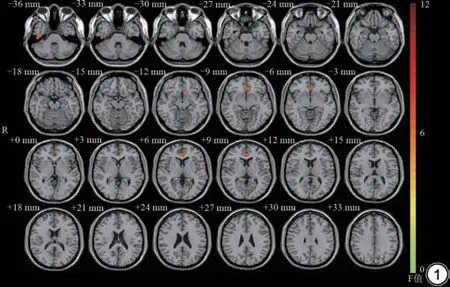
图1 帕金森病伴/不伴抑郁患者组及健康对照组排列熵差异脑区主要分布于右侧颞下回、左侧前扣带回及右侧扣带回中部。Fig. 1 PE value showed significant differences in the right inferior temporal gyrus, left anterior cingulate and right median cingulate gyrus among the HCs,PD-Dep and PD-NDep.


表3 三组显著差异的脑区排列熵值(xˉ±s)Tab.3 Comparison of PE value between 3 groups(xˉ±s)
2.3 相关性分析结果
将得到的PD-Dep 组差异脑区PE 与HAMD 评分做相关分析,结果如图3 所示,右侧扣带回中部PE 值与HAMD呈正相关(P<0.01,r=0.790)。
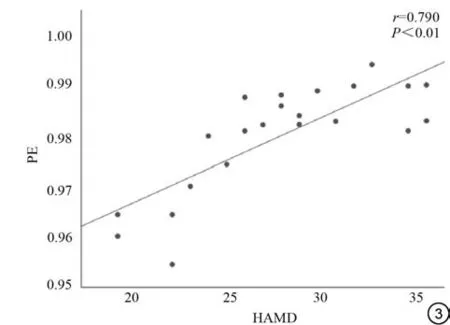
图3 PD-Dep 患者PE 值与HAMD 评分相关脑区。右侧扣带回中部PE值与HAMD 呈正相关(P<0.01,r=0.790)。PD-Dep:帕金森病伴抑郁患者;PE:排列熵;HAMD:汉密尔顿抑郁量表。Fig. 3 Relevant brain regions for PE value and HAMD scale scores in PD-Dep patients. The PE values positively correlate with HAMD scores in the right median cingulate gyrus (P<0.01, r=0.790). PD-Dep: Parkinson's disease patients with depression; PE: Permutation Entropy; HAMD:Hamilton Depression Scale.
3 讨论
本研究通过基于静息态脑功能磁共振成像的PE算法对HCs、PD-Dep、PD-NDep患者的大脑复杂度进行分析,结果显示三组被试的PE值在右侧颞下回、左侧前扣带回、右侧扣带回中部脑区存在明显差异,并且PD-Dep 患者右侧扣带回中部PE 值与HAMD 评分呈正相关。本研究创新性地采用目前国内较少应用的PE算法分析PD-Dep 患者的fMRI 数据反映大脑复杂性的改变,为探索PD-Dep 患者大脑神经活动的变化提供了新的方法,对于PD 伴发抑郁的临床辅助诊断和及时干预也有一定的价值。
3.1 脑熵分析法的研究现状
目前fMRI是神经影像学研究发现大脑功能的异常的主要方法,脑熵作为一种非线性信号处理技术是探测大脑fMRI 动力学复杂度的新方法[18]。大脑活动的熵等同于根据香农信息理论[6]的信息,可以反映大脑活动的变化。但既往研究中采用的传统香农熵仍存在如下缺点:未对数据中存在的任何时间结构进行解释,存在于时间动态中的信息可能遗漏;必须事先指定概率分布函数;无法描述系统的混沌状态[19]。鉴于上述原因本研究采用稳健、快速、简单且可量化动态系统的组织属性和时间结构的PE方法作为衡量大脑复杂度的指标。PE 是由Bandt 等[14]提出的通过统计某些排列模式的出现或缺失概率来衡量信号复杂度的算法。相比其他常用的熵度量,如近似熵[20](approximate entropy, ApEn)和样本熵[21](sample entropy, SampEn),PE 具有简单性、计算复杂度低、无需进一步的模型假设及在动态噪声存在下的鲁棒性等优势。ApEn 和SampEn 都仅基于幅度,而忽略了时间序列的顺序。作为基于时间序列自然序数模式的符号动态度量,PE 只考虑样本的等级,而不考虑它们的指标。目前,PE 已用于人类失神癫痫的EEG 信号研究[8]、典型失神发作[22]等多种疾病,多种PE 算法还应用于双相情感障碍[23]、重度抑郁症[24]、主观认知下降[4]等疾病的fMRI研究,但目前较少有研究将其应用于PD 及PD-Dep 的相关研究。PE 作为研究大脑复杂性异常的有效手段,将其应用于PD 及PD-Dep 的研究为未来的神经影像学发展提供了新思路。此外,既往研究中PE 分析广泛应用于EEG 数据,但却较少应用于fMRI 数据[25]。fMRI 较EEG 有较高的空间分辨率,本研究采用PE 分析法可以定位发生时间动态或局部信息变化的大脑区域[26],因此将PE 应用于fMRI数据是可行且具有一定意义的。本研究将PE 的复杂度分析方法应用于高空间分辨率的HCs、PD-NDep、PD-Dep 患者的fMRI 数据的分析中,并发现脑区复杂度上的变化,通过PE 反映大脑处理传入或传出信息的能力有助于PD伴抑郁的诊断和治疗。
3.2 PD-Dep患者异常脑区PE改变的可能机制
本研究中PD 患者右侧颞下回PE 较HCs 升高,提示被试组患者右侧颞下回在静息状态下的信息处理容量增加[27],处理信息的能力增强,时间信号的复杂性及变异性升高,意味着该脑区大脑活动的混乱程度比其他脑区增加,这可能是由PD 导致的组织内部之间或与外部的联系存在异常造成的[28]。颞下回参与高级认知功能,如视觉辨认、语言理解、决策及情绪调节等,是默认网络的一个重要功能区域[29-30]。颞叶在情绪调节中发挥关键作用,与杏仁核、眶额叶、前额叶、基底前脑和下丘脑等与情绪相关的关键结构密切相关,既往文献报道颞叶与严重的抑郁和焦虑症以及各种疾病导致的抑郁和焦虑症状有关[31-32],同时PD-Dep患者颞叶的自发活动及功能连接存在异常[33-34]。PD 患者颞叶复杂度的改变反映了其神经活动的异常,情绪调节能力受损,导致PD患者出现抑郁症状,因此本研究结果支持以往的研究结果。既往研究还发现PD 患者脑干中的中缝核和蓝斑,在疾病的早期阶段就已受到损伤,部分大脑皮层受损晚于脑干[35]。而主要来源于中缝核、蓝斑、黑质和腹侧被盖区的单胺类神经递质缺乏及受体敏感性异常是原发性抑郁症的重要发病机制[36]。PD 患者与原发性抑郁症患者都存在中缝核及蓝斑的异常,二者间是否有共同的病理生理机制仍有待进一步研究。本研究中颞下回的PE 值改变,为PD 患者抑郁的病理机制提供了新的理论支持。颞下回的复杂度异常可能与PD伴随的认知、情绪障碍等抑郁症状有关,颞下回局部神经元活动异常可能导致PD患者出现抑郁症状。
本研究中PD-Dep 组右侧扣带回中部的PE 值较PD-NDep 组增高,左侧前扣带回PE 值较HCs 组减低。扣带回负责注意力和情感信息的整合,与认知控制和情感行为相关[37-38],作为构成边缘系统的重要组成部分其神经元损伤会导致PD 神经精神症状的出现[39-40]。扣带回PE 的改变可能是由于PD 神经退行性改变所导致相应脑区损伤,引起大脑处理情感信息的能力改变产生抑郁症状,抑郁症状产生后相关脑区静息态脑活动增强以维持患者的注意力及情绪管理功能,由此我们推测这些脑区的复杂度改变可能是一种代偿机制[28],其复杂度改变可能对应神经元网络受损的不同阶段。前扣带回损伤会影响神经系统条件反射的能力,使情绪控制能力下降,引起PD的抑郁症状,其PE 值减低提示PD-Dep 患者脑区活动的复杂性降低。在本研究中左侧前扣带回熵值的降低可能意味着损伤已超过了可代偿范围,系统平衡无法继续维持,相应损伤脑区信息处理能力减弱,同时导致大脑处理各种传入和传出信息的灵活性较低,继而出现抑郁症状。Wang 等[25]的研究也证实了神经元损伤会引起大脑复杂度的减低。在本研究中还发现PD-Dep 组PE 值较PD-NDep 组升高,表明在可代偿的范围内,右侧扣带回中部熵值增高可能是损伤后大脑功能的维持,通过代偿提高信息处理的能力,增加静息态脑活动,但目前仍需进一步的研究来探索其相关机制。与此同时,右侧扣带回中部与HAMD 评分之间的相关性分析表明随着大脑活动复杂性的增加,症状严重程度增加。值得注意的是,有研究发现原发性抑郁症患者前扣带回ALFF较HCs升高[41],表明局部脑区神经元自发性活动亢进,研究得出的结论不一致的原因可能是本研究中PD-Dep 患者年龄较大,后续研究中应进一步分析前扣带回PE 值减低是由于PD 神经元退行性改变引起局部脑区损伤所导致,还是由于衰老引起的复杂度减低的正常后果。由此可推测前扣带回异常导致PD患者产生抑郁症状的机制与原发性抑郁症患者存在差异。多项研究[34,42]发现由于抑郁症状的存在,扣带回存在自发活动及连接功能的异常,由于该区域功能紊乱,患者相关脑区活动复杂度发生改变,提示扣带回的功能状态可作为评估PD伴抑郁严重程度的重要生物标记。
3.3 局限性
本研究尚存在一些局限:(1)本研究是横断面研究,样本量较小;(2)抑郁症是一种异质性疾病,PD-Dep 的神经机制可能与一般人群的抑郁症不同;(3)缺乏原发性抑郁症组,PD-Dep 是否与原发性抑郁症具有共同的病理生理学机制仍有待进一步探索。后续研究需要进行纵向随访观察,并通过增加样本量进一步提高我们对PD 患者抑郁的神经机制的理解。在未来使用多模态MRI 技术的大规模研究并结合不同的分区方案多种算法分析,进一步探索PD-Dep的发病机制。
综上所述,PD-Dep 的病理生理起源非常复杂,涉及多个神经递质系统和广泛的大脑区域。采用PE分析HCs、PD-NDep组及PD-Dep组的fMRI数据的复杂度得到局部差异脑区,一定程度上反映了其病理机制的复杂性,表明PE 可以作为研究PD 伴抑郁患者大脑复杂度的一种新方法,同时为疾病辅助诊断、病情评估及治疗提供参考。
作者利益冲突声明:全部作者均声明无利益冲突。
