合成扩散加权成像评估脑胶质瘤分级的应用研究
2022-11-27吕瑞瑞党佩葛鑫李敏黄雪莹王明磊杨旭宏雍鹏王晓东
吕瑞瑞,党佩,葛鑫,李敏,黄雪莹,王明磊,杨旭宏,雍鹏,王晓东*
脑胶质瘤是颅内最常见的原发肿瘤,2021年新版WHO中枢神经系统肿瘤分类保留了2016版关于脑胶质瘤分级,将脑胶质瘤分为低级别胶质瘤(low-grade glioms, LGG)和高级别胶质瘤(high-grade glioms,HGG)两类[1]。不同级别胶质瘤治疗手段及预后有较大差异,因此术前胶质瘤分级具有重要临床意义[2-3]。扩散加权成像(diffusion weighted imaging, DWI)通过无创检查反映脑肿瘤在微观环境中水分子的扩散性[4],已广泛应用于脑胶质瘤分级研究[5],但常规DWI单次扫描只能获得单个b值(通常b=1000 s/mm2)DWI 图像。胶质瘤异质性高,单纯利用常规DWI 单个b 值成像已不能满足其影像表现多样化的分级研究,因而以往多项研究采用常规DWI联合其他技术(如动脉自旋标记、酰胺质子转移成像等)进行分级研究[6-7]。合成DWI(synthetic DWI, sDWI)与常规DWI不同的是,在不增加扫描时间的同时通过一次扫描获得多个b 值的DWI 图像[8]。目前,大多研究集中于高b 值和标准b 值对分级的效能比较,尚未发现sDWI技术用于脑胶质瘤分级研究的报道,最近有研究报道了sDWI在乳腺癌、前列腺癌、宫颈癌和胰腺癌等方面的临床应用价值[8-11]。本研究通过一组经病理证实为胶质瘤的完整的sDWI 资料,分析探讨其在胶质瘤分级中的应用价值,以期发现一种更高效的胶质瘤术前分级的方法。
1 材料与方法
1.1 一般资料
本回顾性研究经过宁夏医科大学总医院科研伦理委员会批准(批准文号:KYLL-2021-466),免除受试者知情同意。本研究收集自2020年7月至2021年10 月在宁夏医科大学总医院连续纳入诊断为脑胶质瘤的患者的资料。纳入标准:(1)检查前未接受过穿刺、手术或任何相关治疗的原发脑胶质瘤患者;(2)术前一周内接受完整的常规MRI [包括基于复合灵敏度编码的DWI(multiplexed sensitivity-encoding DWI,MUSE-DWI)]检查者;(3)经术后病理证实者。排除标准:(1)临床或病理资料不完善者;(2)图像因伪影等原因不能勾画感兴趣区(region of interest, ROI)者。
1.2 仪器与方法
采用美国GE Signa Architect 3.0 T MRI 系统和48通道扩容神经线圈。患者取仰卧位,行常规MRI(包括T1WI、T2WI、T2 FLAIR和MUSE-DWI等序列)及MRI增强扫描,增强扫描采用专用高压注射器,肘静脉团注对比剂钆双胺(GE 药业,美国),剂量为0.2 mL/kg,速率为3.0 mL/s。所示序列及具体扫描参数如下:T2WI序列,TR 4611 ms,TE 103.1 ms,FOV 24 cm×24 cm,层 数20,层 厚5 mm,层 间 隔1 mm;T1WI 序 列,TR 2461.6 ms,TE 111 ms;T2 FLAIR 序列,TR 8500 m,TE 90.1 ms;T1WI增强序列,TR 2531 ms,TE 36.9 ms;MUSE-DWI 序列,TR 3921 ms,TE 78.1 ms,扩散敏感系数(b)值取0和1000 s/mm2。
1.3 图像分析及参数测量
采用GE Signa Architect 3.0 T MRI系统对sDWI数据进行测量和分析。由2名分别在神经影像诊断方面具有3年及5年诊断经验的住院医师及主治医师分析图像,且对患者病理结果、临床资料和其他影像学检查结果不知情。分析步骤:(1)选择MUSE-DWI序列,进入主机系统sDWI 界面,由已扫描的MUSE-DWI 序列(b值为0 和1000 s/mm2)通过后续计算合成b 值范围为0~2500 s/mm2的DWI 图像即sDWI;(2)结合T2 FLAIR及增强T1WI(T1WI+C)图像避开病灶出血、坏死、囊变区,选取相对容易识别的DWI高信号区域画取ROI测量病灶的信号强度(ROI 范围为0.3~0.5 cm2);(3)根据以上原则选择特定b 值三处不同ROI 测量病灶的信号强度(图1),取其平均值。2 周后2 名观察者再次用同样的方法对这些数据进行重复测量。

图1 感兴趣区(ROI)示意图。1A:T2 FLAIR;1B、1D:DWI;1C:T1WI+C。图1A~1B 为低级别胶质瘤,参考T2 FLAIR 肿瘤实质高信号区域(箭)勾画ROI;图1C~1D 为高级别胶质瘤,T1WI+C 左侧顶叶异常强化,参考T1WI+C 肿瘤实质强化部分(箭)勾画ROI,避开囊变、坏死区域。注:ROI:感兴趣区;FLAIR:液体衰减反转恢复;DWI:扩散加权成像;T1WI+C:增强T1WI。Fig.1 Schematic diagram of ROI.1A:T2 FLAIR;1B,1D:DWI;1C:T1WI+C.1A-1B are low-grade glioma,with no enhancement in enhanced scanning,the ROI is delineated by referring to the hyperintense area (arrow) of T2 FLAIR tumor parenchyma; 1C-1D are high-grade glioma, with abnormal enhancement in the left parietal lobe in enhanced scanning, the ROI is delineated by referring to the enhancement part (arrow) of T1WI+C tumor parenchyma, avoiding the cystic and necrotic area.Note:ROI:region of interest;FLAIR:fluid attenuated inversion recovery;DWI:diffusion weighted imaging.
1.4 统计学分析
采用SPSS 26.0(Version 26.0, Chicago, IL)和MedCalc 20.0进行统计学分析。采用组内相关系数(intraclass correlation coefficient, ICC)评价两名医师参数测量的一致性,ICC>0.75 为一致性良好,0.65~0.75 为一致性一般,ICC<0.65 为一致性差。符合正态分布及方差齐性的计量资料两组间比较采用独立样本t检验,不符合正态分布者采用Mann-WhitneyU检验比较两组间信号强度差异,结果以P<0.05 为差异具有统计学意义,将P<0.05 的变量纳入二元Logisitic 回归分析中筛选鉴别高低级别胶质瘤的独立变量。最后采用MedCalc 20.0软件对数据进行分析,计算受试者工作特征(receiver operating characteristic, ROC)曲线下面积(area under the curve, AUC),确定胶质瘤分级的最佳临界值、敏感度和特异度,评估sDWI 不同b 值对应信号强度值对高低级别胶质瘤的诊断效能。结果均以P<0.05为差异具有统计学意义。
2 结果
2.1 临床资料
最终纳入72例具有完整病理结果的胶质瘤患者病例,男39 例,女33 例,年龄15~78(43±15)岁,其中低级别胶质瘤30 例(男14 例,女性16 例),高级别胶质瘤42例(男性25例,女性17例)。
2.2 sDWI鉴别高低级别胶质瘤诊断效能
sDWI不同b值高低级别胶质瘤信号强度比较显示:b 值分别为500、800、1000、1200、1500、1800、2000、2200、2500 s/mm2时对应的信号强度在高低级别胶质瘤组间差异均具有统计学意义(P<0.001)(表1)。二元Logisitic回归分析显示b=2500 s/mm2的DWI 图像对应的信号强度是预测高低级别胶质瘤的独立变量。ROC曲线分析显示b值为2500 s/mm2时诊断准确率最高,AUC为0.935,相应的敏感度为98%、特异度为87%。其余b 值为2200、2000、1800、1500、1200、1000、800、500 s/mm2时AUC分别为0.929、0.925、0.919、0.915、0.909、0.905、0.859、0.757(表2)。sDWI 图像随着b值升高,病灶与周围组织对比度越高,清晰显示瘤体周围囊变、坏死(图2)。

图2 高低级别胶质瘤合成扩散加权成像(sDWI)表现。2A:女,58岁,低级别胶质瘤(WHO 2级),增强T1WI(T1WI+C)显示左侧颞叶异常信号灶,病灶中心局部强化,sDWI 不同b 值DWI 图像(默认窗值)显示:b 值越高,瘤体显示越清楚,图像质量并未随着b 值升高而降低。2B:男,51 岁,胶质母细胞瘤(WHO 4 级),T1WI+C 显示右侧顶叶环状强化灶,sDWI不同b 值DWI图像(默认窗值)显示:低b 值(b<1500 s/mm2)时瘤体与周围坏死、囊变区分界不清,较高b 值时病变组织与周围组织之间的对比度越大,病变显示更显著。Fig. 2 The synthetic DWI (sDWI) imaging of low and high grade gliomas. 2A: Female, 58 years old, low-grade glioma (WHO grade 2),enhancement showed abnormal signal focus in the left temporal lobe and local enhancement in the center of the lesion. DWI images with different b values of sDWI (default window value)showed that when the b value was higher,the more clearly the tumor was displayed,the image quality did not decrease with the increase of b value.2B:Male,51 years old, high-grade glioma (WHO grade 4), enhancement showed annular enhancement focus of the right parietal lobe. DWI images with different b values of sDWI (default window value) showed that the tumor and surrounding necrosis and cystic demarcation were not clearly defined at low b value (b<1500 s/mm2).When b value was higher,the greater the contrast between the lesion tissue and the surrounding tissue,the more significant the lesion.
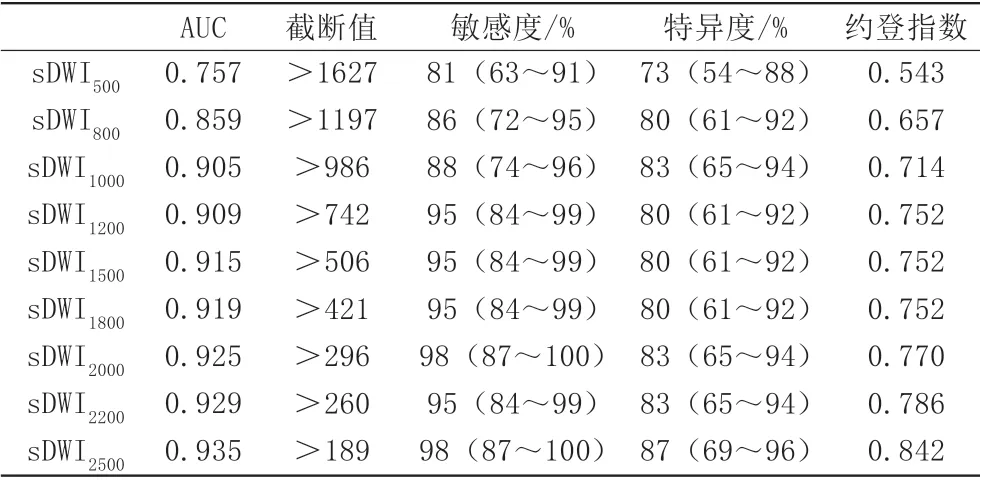
表2 合成DWI(sDWI)不同b值高低级别胶质瘤诊断效能Tab.2 Diagnostic efficacy of synthetic DWI with different b values for high and low grade gliomas
3 讨论
本研究利用sDWI技术,比较不同b值DWI图像信号强度对鉴别高低级别胶质瘤的价值,结果显示:b值为500、800、1000、1200、1500、1800、2000、2200、2500 s/mm2时差异均有统计学意义(P<0.001),且在同一b 值下,高级别组的DWI 信号强度高于低级别组。logistic回归分析显示b 值为2500 s/mm2是鉴别胶质瘤分级的独立显著预测因子,其AUC 为0.935,sDWI 对评估胶质瘤分级具有潜在的临床应用价值,以高b 值DWI图像鉴别效能显著,可为胶质瘤术前分级提供影像学依据。
3.1 sDWI技术原理
DWI 通过无创检查反映脑肿瘤内细微结构,对细胞密度、大小、细胞膜通透性和细胞外空间扭曲度敏感[12],使脑肿瘤的诊断从以往的形态学上升到微观的、形态与微观并重的研究[4]。sDWI技术是一种从低b值DWI图像获得高b值图像的方法,从至少两个不同的低b值获得的DWI图像中计算出高b值(或任何b值)图像,避免了直接使用高b值进行测量的缺点,如低信噪比和图像失真,还可以使用公式:S(b)=S(0)e-b×ADC在逐体素的基础上计算组织的表观扩散系数(apparent diffusion coefficient, ADC)。使用sDWI进行疾病检测的主要依据是使病变组织和背景之间的图像对比度最大化,对病变显示更加显著,其主要取决于固有组织扩散率、T2弛豫时间以及b值大小的选择[13]。
3.2 sDWI技术优势
本研究与既往研究不同的是,Al-Agha 等[14]通过分别扫描两个特定b值(1000和3000 s/mm2)评估胶质瘤分级,而我们利用sDWI技术在不增加扫描时间的同时通过一次扫描获得0~2500 s/mm2范围内的任意b值来评估脑胶质瘤分级,克服了传统DWI 扫描多个b 值增加扫描时间这一缺点,同时在后处理过程中,保证每个b 值对应的ROI 位置和大小基本一致,很大程度减少了测量误差。其次,sDWI 技术在不增加采集时间的情况下提高了病变可见性,对病变显示更加显著的同时避免了高b 值下DWI 图像的缺点,即涡流失真[9]。
3.3 sDWI不同b 值信号强度对高低级别胶质瘤的诊断效能
Al-Agha 等[14]研究发现,高低级别胶质瘤在高b值(b=3000 s/mm2)时ADC 值差异更明显。也有文献显示,高b 值(b=4000 s/mm2)对胶质瘤的分级诊断效能高于标准b值(b=1000 s/mm2)[15]。这与本研究结果具有一致性,在sDWI b 值范围为0~2500 s/mm2时,随着b 值升高,胶质瘤分级的诊断效能越高,在b=2500 s/mm2时高低级别胶质瘤信号强度差异最显著。可能与高b 值更能反映胶质瘤水分子流动有关,低b 值DWI 图像信号主要反映高流动自由水,而高b 值DWI自由水信号大部分被衰减,图像信号主要反映低流动结合水[16-17]。既往研究表明,b值>1000 s/mm2时,肿瘤组织中的DWI信号衰减慢于正常组织,而水肿中的DWI信号在b值较低时迅速衰减,表明细胞外水在低b值时可以自由扩散[12]。b值越小,越容易受到灌注效应的影响,b值较大时,则会造成组织信噪比和病灶对比噪声比逐渐减低,图像质量降低[18],因此不能选择较大或较小的b值,而本研究中的b值为2500 s/mm2时,高低级别胶质瘤信号强度差异最显著,表明sDWI b值范围为0~2500 s/mm2,b值为2500 s/mm2时能够更好地反映肿瘤组织内水分子运动情况。DWI 作为游离水扩散测量的生物标志物[19-20],随着肿瘤分级越高,细胞密度越大,且癌性间质成分增多,水分子自由扩散运动空间减小、运动度降低,导致DWI 信号强度升高[21],这与本研究结果一致,即同一b 值下高级别胶质瘤组DWI信号强度均明显高于低级别胶质瘤组。
3.4 sDWI高b值成像的优势
在本研究中,我们利用sDWI 获取的不同b 值图像评估脑胶质瘤分级的效能,并与多个b 值的DWI 图像比较,评估sDWI不同b值的DWI图像对脑胶质瘤分级的效能,结果发现b=2500 s/mm2时诊断效能最高。以往多项研究[22]显示高b值DWI在评估胶质瘤分级中具有较高的敏感性和特异性,但胶质瘤DWI 的高b 值选择仍未达成共识,主要由于病变的最佳b值取决于图像对比度,图像对比度随组织类型而改变[23],提高b 值对图像质量及信噪比产生一定程度的影响,常规高b 值成像随着b 值的升高,DWI 图像信噪比显著下降,变形程度增加[24]。sDWI 高b 值DWI 图像克服了这一局限性[25-26],在乳腺癌等疾病应用中得到了证实[27],有研究显示sDWI1500与cDWI1500(常规b=1500 s/mm2)相比,sDWI1500提供了更好的病变显著性和更高的癌与实质对比度[28]。Thomas 等[29]利用sDWI 研究缺血性脑卒中也证实这一观点。sDWI 技术在不延长扫描时间的同时提供多个b 值DWI 图像以及更好的病变与周围组织对比度,清晰显示瘤体周围组织囊变、坏死。同时,sDWI 也为脑胶质瘤高b 值成像的选择提供了方向。
此外,有研究报道了高b 值DWI在胶质瘤放化疗假性进展鉴别中的优势,以及在复发性胶质瘤贝伐单抗治疗假性反应鉴别中的优势[30],sDWI 同时为胶质瘤术后辅以放化疗患者复发与假性进展的鉴别诊断也提供了方向。
3.5 本研究存在的不足
本研究的不足之处:(1)sDWI只能合成b值范围为0~2500 s/mm2的DWI 图像,不能提供更高b 值DWI图像;(2)sDWI 无法合成(除b 值为0、1000 s/mm2)ADC 图像并测出其不同b 值对应的ADC 值,从而未将ADC 值纳入本研究;(3)手动勾画ROI 存在主观性,不可避免存在偏差;(4)本组样本量相对不足,今后仍需要大样本多中心研究进一步证实。
综上所述,我们采用sDWI 技术来初步半定量评价脑胶质瘤分级,结果说明该方法具有一定的临床应用价值,为脑胶质瘤分级诊断提供了一种有意义的功能成像方法,从而为临床诊断、治疗提供更精确的依据。
作者利益冲突声明:全体作者均声明无利益冲突。
