不同氮效率玉米品种响应氮肥减施的差异表达基因分析
2022-11-25张盼盼张美微何冠华乔江方
李 川,张盼盼,张美微,牛 军,赵 霞,何冠华,乔江方
(1. 河南省农业科学院 粮食作物研究所,河南 郑州 450002;2. 宝丰县农业科学研究所,河南 宝丰 467400)
玉米作为我国重要的粮食、饲料、经济三合一作物,对保障我国粮食安全具有重要作用[1]。近年来,我国人口增加、社会发展引起劳动力转移及耕地面积大大减少,提高玉米单位面积产量成为满足我国对玉米需求的有效途径[2⁃3]。合理施肥是提高玉米单产的重要措施,尤其是氮肥,其对玉米单产的贡献率约为45%[4]。我国氮肥单位面积施用量超过美国等国家,但是当季氮肥利用率却只有30%~35%,低于世界平均水平[5]。过量施用氮肥不仅增加了生产成本、降低了氮肥利用率、浪费资源,还会导致植株细胞壁变薄、茎秆易折断和病菌侵袭(如玉米叶枯病大面积暴发)。另外,过量施用氮肥还会导致土壤酸化板结、土壤微生物活性下降、水及大气污染等环境问题[6]。2020 年,农业农村部明确提出化肥施用量零增长的政策[7]。因此,提高玉米单产应该通过提高玉米的氮肥利用效率来实现。然而,不同玉米品种对施氮量的响应程度不同、氮肥利用效率不同[8⁃10]。依据氮素吸收效率和氮素利用效率,玉米氮高效品种可划分为高氮高效型品种、低氮高效型品种[11⁃13]、低氮高氮均高效型品种[14⁃17]。其中,低氮高效型玉米品种可以在低氮条件下实现稳产、高产[18⁃20],提高氮肥利用率,减少氮肥施用量[21⁃22],减少生产成本,防止环境污染,实现农业绿色可持续发展[23⁃24]。因此,研究氮高效玉米品种的氮高效机制对减施氮肥、提高单产及培育新的氮高效品种具有重要意义。目前,玉米氮高效品种相关研究多集中在氮运筹方式[25⁃27]及氮肥效率筛选标准评定[28⁃30]方面,尚未见不同氮效率玉米品种响应氮肥减施的差异表达基因(Differently expressed genes,DEG)研究。为此,在正常氮和低氮条件下,对氮高效和氮低效玉米品种灌浆中期穗位叶进行高通量转录组测序,分析不同氮效率玉米品种中氮代谢相关DEG,并对重要DEG 进行功能富集分类和代谢通路分析,以期阐明不同氮效率品种响应氮肥减施的复杂分子机制,为选育耐低氮玉米品种提供理论指导。
1 材料和方法
1.1 试验地概况及试验材料
试验于2021 年在河南省农业科学院现代农业科技试验示范基地(新乡市原阳县,113°42′4″E、35°0′17″N)进行。该区属于暖温带大陆性季风气候,土壤类型为潮土,肥力均匀。试验地前茬作物为小麦,排灌方便。0~30 cm 耕层土壤pH 值为8.4,呈弱碱性,有机质含量为17.25 g/kg,全氮含量为0.96 g/kg,速效氮含量为79.35 mg/kg,速效磷含量为39.22 mg/kg,速效钾含量为170.56 mg/kg。
供试玉米品种为伟科518(WK518)、农大108(ND108)。河南省农业科学院粮食作物研究所玉米耕作与栽培课题组前期研究[28]结果表明,WK518在氮肥减施条件下减产较少,氮肥利用效率显著高于ND108;WK518 氮吸收效率、氮利用效率、氮效率及穗位叶SPAD 值、初始荧光值、最大荧光值、最大光化学效率、PSⅡ综合性能指数、硝酸还原酶、谷氨酰胺合成酶活性均高于ND108。供试氮肥为尿素(含N 46%),磷肥为过磷酸钙(含P2O512%),钾肥为硫酸钾(含K2O 52%)。
1.2 试验设计
试验设置2 个氮水平,分别为0 kg/hm2(低氮,LN)和225 kg/hm2(正常氮,HN)。每个处理3 个重复,共12 个小区。每个小区均为8 行区,行长为5 m,行间距为0.6 m,小区间隔为1.2 m。氮肥50%基施、50%于大喇叭口期追施。磷肥和钾肥的施用量均为120 kg/hm2,作为基肥施用。WK518 和ND108 均于2021 年6 月12 日播种,种植密度均为67 500株/hm2。其他田间管理与大田生产一致。
1.3 取样
于灌浆中期(2021 年8 月26 日),用酒精消毒后的剪刀剪取长势一致的5 株玉米的部分穗位叶,混合后放入5 mL 离心管中,重复3 次,分别命名为WK518-LN-1、 WK518-LN-2、 WK518-LN-3、WK518-HN-1、 WK518-HN-2、 WK518-HN-3、ND108-LN-1、ND108-LN-2、ND108-LN-3、ND108-HN-1、ND108-HN-2、ND108-HN-3,立即放入液氮罐中暂时保存,带回实验室后于-80 ℃超低温冰箱中长期保存。
1.4 转录组高通量测序
玉米叶片总RNA 用RNeasy plant mini kit(Qiagen,Germany)试剂盒提取,总RNA 的完整性用1%琼脂糖凝胶电泳进行检验,总RNA 的质量用Agilent Bioanalyzer 2100 system(Aglilent Technologies,USA)生物芯片分析检测仪进行检测,总RNA 的浓度用Nanodrop ND-1000 UV-Vis Spectrophotometer(Nanodrop Technologie,USA)仪器定量检测。将没有降解且浓度较高的总RNA 样本送至测序公司。利用Oligo(dT)富集分离出mRNA,并将完整的mRNA 随机断裂成300 bp 的mRNA 片段,之后反转录成cDNA,构建cDNA 文库,连接接头之后进行PCR 扩增,最后利用Illumina HiSeqTM2500 测序仪进行高通量测序。
1.5 转录组丰度分析
测序原始数据通过碱基分布统计进行质量控制,过滤去除接头和低质量序列之后得到干净序列。利用Hisat2序列比对软件将测序所得的干净序列与参考基因组玉米自交系B73 基因组(https://www.maizegdb.org/)进行比对,统计比对结果。转录本丰度等同于基因表达量分析,基因表达水平越高转录本丰度越高。基因表达水平用比对到参考基因组中的序列的数量来计算,即R(F)PKM(Reads/fragments per kilobase of exon model per million mapped reads)值,每100 万条序列中每个基因以1 000 个碱基为单位,与参照基因组公布序列比对上的序列数量。
1.6 DEG分析
不同样本之间DEG 的筛选标准为|log2(差异倍数)|≥1 且达到显著水平(P<0.05)。然后参照GO(Gene Ontology)数据库将筛选出的DEG 的功能进行分类,参照KEGG(Kyoto Encyclopedia of Genes and Genomes)数据库对DEG 编码蛋白质的功能进行预测及代谢通路富集分析。
1.7 实时荧光定量PCR(qRT-PCR)分析
根据高通量测序结果筛选出9个与氮吸收效率相关的DEG,利用Primer Premier 5.0 软件设计引物序列,交生工生物工程(上海)股份有限公司进行合成。qRT-PCR 反应体系按照Trans Start Top Green qPCR SuperMix 试剂盒进行配制,反应程序:95 ℃10 min;95 ℃10 s,60 ℃30 s,循环40 次。根据2-△△CT法计算基因的相对表达量。试验设3 个生物学重复、3个技术重复。
2 结果与分析
2.1 不同氮水平处理玉米穗位叶转录组测序质量分析
对12 个不同氮水平处理玉米穗位叶样本高通量转录组测序结果(表1)进行分析,发现干净序列丰度较高,GC 含量为48.50%以上,碱基质量值(Q20)在99.16%以上;与参考基因组公布序列进行比对,匹配率为84.00%~89.89%,比对有效。基因功能分析之后共获得49 339个基因。

表1 不同氮条件下不同氮效率玉米品种穗位叶转录组测序质量Tab.1 The transcriptome sequencing quality of ear leaves of maize varieties with different nitrogen efficiencies under different nitrogen levels
2.2 低氮条件下不同氮效率玉米品种DEG分析
由图1 可知,低氮条件下,在对比组WK518-LN vs ND108-LN 中共检测到4 384 个DEG。其中,2 065个为上调表达基因,2 319个为下调表达基因。

图1 不同氮条件下不同氮效率玉米品种中DEG数目Fig.1 The DEG numbers of different maize varieties with different nitrogen efficiencies under different nitrogen levels
由图2 可知,WK518-LN vs ND108-LN 对比组中DEG 显著富集的GO条目为尿卟啉-ⅢC-甲基转移 酶 活 性(Uroporphyrin⁃Ⅲ C⁃methyltransferase activity)、甘露糖-6-磷酸异构酶活性(Mannose⁃6⁃phosphate isomerase activity)、氧 化- 还 原 过 程(Oxidation⁃reduction process)、线 粒 体 组 织(Mitochondrion organization)、核 染 色 质(Nuclear chromatin)、ATP 结 合(ATP binding)、叶 绿 体(Chloroplast)、尿 卟 啉 原 脱 羧 酶 活 性(Uroporphyrinogen decarboxylase activity)、细胞质小核糖体亚单位(Cytosolic small ribosomal subunit)、U2 核内小RNA 结合(U2 snRNA binding)、顺式-反式异构酶活性(Cis⁃trans isomerase activity)、槲皮素7-O-葡糖转移酶(Quercetin 7⁃O⁃glucosyltransferase activity)、槲皮素3-O-葡糖转移酶(Quercetin 3⁃O⁃glucosyltransferase activity)、类黄酮葡萄糖醛酸化(Flavonoid glucuronidation)、类黄酮生物合成过程(Flavonoid biosynthetic process)、皮质微管(Cortical microtubule)、微 管(Microtubule)、高 温 响 应(Response to heat)、原生质膜(Plasma membrane)、ADP 结合(ADP binding)。其中,富集程度最高的为尿卟啉-ⅢC-甲基转移酶活性、甘露糖-6-磷酸异构酶活性2 个GO 条目;富集最多DEG 的为原生质膜、叶绿素、ATP结合3个GO条目。

图2 低氮条件下WK518-LN vs ND108-LN对比组中DEG的GO富集分析Fig.2 GO enrichment analysis of DEGs in WK518-LN vs ND108-LN group under low nitrogen level
通过KEGG 数据库对低氮条件下WK518-LN vs ND108-LN 对比组中DEG 的代谢通路进行分析(图3),发现WK518-LN vs ND108-LN 对比组中DEG 富集于氨基糖及核苷酸糖新陈代谢(Amino sugar and nucleotide sugar metabolism),苯丙氨酸新陈代谢(Phenylalanine metabolism),类单萜生物合成(Monoterpenoid biosynthesis),甘氨酸、丝氨酸及苏氨 酸 新 陈 代 谢(Glycine,serine and threonine metabolism),碱基剪切修复(Base excision repair),错配修复(Mismatch repair),类胡萝卜素生物合成(Carotenoid biosynthesis),花 青 素 生 物 合 成(Anthocyanin biosynthesis),磷酸盐及亚磷酸盐新陈代谢(Phosphonate and phosphinate metabolism),丁酸甲酯新陈代谢(Butanoate metabolism),过氧化物酶体(Peroxisome),灵菌红素生物合成(Prodigiosin biosyntheses),非同源性末端连接(Non⁃homologous end⁃joining),DAN 复制(DNA replication),丙氨酸新陈代谢(α⁃alanine metabolism),泛醌及其他萜类-醌化合物生物合成(Ubiquinone and other terpenoid⁃quinone biosynthesis),卟啉及叶绿素新陈代谢(Porphyrin and chlorophyll metabolism),牛磺酸及亚牛磺酸新陈代谢(Taurine and hypotaurine metabolism),缬氨酸、亮氨酸及异亮氨酸降解(Valine,leucine and isoleucine degradation),核苷酸剪切修复(Nucleotide excision repair)20 个KEGG 代谢通路。

图3 低氮条件下WK518-LN vs ND108-LN对比组中DEG的KEGG分类Fig.3 KEGG classification of DEGs in WK518-LN vs ND108-LN group under low nitrogen level
2.3 正常氮条件下不同氮效率玉米品种DEG分析
由图1 可见,正常氮条件下,在WK518-HN vs ND108-HN 对比组中共检测到6 184 个DEG。其中,2 368个为上调表达基因,3 780个为下调表达基因。检测到的DEG 远远多于低氮条件,尤其是下调表达基因比低氮条件下多了63%。
由图4 可知,WK518-HN vs ND108-HN 对比组中DEG 显著富集于气孔关闭(Stomatal closure)、跨膜受体丝氨酸/苏氨酸蛋白激酶活性(Transmembrane receptor protein serine/threonine kinase activity)、叶绿体基质(Chloroplast stroma)、类囊 体(Thylakoid)、叶 绿 体 被 膜(Chloroplast envelope)、防御响应(Defense response)、蛋白质自磷酸化(Protein autophosphorylation)、未折叠蛋白结合(Unfolded protein binding)、氧 化- 还 原 过 程(Oxidation⁃reduction process)、跨膜受体酪氨酸蛋白激酶活性(Transmembrane receptor protein tyrosine kinase activity)、高温响应(Response to heat)、NAD(P)H脱氢酶复合体/质体醌[NAD(P)H dehydrogenase complex/plastoquinone]、寒 冷 响 应(Response to cold)、ATP 结 合(ATP binding)、蛋 白 质 磷 酸 化(Protein phosphorylation)、丝氨酸/苏氨酸蛋白激酶活性(Protein serine/threonine kinase activity)、叶绿体类囊体膜(Chloroplast thylakoid membrane)、膜组成部分(Integral component of membrane)、叶绿体(Chloroplast)、原生质膜(Plasma membrane)等GO 条目。其中,富集程度较高的为NAD(P)H 脱氢酶复合体/质体醌、跨膜受体酪氨酸蛋白激酶活性2 个GO 条目;富集最多DEG 的为原生质膜、叶绿体、膜组成部分3个GO条目。

图4 正常氮条件下WK518-HN vs ND108-HN对比组中DEG的GO富集分析Fig.4 GO enrichment analysis of DEGs in WK518-HN vs ND108-HN group under normal nitrogen level
由图5 可知,WK518-HN vs ND108-HN 对比组中DEG 显著富集于光合作用生物体中碳固定(Carbon fixation in photosynthetic organisms),氨基糖及核苷酸糖新陈代谢(Amino sugar and nucleotide sugar metabolism),糖 酵 解/糖 异 生(Glycolysis/gluconeogenesis),丙 氨 酸 新 陈 代 谢(β⁃alanine metabolism),光合作用-天线蛋白(Photosynthesis⁃antenna proteins),丙氨酸、天冬氨酸及谷氨酸新陈代谢(Alanine,aspartate and glutamate metabolism),赖氨酸降解(Lysine degradation),苯丙氨酸新陈代谢(Phenylalanine metabolism),果糖及甘露糖新陈代谢(Fructose and mannose metabolism),光合作用(Photosynthesis),泛醌及其他萜类-醌化合物生物合 成(Ubiquinone and other terpenoid⁃quinone biosynthesis),过氧化物酶体(Peroxisome),植物-病原体相互作用(Plant⁃pathogen interaction),精氨酸及脯氨酸新陈代谢(Arginine and proline metabolism),甘氨酸、丝氨酸及苏氨酸新陈代谢(Glycine,serine and threonine metabolism),淀粉及蔗糖新陈代谢(Starch and sucrose metabolism),磷脂酰肌醇信号系统(Phosphatidylinositol signaling system),内质网内蛋白质加工过程(Protein processing in endoplasmic reticulum),花生四烯酸新陈代谢(Arachidonic acid metabolism),氮新陈代谢(Nitrogen metabolism)20 个KEGG 代谢通路。与低氮条件下WK518-LN vs ND108-LN 对比组相比,只有6 个共同的显著富集代谢通路,分别为氨基糖及核苷酸糖新陈代谢,丙氨酸新陈代谢,苯丙氨酸新陈代谢,泛醌及其他萜类-醌化合物生物合成,过氧化物酶体,甘氨酸、丝氨酸及苏氨酸新陈代谢。
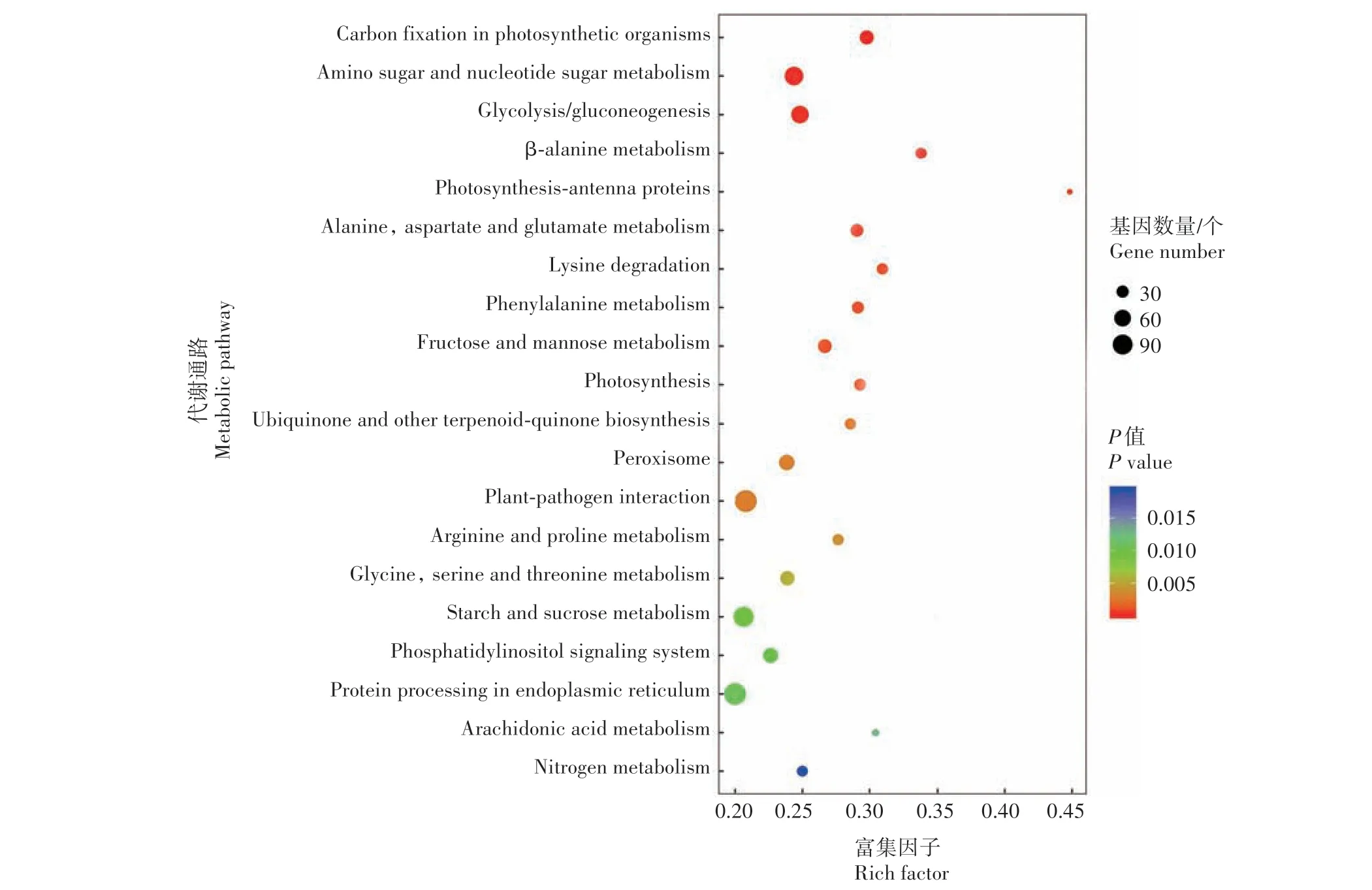
图5 正常氮条件下WK518-HN vs ND108-HN对比组中DEG的KEGG分类Fig.5 KEGG classification of DEGs in WK518-HN vs ND108-HN group under normal nitrogen level
2.4 WK518在不同氮条件下DEG分析
由图1 可见,在不同氮条件下,在WK518-HN vs WK518-LN 对比组中共检测到3 277 个DEG。其中,1 009 个为上调表达基因,2 268 个为下调表达基因。
由图6 可知,WK518-HN vs WK518-LN 对比组中DEG 显著富集的GO 条目为几丁质响应(Response to chitin)、蛋 白 质 磷 酸 化(Protein phosphorylation)、膜(Membrane)、吲哚硫代葡萄糖苷代谢过程(Indole glucosinolate metabolic process)、肌醇半乳糖苷-蔗糖半乳糖基转移酶(Galactinol⁃sucrose galactosyltransferase)、高 温 胁 迫 响 应(Response to heat)、原生质膜(Plasma membrane)、干旱胁迫响应(Response to water deprivation)、冷胁迫响应(Response to cold)、脱落酸激活的信号通路(Abscisic acid⁃activated signaling pathway)、膜组成部分(Integral component of membrane)、脱落酸响应(Response to abscisic acid)、盐胁迫响应(Response to salt stress)、几丁质酶活性(Chitinase activity)、钙离 子 结 合(Calcium ion binding)、病 原 体 响 应(Response to virus)、棉籽糖分解代谢过程(Raffinose catabolic process)、棉籽糖α-半乳糖苷酶活性(Raffinose alpha⁃galactosidase activity)、对其他生物体的防御反应(Defense response to other organism)、丁烯内酯衍生物响应(Response to karrikin)。其中,富集程度较高的GO条目为棉籽糖分解代谢过程、棉籽糖α-半乳糖苷酶活性;富集较多DEG的GO条目为原生质膜、膜组成部分。

图6 WK518在不同氮水平下DEG的GO富集分析Fig.6 GO enrichment analysis of DEGs in WK518-HN vs WK518-LN group under different nitrogen levels
由图7 可知,WK518-HN vs WK518-LN 对比组中DEG 显著富集于光合作用生物体中碳固定(Carbon fixation in photosynthetic organition),植物激素信号传导(Plant hormone signal transduction),内质网内蛋白质加工过程(Protein processing in endoplasmic reticulum),植物-病原体相互作用(Plant⁃pathogen interaction),植物MAPK 信号通路(MAPK signaling pathway⁃plant),类胡萝卜素生物合成(Carotenoid biosynthesis),果糖及甘露糖新陈代谢(Fructose and mannose metabolism),乙醛酸及二羧酸盐新陈代谢(Glyoxylate and dicarboxylate metabolism) ,糖 酵 解/糖 异 生(Glycolysis/gluconeogenesis),类 黄 酮 生 物 合 成(Flavonoid biosynthesis),玉 米 素 生 物 合 成(Zeatin biosynthesis),其他类型O-聚糖生物合成(Other types of O⁃glycan biosynthesis),精氨酸及脯氨酸新陈代谢(Arginine and proline metabolism),氨基糖及核苷酸糖新陈代谢(Amino sugar and nucleotide sugar metaboism),芪类、双苯庚烷及姜辣素(Stilbenoid,diarylheptanoid and gingerol),光合作用(Photosynthesis),植物昼夜节奏(Circadian rhythm⁃plant),甘油磷 脂新陈 代谢(Glycerophospholipid metabolism),淀粉及蔗糖新陈代谢(Starch and sucrose metabolism),苯丙氨酸新陈代谢(Phenylalanine metabolism)共20个KEGG代谢通路。

图7 WK518在不同氮条件下DEG的KEGG分类Fig.7 KEGG classification of DEGs in WK518-HN vs WK108-LN group under different nitrogen levels
2.5 ND108在不同氮条件下DEG分析
由图1 可见,在不同氮条件下,在ND108-HN vs ND108-LN 对比组中共检测到874 个DEG。其中,364个为上调表达基因,510个为下调表达基因。检测到的DEG 远远少于不同氮条件下的WK518,尤其是下调表达基因比WK518少了77.52%。
由图8 可知,ND108-HN vs ND108-LN 对比组中DEG 显著富集的GO 条目主要为干旱胁迫响应(Response to water deprivation)、毒素分解代谢过程(Toxin catabolic process)、几丁质酶活性(Chitinase activity)、海藻糖生物合成过程(Trehalose biosynthetic process)、海 藻 糖- 磷 酸 酶 活 性(Trehalose⁃phosphatase activity)、几丁质结合(Chitin binding)、作用于配对的氧化还原酶活性(Oxidoreductase activity,acting on paired)、调控丝氨酸/苏 氨 酸 蛋 白(Regulation of protein serine/threonine protein)、蛋白磷酸酶抑制剂活性(Protein phosphatase inhibitor activity)、氧 化 还 原 过 程(Oxidation⁃reduction process)、镉 离 子 响 应(Response to cadmium ion)、脱落酸结合(Abscisic acid binding)、类黄酮生物合成过程(Flavonoid biosynthetic process)、类黄酮糖脂化作用(Flavonoid glucuronidation)、脱落酸激活的信号通路(Abscisic acid⁃activated signaling pathway)、砷酸盐还原酶/谷氧还蛋白活性(Arsenate reductase/glutaredoxin activity)、脱落酸响应(Response to abscisic acid)、次级代谢物生物合成过程(Secondary metabolite biosynthetic process) 、 信 号 传 导(Signal transduction)、食 草 动 物 响 应(Response to herbivore)。其中,富集程度较高的GO 条目为食草动物响应、砷酸盐还原酶/谷氧还蛋白活性;富集最多DEG 的GO 条目为氧化还原过程、镉离子响应、干旱胁迫响应。与不同氮条件下WK518 相比,只有3个相同的显著富集GO 条目,即干旱胁迫响应、脱落酸激活的信号通路、脱落酸响应。可见氮高效品种WK518 与氮低效品种ND108 响应氮肥减施的分子机制有着巨大的差异。

图8 ND108在不同氮条件下DEG的GO富集分析Fig.8 GO enrichment analysis of DEGs in ND108-HN vs ND108-LN group under different nitrogen levels
由图9 可知,在不同氮条件下,ND108-HN vs ND108-LN 对比组中DEG 富集的KEGG代谢通路为乙醛酸及二羧酸盐新陈代谢(Glyoxylate and dicarboxylate metabolism),植 物MAPK 信 号 通 路(MAPK signaling pathway⁃plant),灵菌素生物合成(Prodigiosin biosynthesis),玉米素生物合成(Zeatin biosynthesis),生物素新陈代谢(Biotin metabolism),双萜类生物合成(Diterpenoid biosynthesis),黄酮及黄酮醇生物合成(Flavone and flavonol biosynthesis),α-亚麻酸新陈代谢(α⁃linolenic acid metabolism),氮代谢(Nitrogen metabolism),淀粉及蔗糖新陈代谢(Starch and sucrose metabolism),苯丙素生物合成(Phenylpropanoid biosynthesis),ABC 转运蛋白(ABC transporters),精 氨 酸 生 物 合 成(Arginine biosynthesis),植物激素信号传导(Plant hormone signal transduction),C5 分 支 二 元 酸 新 陈 代 谢(C5⁃branched dibasic acid metabolism),脂肪酸生物合成(Fatty acid biosynthesis),类黄酮生物合成(Flavonoid biosynthesis),牛磺酸及亚牛磺酸新陈代谢(Taurine and hypotaurine metabolism),泛酸及辅酶A 生物合成(Pantothenate and CoA biosynthesis),丙氨酸、天冬氨酸及谷氨酸新陈代谢(Alanine,aspartate and glutamate metabolism)。与不同氮条件下WK518 相比,仅有5 个相同的代谢通路,分别为乙醛酸及二羧酸盐新陈代谢、植物MAPK 信号通路、玉米素生物合成、淀粉及蔗糖新陈代谢、植物激素信号传导。
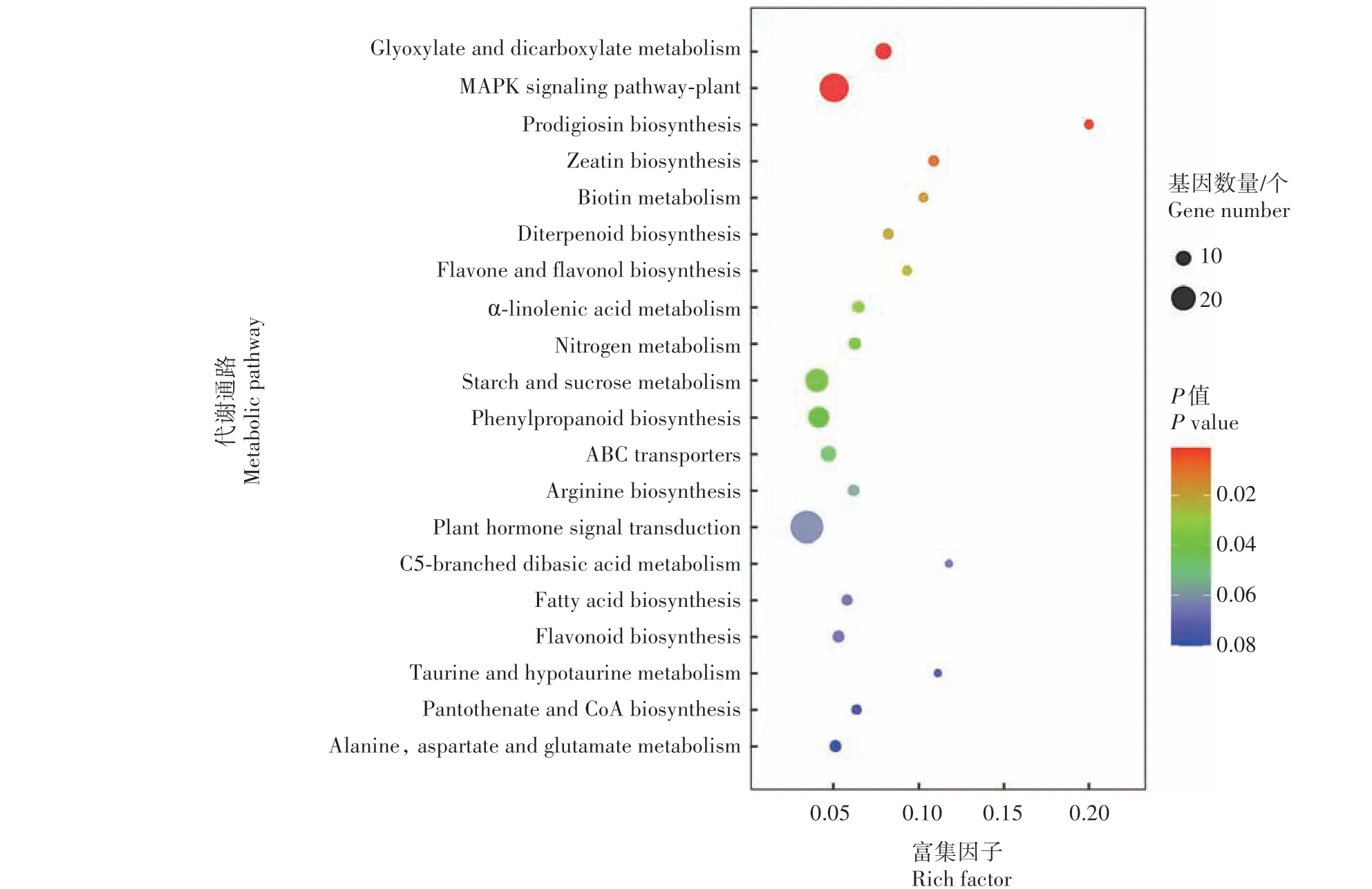
图9 ND108在不同氮条件下DEG的KEGG分类Fig.9 KEGG classification of DEGs in ND108-HN vs ND108-LN group under different nitrogen levels
2.6 不同氮条件下不同氮效率玉米品种中的差异表达转录因子分析
不同氮条件下,在氮高效品种WK518和氮低效品种ND108 检测到的DEG 中,共有58 个转录因子家族(表2),这些转录因子大多调控植物生长发育、生物及非生物胁迫响应等。其中,GRAS 转录因子家族、bHLH 转录因子家族、MYB 相关转录因子家族、NAC 转录因子家族、C3H 转录因子家族、ERF 转录因子家族、C2H2转录因子家族、WRKY 转录因子家族、FAR1 转录因子家族均包含了1 000 个以上的DEG;B3、bZIP、MYB、G2-like、M-type-MADS、Trihelix、GATA、HB-other、LBD、ARF、TCP、HDZIP、E2F/DP、MIKC-MADS、Nin-like、Dof、SBP、GeBP、HSF、NF-YA、ZF-HD、AP2、CAMTA、NF-YC、NF-YB、CPP、BES1、DBB、ARR-B、TALE、YABBY、CO-like、STAT 33 个转录因子家族均包含了100 个以上的DEG。

表2 不同氮条件下WK518和ND108中的差异表达转录因子Tab.2 Differentially expressed transcription factors in WK518 and ND108 under different nitrogen levels

续表2 不同氮条件下WK518和ND108中的差异表达转录因子Tab.2(Continued) Differentially expressed transcription factors in WK518 and ND108 under different nitrogen levels
2.7 不同氮条件下不同氮效率玉米品种中部分DEG的表达验证
为了验证不同氮效率品种中氮吸收相关DEG的表达模式,利用qRT-PCR 分析正常氮条件下LOC109944516-1、LOC109944516-2、LOC103640123、LOC103636214 及低氮条件下LOC100279186-1、LOC100279186-2、LOC103640667、LOC103641949、LOC100217128 在不同氮效率品种WK518、ND108中的表达情况。由图10 可知,在正常氮条件下,LOC109944516-1、LOC109944516-2、OC103640123、LOC103636214在氮高效品种WK518中的表达量下降。其 中,LOC109944516-1、LOC109944516-2、LOC103640123 达到显著水平,这与转录组测序结果一致。 在低氮条件下,LOC100279186-1、LOC100279186-2、LOC103641949、LOC100217128在氮高效品种WK518中的表达量显著升高,这与转录组测序结果一致。

图10 不同氮条件下WK518和ND108中部分DEG的表达验证Fig.10 Expression validation of partial DEGs in WK158 and ND108 under different nitrogen levels
3 结论与讨论
在WK518-HN vs WK518-LN 对比组中筛选到DEG 3 277 个,然而在ND108-HN vs ND108-LD 对比组中仅仅筛选到874 个DEG,这与张盼盼等[28]的氮肥减施条件下不同基因型玉米氮效率差异及生理特性研究结果一致。正是WK518 在低氮条件下启动了更多的基因差异表达,从而在表型上表现为氮肥减施条件下依旧有着较高的叶绿素含量、氮素代谢相关酶活性和较优的叶绿素荧光特性,从而保证了WK518 在不施氮肥的条件下籽粒干物质积累和氮素同化能力,维持较高的氮素利用效率,最终保障产量。而ND108 在低氮条件下由于启动了较少的基因差异表达,不能维持正常的叶绿素含量、氮素代谢相关酶活性、荧光特性等,最终表现为减产严重。
本研究共检测到58个差异表达转录因子家族,这些转录因子家族成员大多调控植物生长发育、生物及非生物胁迫响应等,主要包括bHLH 转录因子、MYB相关转录因子、NAC转录因子、FAR1转录因子等。玉米植株响应低氮的分子机制是多基因的综合作用,下一步可以针对性选择几类重要的氮肥响应转录因子,对其进行功能验证,最终鉴定出重要的氮响应转录因子基因,并通过分子生物学技术提高玉米植株的氮吸收效率。
