多重耐药菌感染患者清创术后内镜灭菌方法研究
2022-11-24马久红周梦娇李贤煌毕正琴何荣攀
马久红,周梦娇,李贤煌,毕正琴,何荣攀,胡 露,黄 茜
(1. 南昌大学第一附属医院消化内镜中心,江西 南昌 330006; 2. 荆州市第一人民医院消化内镜中心,湖北 荆州 434200; 3. 南充市中心医院呼吸内科,四川 南充 637000)
胰腺包裹性坏死(wall-off necrosis,WON)是急性胰腺炎常见的并发症,根据新亚特兰大分类将其定义为囊腔含有固体坏死物质、急性胰腺炎病程大于4周且成熟囊壁有胰周积液[1-2]。WON并多重耐药菌(multidrug-resistant organism, MDRO)感染率达63%,成为急性胰腺炎患者主要死因[3-4]。(经皮/经胃)内镜下清创术是将内镜操纵到坏死腔的不同延伸部分,利用活检钳、圈套器等器械,达到彻底清除坏死组织碎片的效果,具有病死率低、胰瘘发生率低等优点,已成为WON首选的治疗方案[5-7]。MDRO WON(经皮/经胃)内镜下清创术使用的副送水内镜除有钳子管道和送气/送水管道,增加了副送水管道,实现对术中创面实时冲洗,获得更清晰的视野,以提高治疗效率。然而,副送水管道细小,清洗消毒过程中不能直接刷洗,仅依靠注射器反复注气注液,清洗消毒难度大,更容易引起MDRO在腔道内的残留。
过去十几年间,国外研究报道各大医院超过25起软式内镜再处理不合格导致的MDRO感染暴发[8]。2014年,美国西雅图一家医院内镜逆行胰胆管造影术(endoscopic retrograde cholangiopancreatography, ERCP)后16例患者因感染MDRO死亡。Ross等[9]分析原因发现,现有的软式内镜再处理指南存在不足,即使严格按照厂家指南进行清洗消毒,仍有2%的软式内镜再处理不合格。因软式内镜再处理不合格引起MDRO医院感染或暴发的危险因素包括:内镜管腔结构复杂清洗不彻底、存在刮痕刮丝等损伤、消毒灭菌剂使用不规范等[10-12]。鉴于MDRO WON(经皮/经胃)内镜下清创术使用的副送水内镜结构更复杂,国内尚缺乏相应的再处理数据。本研究采用过氧乙酸浸泡灭菌和环氧乙烷低温灭菌两种方法对用于MDRO WON(经皮/经胃)内镜下清创术的副送水内镜进行消毒灭菌,对消毒灭菌后内镜的钳子管道、送气/送水管道和副送水管道3个位点进行微生物采样研究,初步了解不同方法对MDRO WON(经皮经胃)内镜下清创术内镜的灭菌效果,以期为该类内镜甚至不同用途内镜的消毒灭菌方式提供参考依据。
1 对象与方法
1.1 研究对象 本研究共纳入(经皮/经胃)内镜下清创术的GIF-260J带副送水功能的内镜78条,均为2020年1月—2021年12月某院在胰腺ICU住院且根据引流物培养结果明确为MDRO感染的WON患者手术使用。
1.2 灭菌方法 A组按照WS 507—2016《软式内镜清洗消毒技术规范》[13](以下简称《规范》)对内镜进行预处理、测漏、手工清洗、漂洗、0.225%过氧乙酸浸泡灭菌15 min、无菌水终末漂洗、干燥;B组根据《规范》对内镜进行预处理、测漏、手工清洗、漂洗、干燥、环氧乙烷低温灭菌。
1.3 分组及采样方法 根据不同灭菌方法,采用随机数字表法分为A组过氧乙酸浸泡灭菌组和B组环氧乙烷低温灭菌组,各39条,分别对内镜的钳子管道、送气/送水管道和副送水管道3个位点进行微生物培养和菌落计数。按照GB15982—2012《医院消毒卫生标准》[14](以下简称《标准》)的要求,严格进行无菌操作。使用无菌注射器抽取50 mL硫代硫酸钠中和剂分别对消毒灭菌后的钳子管道、送气/送水管道和副送水管道进行冲洗,远端部由全量收集器收集。收集完毕2 h内送至实验室进行微生物学监测。取洗脱液1 mL接种营养琼脂平皿,再取1 mL重复上步骤接种于平皿,将剩余48 mL洗脱液用滤膜(0.45 μm)过滤浓缩,将滤膜接种于平皿上,置36℃±1℃温箱培养48 h后进行菌落计数。挑出典型单个菌落进行革兰染色,光学显微镜下观察细菌形态并分类,采用微生物自动分析系统进行细菌鉴定和药敏试验。
1.4 灭菌效果评价 按照《规范》灭菌后的内镜不能检出任何微生物,3个管道采样有任一位点检测出微生物即为此内镜灭菌不合格。(1)灭菌合格率(%)=灭菌合格条数/采样条数×100%。(2)菌落数:当滤膜法不可计数时, 菌落总数(CFU/位点)=平皿的平均菌落数×50。当滤膜法可计数时, 菌落总数(CFU/位点)=平皿总菌落数+滤膜总菌落数[15]。
1.5 质量控制
1.5.1 患者一般资料一致性 系统后台导出每例患者性别、年龄、病因和感染病原菌耐药情况,比较两组患者一般资料的一致性。
1.5.2 内镜一致性 本试验的内镜均为同一批次购入,使用年限和型号均相同(GIF-260J)。试验前内镜均行微生物学监测,菌落计数为0则纳入研究。
1.5.3 工作人员一致性 1名专职清洗消毒护士负责本试验内镜的清洗消毒工作,1名专职护士负责清洗消毒流程质量控制。2名采样护士负责本试验内镜的采样工作。
2 结果
2.1 两组患者的一般资料 两组患者性别、年龄、病因及耐药菌比较,差异均无统计学意义(P>0.05),见表1。
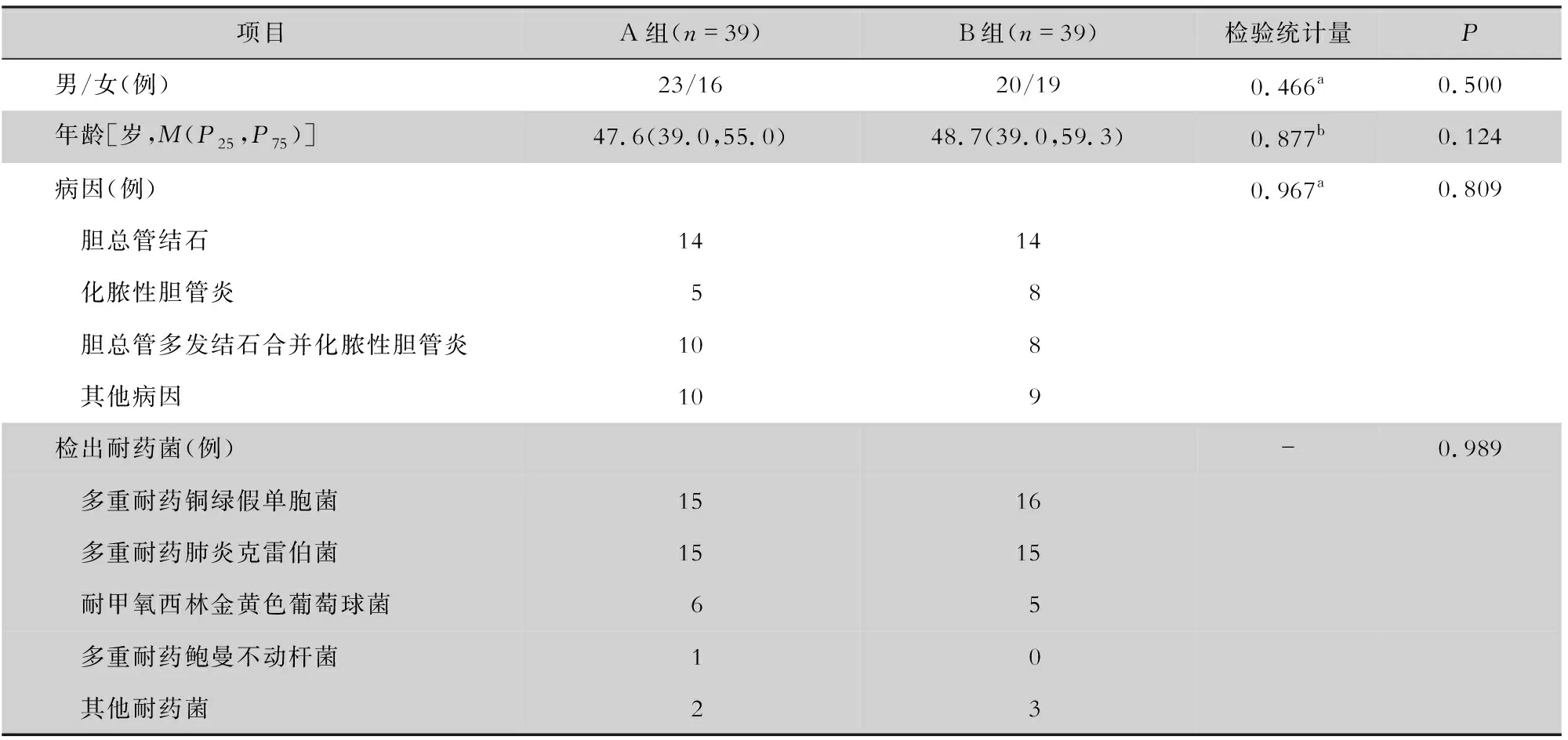
表1 两组患者一般资料比较
2.2 不同灭菌方法处理后内镜灭菌合格率比较 A组内镜灭菌合格率为61.54%(24/39),B组内镜灭菌合格率为100%(39/39),两组比较,差异具有统计学意义(χ2=18.571,P<0.001)。
2.3 不同灭菌方法处理后各位点灭菌合格率比较 A组钳子管道灭菌合格率为82.05%,送气/送水管道灭菌合格率为89.74%,副送水管道灭菌合格率为74.36%,B组3个位点灭菌合格率均为100%。钳子管道和副送水管道2个位点组间灭菌合格率比较,差异均有统计学意义(均P<0.05)。送气/送水管道两组内镜灭菌合格率比较,差异无统计学意义(P>0.05)。见表2。其中,A组有3条(7.69%)内镜的3个位点同时检出细菌,有2条(5.13%)内镜的钳子管道和副送水管道2个位点同时检出细菌。
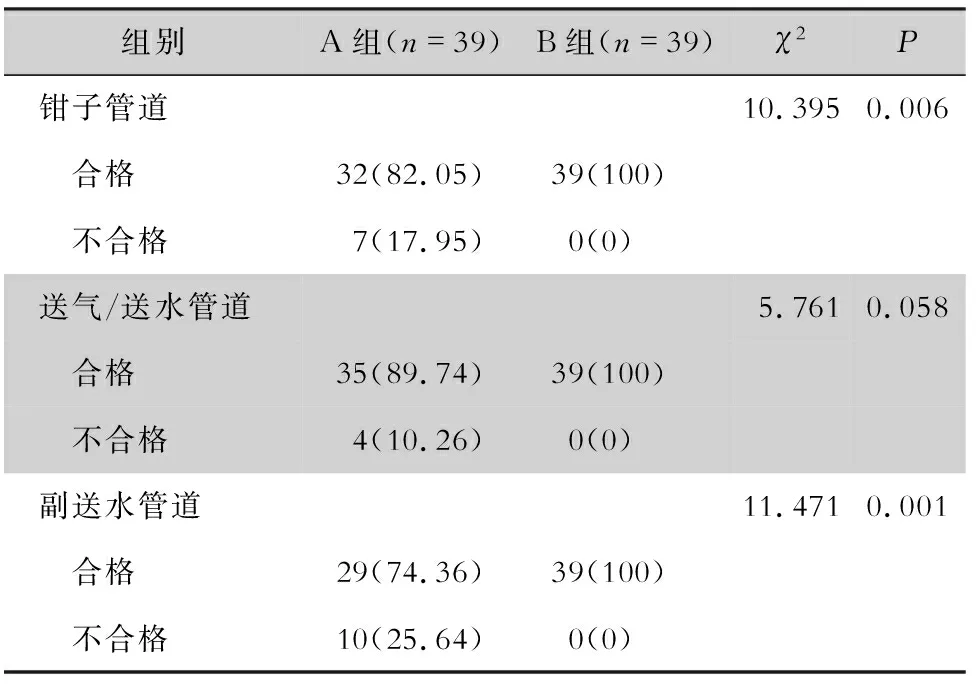
表2 不同灭菌方法处理后内镜各位点灭菌合格率比较 [例(%)]
2.4 不同灭菌方法处理后各位点菌落数比较 3个位点细菌菌落数A组和B组间比较,差异均有统计学意义(均P<0.05)。A组内镜过氧乙酸浸泡灭菌后各位点的菌落总数分布范围不同,钳子管道、送气/送水管道和副送水管道菌落总数范围分别为0~6 、0~112、0~23 CFU。见表3。

表3 不同灭菌方法处理后内镜各位点菌落数比较(CFU)
2.5 过氧乙酸浸泡灭菌后内镜各位点检出MDRO情况 A组117份标本分离到36株MDRO,其中多重耐药铜绿假单胞菌占38.89%(14株),多重耐药肺炎克雷伯菌占27.78%(10株),耐甲氧西林金黄色葡萄球菌占19.44%(7株),多重耐药鲍曼不动杆菌占5.56%(2株)。见表4。

表4 过氧乙酸浸泡灭菌内镜各位点检出MDRO情况
2.6 不合格内镜转为环氧乙烷低温灭菌后各位点合格情况 本研究A组检测到15条内镜灭菌不合格,将该15条内镜转为环氧乙烷低温灭菌,结果显示钳子管道、送气/送水管道、副送水管道微生物学监测灭菌合格率达100%。
3 讨论
随着内镜下微创诊疗技术的发展,软式内镜应用领域也不断拓展,不仅用于“看见内部”,还用于无菌腔体内的治疗手术[16]。斯波丁分类规定,凡接触无菌组织的软式内镜均应灭菌[17]。过氧乙酸是近年软式内镜再处理过程中使用较为广泛的消毒剂和灭菌剂,理论上能杀灭一切细菌繁殖体,包括分枝杆菌、病毒、真菌及其孢子和绝大多数细菌芽孢,具有效率高、时间短、周转快等特点。本研究显示,MDRO WON(经皮/经胃)内镜下清创术内镜经过氧乙酸浸泡灭菌方法灭菌合格率为61.54%。从117份标本中分离到36株MDRO,其中多重耐药铜绿假单胞菌检出率最高。该结果考虑与内镜管腔结构复杂、易受磨损等原因导致手工清洗合格率低,内镜生物负载大,化学消毒剂浸泡杀菌效果差, 以及MDRO对过氧乙酸产生抗性有关[18-20]。
本研究关注带副送水功能的内镜,其结构复杂,包括钳子管道、送气/送水管道和副送水管道。钳子管道是内镜器械进出同时吸引空腔内容物的管道。送气/送水管道通过注气充盈空腔,注水冲洗内镜可视镜面,保持镜面干净清晰。副送水管道通过注入生理盐水等液体对创面进行冲洗,以保持清晰的治疗视野。A组内镜各位点合格率显示,送气/送水管道灭菌情况优于钳子管道和副送水管道。各位点细菌鉴定结果显示,送气/送水管道细菌检出株数少于钳子管道和副送水管道,可能和送气/送水管道的功能和设计有关。使用内镜时送气/送水管道在正压情况下通过内镜先端部极小的侧孔注入灭菌水和空气,这种设计可以减少污染物进入水气腔道的概率;但送气/送水管道细小,清洗刷无法进入管道内,在床旁预处理和手工清洗时,只能依靠专用清洗接头和灌流装置进行冲洗,一旦污染就难以清洗干净,影响消毒灭菌效果。A组各位点菌落数结果显示,1条内镜送气/送水管道菌落数高达112 CFU。由此可见,送气/送水管道菌落计数差异较大,该结果与国外其他学者研究结果[21]一致。
本组试验数据显示,过氧乙酸浸泡灭菌后副送水管道的灭菌合格率最低(74.36%),细菌检出率最高,与刘军等[22]研究结果一致。带副送水内镜的副送水管道极细小狭长,内径为1 mm,直接开口于内镜先端部,使用中存在液体反流倒灌的可能,污染风险高。对副送水管道的清洗,目前只能通过手工方法连接专用管道,使用注射器推注水或清洗液进行清洗,难以达到内镜清洗消毒的较高要求。因此,使用过氧乙酸浸泡灭菌方法时需加强对送气/送水管道和副送水管道污染状况的微生物学监测,以保证灭菌合格,未来也应设计新的清洗方法,降低感染风险。
2013—2014年美国暴发历史上最大一次因十二指肠镜抬钳器污染引起的MDRO感染事件,其中35例患者被确诊,随后采取环氧乙烷对十二指肠镜灭菌才得以终止暴发[23-24]。Smith等[25]对ERCP术前直肠拭子检查结果显示,MDRO感染或化脓性胆管炎患者使用的十二指肠镜感染传播风险高,被定义为高风险内镜。对该类高风险内镜采用环氧乙烷低温灭菌结果显示该处理可阻断MDRO通过十二指肠镜交叉感染。本研究中环氧乙烷低温灭菌对MDRO WON(经皮/经胃)内镜下清创术内镜消毒总合格率达100%,3个位点的合格率均为100%,没有检出微生物。将15条过氧乙酸灭菌法灭菌不合格的内镜转为环氧乙烷低温灭菌后,微生物检测灭菌合格率达100%,阻断了MDRO 通过内镜下清创术的副送水内镜感染传播的风险。上述结果提示,MDRO WON(经皮/经胃)内镜下清创术的内镜可认定为高风险内镜,建议采取环氧乙烷低温灭菌方法以保证临床使用安全,避免感染风险。
MDRO WON(经皮/经胃)内镜下清创术内镜再处理的质量控制仍是一大挑战,建议消毒灭菌前必须对内镜进行彻底地手工清洗。为防止MDRO在清洗消毒过程中对周围环境的污染,应注意手卫生以及穿好隔离衣,加强对诊疗间及周围环境的终末消毒,防止交叉感染。对内镜的微生物学监测不能仅局限于钳子管道的监测,带副送水内镜需监测副送水管道,以降低感染风险。未来应对临床常见MDRO的消毒剂和灭菌剂抗性进行研究,为临床合理选择消毒灭菌方法提供依据。
利益冲突:所有作者均声明不存在利益冲突。
