草本资源植物菥蓂对盐胁迫下生理生态及次生代谢产物响应
2022-11-23李娜娜刘同歌黄志慧郑宝江张玉红
李娜娜,刘同歌,黄志慧,郑宝江,张玉红*
(1.东北林业大学森林植物生态学教育部重点实验室,黑龙江 哈尔滨 150040;2.东北林业大学生命科学学院,黑龙江 哈尔滨 150040)
中国是盐渍土分布较为广泛的国家,在我国西北、东北、华北等地区土壤盐渍化现象明显,其中东北地区盐碱草地覆盖面积达到70%,并逐渐扩大,这使得大部分地区生态环境的稳定性以及土壤的利用率受到了严重的制约。土壤中盐的含量高,植物的成活率就下降,可以看出盐胁迫是影响植物生长发育的重要环境因子之一[1-2]。盐胁迫会导致渗透胁迫、离子毒性等影响植物的生理和代谢紊乱,从而使细胞损伤直至死亡[3]。现在有很多科学家从植物耐盐机制及培育耐盐品种等方面做了大量的研究,通过培育耐盐品种从而提升盐碱土地的生产力和利用率,对于提高资源植物的生产和产量具有重要且深远的意义[4]。
菥蓂(Thlaspi arvense),又叫遏蓝菜,十字花科菥蓂属植物,在我国大部分地区都有分布,常生长在山坡、草地、路旁[5]。种子和全草都能入药,菥蓂全草中含有芥子苷、芥子酶、吲哚等;菥蓂种子中的脂肪油高达36%、蛋白质的含量可达27%,种子油中含有饱和脂肪酸7%、芥子酸37%,叶片中含有大量的维生素C和胡萝卜素[6-8]。菥蓂是我国历版药典收录品种,有清肝明目、清热利尿、解毒、祛风湿等功效[9]。据报道菥蓂种子可治疗风湿性关节炎、胃痛、肝炎、痛风等[10]。目前,国内外对于菥蓂的研究主要集中在生物柴油原料[11-12]以及药用价值方面,而对于菥蓂植株的抗逆性目前少有报道。本研究主要利用水培的方式研究菥蓂植株在不同时间不同浓度NaCl处理下,其抗氧化酶活性、丙二醛含量、可溶性糖、可溶性蛋白、脯氨酸和叶绿素含量等多项生理生态指标的变化以及次生代谢产物含量的变化,为菥蓂耐盐植株的选择及在盐碱土地上的种植奠定理论基础。
1 材料与方法
1.1 试验材料
于2020年8月初,将菥蓂种植于东北林业大学森林植物生态学教育部重点实验室的温室内进行培育。待菥蓂种子萌发生长到4片叶时,将其移栽到改良的1/2 Hoagland’s营养液中培养适应一周,后更换为改良的Hoagland’s营养液进行培养。每隔3 d更换1次营养液,在最适条件下[昼夜温度(25±2)℃/(20±2)℃、pH值5.91、光暗周期16 h/8 h]培养30 d左右,即可进行不同浓度的盐胁迫处理。
1.2 试验设计
选择长势一致的植株作为实验材料。用Hoagland’s营养液配置NaCl浓度为50(S1)、100(S2)、150(S3)、200 mmol·L-1(S4)的处理液,以不加NaCl的Hoagland’s营养液作为空白(对照,CK),每个浓度梯度设置3个重复。分别在处理的第1、5、10、15天下午1:00采集各浓度梯度菥蓂叶片,选取植株功能叶片随机取样,立即放入液氮中,后存于-80℃超低温冰箱中,用于各种生理生态指标以及黑芥子苷、总酚、总黄酮次生代谢产物含量的测定。
1.3 测定指标及方法
1.3.1 生理指标测定 超氧化物歧化酶(superoxide dismutase,SOD)活性的测定采用氮蓝四唑(NBT)光化还原法;过氧化物酶(peroxidase,POD)活性的测定采用愈创木酚法;过氧化氢酶(catalase,CAT)活性的测定采用紫外吸收法;丙二醛(malondialdehyde,MDA)含量的测定采用硫代巴比妥酸(TBA)比色法;脯氨酸(proline,PRO)含量的测定采用酸性茚三酮染色法;可溶性糖(soluble sugar,SS)含量的测定采用蒽酮比色法;可溶性蛋白(soluble protein,SP)含量的测定采用考马斯亮蓝G-250染色法,以上方法均参考高俊凤[13]的方法进行测定。
1.3.2 光合指标测定 叶绿素含量测定[14]:称取菥蓂叶片0.05 g,将其剪碎放入具塞试管中,每组3次重复,再向试管中加入5 mL二甲基亚砜(dimethyl sulfoxide,DMSO)溶液,黑暗下60℃水浴反应4 h,直至用肉眼观察叶子颜色变白为止。叶绿素被DMSO浸提干净后,进行测定,以DMSO作为对照,在663、646、470 nm波长下测定吸光度。
待菥蓂植株盐胁迫达到相应的天数时,在取样前测定NaCl胁迫下菥蓂光合参数,于晴朗的上午9:00左右,采用便携式光合测定仪(Li-6400,美国LI-COR公司)进行植物净光合速率、蒸腾速率等光合指标以及叶绿素荧光参数的测定,每个处理设置3次重复,每株选择3个功能相同的叶片,取平均值。选取菥蓂长势相近的叶片,用夹子夹住待测叶片,进行15 min暗适应,后用便携式调制叶绿素荧光仪(PAM-2500,德国WALZ公司)进行最大光化学效率的测定,每个处理设置3次重复,每株选择3个功能相同的叶片,取平均值。
1.3.3 次生代谢产物的测定 总酚、总黄酮含量测定:称取菥蓂烘干后的叶片0.5 g,研磨成粉状倒入50 mL具塞离心管中,每组3次重复,向离心管中加入甲醇25 mL,称其重量并计数,然后进行超声处理(250 W,40 kHz)30 min,室温静置,再次称重并用甲醇补足损失的重量,摇匀离心(10000 r·min-1,20 min),后吸取上清液,用于测定总酚、总黄酮含量。采用福林酚法[15]测定总酚含量,氯化铝比色法[15]测定总黄酮含量。
黑芥子苷的含量测定[16]:选取菥蓂叶片2 g置于预冷的研钵中,加入40%乙醇5 mL在冰上研磨形成匀浆,每组3次重复,将匀浆转移到50 mL离心管中,再用40%乙醇10 mL冲洗2~3次研钵,摇匀后放入4℃冰箱静置30 min,将其超声处理(250 W,40 kHz)1.5 h后过滤,滤液用于黑芥子苷含量的测定。采用高效液相色谱(high performance liquid chromatography,HPLC)法测定菥蓂叶片中黑芥子苷的含量。
1.4 数据分析
采用Microsoft Excel 2019和Origin 2018进行数据统计及绘图,用SPSS 21.0进行差异显著性分析。
2 结果与分析
2.1 NaCl胁迫对菥蓂生长状况的影响
由图1可以看出,随着NaCl浓度的增加和胁迫时间的延长,在盐胁迫的第1、5天变化不是很明显,可以正常生长;在胁迫第10天,S2、S3和S4叶片逐渐变黄变小卷曲,长势稀疏;在胁迫的第15天,叶片大部分变黄,S3和S4处理菥蓂生长明显受到抑制,叶片萎蔫直至死亡。

图1 NaCl胁迫对菥蓂生长状况的影响Fig.1 Effect of NaCl stress on the growth of T.arvense
2.2 NaCl胁迫对菥蓂叶片抗氧化酶活性和丙二醛含量的影响
由图2可以看出,一定程度的盐胁迫会提高SOD活性,随着NaCl浓度的不断增加,SOD活性呈现先增加后减小的趋势,低浓度盐胁迫下SOD活性高于CK,第5天时S1处理SOD活性达到最大值,为471.63 U·g-1·h-1。POD活性随着NaCl浓度的不断增加呈现先增后减的趋势,在盐胁迫的第1天变化不明显,随着胁迫时间的延长,POD活性变化幅度也逐渐增大,并在NaCl浓度为100 mmol·L-1时,活性达到最高。CAT活性随着NaCl浓度的不断增加,呈现明显的先增加后减小趋势,在S2处理,活性达到最高,在胁迫第15天,处理组CAT活性均高于CK。MDA含量随着NaCl浓度的不断增加,呈现先升高后降低的趋势;在盐胁迫第1天时,叶片中MDA含量变化幅度不大,随着盐胁迫时间的延长,变化幅度逐渐增大,含量逐渐增加,在盐胁迫第15天,S2处理含量达到最高,为CK的3.18倍。

图2 NaCl胁迫对菥蓂叶片抗氧化酶活性和MDA含量的影响Fig.2 Effect of NaCl stress on antioxidant enzyme activity and MDA content of T.arvense
2.3 NaCl胁迫对菥蓂叶片渗透调节物质的影响
2.3.1 NaCl胁迫对菥蓂叶片可溶性糖和脯氨酸含量的影响 由图3可以看出,SS含量随着NaCl浓度的增加、胁迫时间的延长呈现上升的趋势,并且随着时间的延长含量上升的幅度也逐渐增大。在胁迫第15天,上升现象极为明显,在S3处理时SS含量达到80.12 mg·g-1。盐胁迫的第1、5、10天,随着NaCl浓度的升高,PRO含量呈现上升的趋势。在盐胁迫的第15天,随着NaCl浓度的升高,PRO含量呈现先上升后下降的趋势,并在S3处理下达到最高,含量是CK的3倍。

图3 NaCl胁迫对菥蓂叶片可溶性糖和脯氨酸含量的影响Fig.3 Effect of NaCl stress on soluble sugar and PRO contents of T.arvense
2.3.2 NaCl胁迫对菥蓂叶片可溶性蛋白含量的影响 由图4可以看出,在盐胁迫的第1天,随着NaCl浓度的不断增加,SP含量也逐渐增加;在盐胁迫第10、15天,随着NaCl浓度的不断增加,SP含量呈现先增加后减少的趋势。

图4 NaCl胁迫对菥蓂叶片可溶性蛋白含量的影响Fig.4 Effect of NaCl stress on soluble protein content of T.arvense
2.4 NaCl胁迫对菥蓂叶片光合作用的影响
2.4.1 NaCl胁迫对菥蓂叶片叶绿素含量和叶绿素荧光的影响 由图5可以看出,在盐胁迫的第1天,菥蓂叶片中叶绿素a、叶绿素a+b含量呈现先上升后下降的趋势,而叶绿素b含量呈现上升趋势,趋势幅度很小。随着盐胁迫时间的增加,在盐胁迫的第5、10、15天,叶片中叶绿素a、叶绿素b、叶绿素a+b的含量均随着NaCl浓度的升高逐渐减小。盐胁迫对菥蓂叶片最大光化学效率略有影响,但变化幅度不大,随着NaCl浓度的升高和胁迫时间的延长逐渐降低。

图5 NaCl胁迫对菥蓂叶片叶绿素含量和叶绿素荧光的影响Fig.5 Effect of NaCl stress on chlorophyll content and chlorophyll fluorescence of T.arvense
2.4.2 NaCl胁迫对菥蓂叶片净光合速率和蒸腾速率的影响 由图6可以看出,随着NaCl浓度的升高和胁迫时间的延长,菥蓂叶片净光合速率和蒸腾速率均呈下降趋势。

图6 NaCl胁迫对菥蓂叶片净光合速率和蒸腾速率的影响Fig.6 Effect of NaCl stress on net photosynthetic rate and transpiration rate of T.arvense
2.5 NaCl胁迫对菥蓂叶片中次生代谢产物含量的影响
2.5.1 NaCl胁迫对菥蓂叶片中总黄酮和总酚含量的影响 由图7可以看出,总黄酮含量随着NaCl浓度的升高呈现先增加后减少的趋势,在盐胁迫的第1天,随NaCl浓度升高菥蓂叶片中总黄酮的含量均低于CK,但在盐胁迫的第5、10、15天,S2处理下均高于CK。在盐胁迫的第1、5天,总酚含量随着NaCl浓度的升高呈现增加的趋势;在盐胁迫的第10、15天,总酚含量随着NaCl浓度的升高呈现先增加后减少的趋势。并且盐胁迫处理的菥蓂叶片中总酚的含量均低于CK。
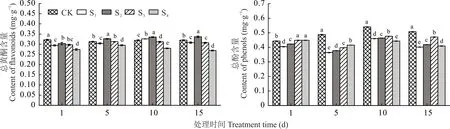
图7 NaCl胁迫对菥蓂叶片总黄酮和总酚含量的影响Fig.7 Effect of NaCl stress on the total flavonoids and phenols contents of T.arvense
2.5.2 NaCl胁迫对菥蓂叶片中黑芥子苷含量的影响 由图8可以看出,菥蓂叶片中黑芥子苷的含量在盐胁迫的第1天随NaCl浓度的升高呈现先增加后减少的趋势,处理后的含量均低于CK;在盐胁迫的第5、10天,S1处理黑芥子苷含量高于CK,并在第5天的S1处理达到最高(2.11 g·kg-1)。在盐胁迫第15天,随NaCl浓度的升高黑芥子苷含量逐渐减少。

图8 NaCl胁迫对菥蓂叶片黑芥子苷含量的影响Fig.8 Effect of NaCl stress on sinigrin content of T.arvense
3 讨论与结论
3.1 NaCl胁迫对菥蓂叶片生长的影响
NaCl胁迫会对植物的外观形态造成直接的影响,有研究表明,当植物遭受胁迫时,其外部形态可以作为衡量植物抗盐性的指标[17]。当植物受到一定程度的盐胁迫时,叶片会表现出明显的盐害症状,并且随着盐胁迫浓度的增加和胁迫时间的延长,植物的响应速率和损害程度也不同[18-20]。本研究结果显示,菥蓂植株在NaCl处理浓度为50~100 mmol·L-1时,可以保持正常的生理活动,在NaCl处理浓度为50 mmol·L-1的低盐中,植株叶片浓绿茂盛,根系发达,与对照相比长势优异。随着胁迫时间的延长,当NaCl处理浓度达到200 mmol·L-1时,植物生长明显受到抑制,植株变矮,叶片发黄萎蔫,植株根系出现腐烂现象。由此可以表明菥蓂植株在低盐胁迫时具有很好的适应性,可正常生长,而在盐浓度≥200 mmol·L-1时,对植物生长生理造成了严重的伤害。
3.2 NaCl胁迫对菥蓂叶片质膜结构及抗氧化酶活性的影响
细胞膜是植物细胞与外界联系的第一道防线,它的稳定性直接反映了植物细胞的代谢功能[21]。丙二醛(MDA)是脂质过氧化在植物中的最终产物,脂质是细胞膜的主要成分之一,因此MDA含量可以作为氧化应激的一个指标,通过测定MDA含量的变化来反映细胞膜的氧化损伤程度[22-23]。李赵嘉等[24]研究发现,当大叶蒲公英(Taraxacum mongolicum)处于低盐度胁迫时,MDA含量无显著变化,而当处于高盐胁迫(≥0.5%)时,MDA含量显著升高,高盐胁迫对大叶蒲公英的膜系统造成了损伤。本研究显示,在盐胁迫第1天,MDA含量随着盐胁迫浓度的增加呈现先升高后降低的趋势,变化趋势较小,说明菥蓂叶片对低盐胁迫具有一定的耐受性。但随着盐胁迫时间的延长,MDA含量显著增加,加剧叶片细胞膜过氧化的损伤,从而使细胞膜完整性受到严重损害[25]。同时体内的活性氧也会大量积累,而活性氧的增加会使细胞质膜发生过氧化,失去通透性,最终使植物细胞严重失水,植物体代谢紊乱。为了适应这种逆环境,植物体内的抗氧化酶(SOD、POD、CAT等)系统被激活,抗氧化酶可以清除植株体内过多的活性氧,从而保证细胞的正常功能和植株的正常生长[26-28]。本试验中,菥蓂叶片SOD、POD和CAT活性随着NaCl处理浓度增加呈现先上升后下降的趋势,这说明在一定浓度的盐胁迫下菥蓂叶片对胁迫环境做出适应性反应,但超过一定浓度后,活性氧自由基越来越多,抗氧化酶系统已不能有效清除体内多余自由基,导致叶片细胞内膜脂过氧化加剧,使SOD、POD和CAT的活性显著降低。在对醉马草(Achnatherum inebrians)、高羊茅(Festuca arundinacea)的研究中也得到了类似的结果,抗氧化酶活性随着盐胁迫程度增加呈现出先上升后下降的趋势[29],并且本研究与徐俊芝等[30]对芥菜(Brassica juncea)、何林池等[31]对棉花(Gossypiumspp.)的研究结果相一致。
3.3 NaCl胁迫对菥蓂叶片渗透调节物质的影响
渗透调节机制是植物抗盐性的重要机制,渗透调节具有调节叶片蒸腾与呼吸、维持正常光合等生理作用[32]。在盐胁迫下,植物细胞体内通过可溶性糖、可溶性蛋白、脯氨酸等小分子有机物的合成和大量积累从而减轻逆境对植物造成的伤害[33]。本研究显示,可溶性糖和脯氨酸含量随着NaCl处理浓度增加和胁迫时间的延长呈现上升趋势,并且随着时间的延长含量上升的幅度也逐渐增大,与李永洁等[34]和苏雅等[35]的研究结果一致;可溶性蛋白含量在盐胁迫的第1天随着NaCl浓度增加而升高,在盐胁迫的第5、10、15天,随着胁迫时间的延长可溶性蛋白含量呈现先增加后降低的趋势,这与陈意兰等[36]对蒭雷草(Thuarea involuta)的耐盐性研究成果相一致。以上研究表明菥蓂在受到盐胁迫时,可以通过增加可溶性糖、可溶性蛋白、脯氨酸含量来维持细胞的渗透平衡,使其在一定的盐胁迫下免受渗透伤害。
3.4 NaCl胁迫对菥蓂叶片光合作用的影响
光合作用作为植物体内重要的代谢过程,对植物的生长、抗性都有很重要影响,其中叶片叶绿素荧光与光合作用的反应过程密切相关,叶片叶绿素荧光可以反映环境因子对光合作用的影响[37]。有研究人员表明,盐胁迫会对植物的叶绿体结构造成破坏,从而使叶绿素含量下降,叶片的光合作用减弱[38]。也有学者认为低盐浓度胁迫可以增加叶绿素的含量,高盐浓度胁迫下叶绿素含量下降[39]。容晓峰等[40]发现当银杏(Ginkgo biloba)处在NaCl溶液浓度为50 mmol·L-1时,其光合作用有明显的促进作用,但随着NaCl溶液浓度的增加,银杏叶片的叶绿素含量、净光合速率、叶绿素荧光参数等光合作用指标均会下降。本研究中,盐胁迫降低了菥蓂的净光合速率、蒸腾速率、最大光化学效率,但在盐胁迫第1天,菥蓂叶片中叶绿素b含量随着NaCl处理浓度的增加呈上升趋势;叶绿素a、叶绿素a+b含量呈先上升后下降的趋势,且各处理的含量大部分高于CK,在盐胁迫第5、10、15天,叶绿素a、叶绿素b和叶绿素a+b含量随NaCl处理浓度的增加呈下降趋势,幅度逐渐增大,说明盐胁迫能够减少叶绿素合成,导致了菥蓂叶片光合色素的降解,这与Santos[38]的研究结果一致。
3.5 NaCl胁迫对菥蓂叶片次生代谢产物的影响
次生代谢过程是植物在长期进化中对生态环境适应的结果,很多研究表明,逆境胁迫可以促进植物次生代谢产物的合成,次生代谢产物在协调植物和环境的关系上起到重要作用[41]。洪森荣等[42]在研究三叶青(Tetrastigma hemsleyanum)两个栽培种试管苗发现,随着盐胁迫的不断加重,‘怀玉1号’和‘怀玉2号’试管苗叶片的黄酮和多酚含量呈先升后降趋势。本试验中,随着NaCl处理浓度的增加总酚的含量呈现逐渐上升的趋势,但低于CK;黄酮和黑芥子苷含量先增加后减少,说明逆境胁迫在一定程度上可提高单位质量菥蓂叶片中的次生代谢产物的含量。
通过对多项测定结果分析,可以看出菥蓂植株具有一定的耐盐性,但对盐环境的适应力有限,在低盐环境下可以通过增加抗氧化酶活性、渗透调节物质以及叶绿素含量等来保护细胞结构免受损伤,因此菥蓂可以在含盐质量分数较低的轻度盐土壤中生长。
