二氯喹啉酸及其代谢物残留的QuEChERS-UHPLC/MS/MS分析及其室内消解动态研究
2022-11-22范金平张盈魏进罗世霞段婷婷
范金平,张盈,魏进,罗世霞,段婷婷
1. 贵州省农业科学院植物保护研究所,贵阳 550092 2. 贵州师范大学化学与材料科学学院,贵阳 550025
二氯喹啉酸(quinclorac),又名快杀稗、稗草净、杀稗灵和神锄等[1],结构式如图1(a)所示,是一种激素类内吸式喹啉酸类芽前、芽后低毒性除草剂,常用于稗草的防治[2],它的作用方式是过度刺激生长,导致细胞膜破裂。由于具有施用适期宽、剂量小、防治效果好及持效期长等优点,常被广泛运用于防除稻田杂草[3]。据相关报道,中国使用的除草剂中二氯喹啉酸的使用量排在前十,平均每年的销售额达4 121万美元[4]。但由于其持效期长,在土壤中易于积累而影响后茬作物的生长发育[5-6],导致后茬作物畸形生长;例如,在烟-稻轮作系统下,施用超过推荐剂量25%时二氯喹啉酸会增加后茬作物烟叶的畸形率,从而使烟叶产量降低[7]。此外,残留在环境中的二氯喹啉酸会导致动物生长发育不良,生殖异常以及变态发育[8]。因此,人们也越来越重视其对动植物产生的危害。目前有关二氯喹啉酸代谢途径的研究很少,在微生物降解的研究中发现分枝杆菌(Mycobacteriumsp.)F4可以通过脱氯的方式或羧基甲基化产生甲酯化合物[9],二氯喹啉酸甲酯(quinclorac methyl ester)是二氯喹啉酸的代谢物,结构式如图1(b)所示,其毒性略低于母体且会使肝脏、甲状腺等组织产生病理学变化,从而导致动物生长发育不良,且二氯喹啉酸甲酯在植物体内可以转化为二氯喹啉酸,二氯喹啉酸甲酯的半致死浓度(LD50)>2 000 mg·kg-1(鼠急性经口)[10]。
二氯喹啉酸检测的方法有气相色谱法[11-12]、液相色谱法[13-15]、生物测定法[16]和超高效液相色谱-质谱法[3,17-18]等。气相色谱法需要更换溶剂,操作比较复杂且检出限高;高效液相色谱法受基质干扰较大;生物测定方法受环境影响较大;液质联用法有检测时间短、灵敏度高、定性能力好等特点。黄思琦等[3]采用液相色谱-串联质谱法测定处于模拟自然条件下稻田环境中的水稻植株、土壤和水中二氯喹啉酸的残留,采用被酸化乙腈作为提取溶剂,分散固相萃取净化,操作简单,灵敏度高,但并未测定代谢物二氯喹啉酸甲酯的残留量;对于二氯喹啉酸及其代谢物的检测方法,王一茹等[11]利用气相色谱同时检测二氯喹啉酸及其代谢物二氯喹啉酸甲酯的残留量,但该方法需使用甲基化试剂(重氮甲烷)将样品转化为甲酯后进行检测,该方法前处理复杂,溶剂量大,分析时间长。QuEChERS(quick, easy, cheap, effective, rugged, safe)方法的样品平均回收率高于85%,干扰物质少,溶剂量小,操作简便、快速。本研究运用改进的QuEChERS,选用不同提取剂(乙腈、含有1%乙酸的乙腈)、不同种类的净化剂N-丙基乙二胺(PSA),C18,C18+石墨化碳黑(GCB),PSA+GCB;结合UPLC-MS/MS分析方法同时检测旱地土、水稻土中二氯喹啉酸及其代谢物二氯喹啉酸甲酯残留,同时研究土壤中二氯喹啉酸在室内条件下的残留消解。明确二氯喹啉酸在土壤中的降解情况为二氯喹啉酸的生态风险评价和二氯喹啉酸的合理使用提供依据。
1 材料与方法(Materials and methods)
1.1 仪器、试剂与材料
UItimate 3000/TSQ Vantage型超高效液相色谱-串联质谱(UHPLC-MS/MS,美国Thermo Fisher公司);ACQUITY UPLC型HSS T3 C18色谱柱(50 mm×2.1 mm,1.8 μm);高通量组织研磨器(CK200型,北京托摩根生物有限公司,中国),电子分析天平(BSA224S-CW,精度为0.0001 g,德国Sartorius公司);多管涡旋仪(MS200,杭州瑞诚仪器有限公司,中国);台式高速离心机(TG16-11型,湖南平凡科技有限公司,中国);0.22 μm有机滤膜(日本岛津公司)。

图1 二氯喹啉酸和二氯喹啉酸甲酯结构式Fig. 1 The structural formula of quinclorac and quinclorac methyl ester
二氯喹啉酸(99.2%,沈阳化工研究院农药检验室国家农药质量监督检验中心,中国)、二氯喹啉酸甲酯(98.0%,Dr. Ehrenstorfer公司,德国)标准品。色谱纯甲醇,分析纯乙腈,色谱纯甲酸,分析纯乙酸;实验用水为屈臣氏蒸馏水。
1.2 土壤样品的理化性质
旱地土和水稻土分别取200 g,分析土壤理化性质,结果如表1所示。

表1 土壤理化性质Table 1 Soil physical and chemical properties
1.3 标准溶液的配制
准确分别称取二氯喹啉酸及其代谢物二氯喹啉酸甲酯标样0.0100 g (精确到0.0001 g),用色谱纯甲醇配制10 mL 1 000 mg·L-1的标准储备液,保存于4 ℃冰箱中。取二氯喹啉酸及其代谢物标准储备液适量,用色谱纯甲醇稀释制得二氯喹啉酸及其代谢物标准工作溶液,标准工作液浓度分别为30.0、3.0、0.3和0.01 mg·L-1。
1.4 设计试验
参考《化学农药环境安全评价试验准则标准》,采用室内培养法,设置不同处理。将土壤样品放在培养箱中,调节培养温度25 ℃、湿度60%,预培养14 d[19]。根据二氯喹啉酸的田间推荐剂量去设置2个水平的二氯喹啉酸处理和空白对照组[19]。根据中国农药信息网显示,采用了40 ghm-2,总有效成分含量为70%,按照土壤密度1.5 gcm-3,采取地表10 cm厚的土层来换算成单位质量土壤施药剂量[19],推荐剂量为0.3 mg·kg-1。最终用浓度为0 mg·kg-1(CK)、0.3 mg·kg-1(T1)、3 mg·kg-1(T10)。0为空白对照。T1为二氯喹啉酸田间最大田间推荐剂量,T10是10倍的推荐剂量。每个处理设置4个平行。实验过程中旱地土定期补充灭菌水,保持所有处理的土壤最大持水量维持在60%,水稻土用水淹没即可。采样时间1、7、15、30、60和100 d。采样后将样品保存于-80 ℃冰箱中。
1.5 样品的前处理与检测
准确称取5.00 g(精确到0.01 g)均质土壤试样于50 mL塑料离心管,加入5.0 mL屈臣氏蒸馏水,加入含1%乙酸的乙腈溶液10 mL,涡旋振荡10 min,加入5.00 g NaCl混匀,涡旋振荡5 min,5 000 r·min-1离心5 min,取上清液1.5 mL到2 mL离心管(装有50 mg C18)中,涡旋2 min,5 000 r·min-1离心5 min,取上清液过0.22 μm的有机滤膜,滤液加屈臣氏蒸馏水(V∶V=1∶1)后供超高效液相色谱串联质谱仪测定。
1.6 色谱与质谱条件
ACQUITY UPLC型C18色谱柱(50 mm×2.1 mm,1.8 μm);流速0.3 mL·min-1;柱温35 ℃;进样量5 μL;流动相A为0.1%的甲酸水,B为甲醇;洗脱程序:0~0.5 min 20% B;0.5~1.5 min 20%~95% B;1.5~3.5 min 95% B;3.5~4.5 min 95%~20% B;4.5~5.0 min 20% B。
ESI离子源,扫描方式为多反应监测(MRM)模式,毛细管电压3.2 kV,离子源温度350 ℃,脱溶剂温度330 ℃,辅助气(N2)流速3 L·min-1,鞘气(N2)流速9 L·min-1,碰撞气为氩气。二氯喹啉酸及其代谢物定性、定量离子对等质谱分析参数如表2所示。
1.7 基质效应
为考察基质效应(ME)的影响,采用标准曲线测定法来测定土壤的基质效应,即分析了空白土壤基质标准溶液和纯溶剂标准溶液,绘制标准曲线,以二者的斜率比来判定基质效应的强弱[20]。
式中:Sm为基质标准曲线的斜率,Ss为溶剂标准曲线的斜率[20]。
当ME为0时,表明不存在基质效应的影响;当ME为-20%~20%时表明存在弱基质效应;当ME为-50%~-20%或20%~50%时表明存在中等基质效应;当ME≤-50%或>50%时表明存在强基质效应[21]。
2 结果与讨论(Results and discussion)
2.1 色谱、质谱条件的确定
二氯喹啉酸及其代谢物二氯喹啉酸甲酯采用ESI+源,标准品直接进样,在MRM模式下进行分析。黄思琦等[3]和梁亚杰等[22]在研究二氯喹啉酸时都采用了ESI源,在质量过滤器(Q1)检测母离子;碰撞反应室(Q2)的碰撞器施加一定电压,母离子被击碎产生相应的碎片离子;质量过滤器(Q3)只检测特征碎片。在Q1下把二氯喹啉酸和二氯喹啉酸甲酯区分开,再经过液相色谱柱的分离,使二氯喹啉酸和二氯喹啉酸甲酯保留时间不同。结合标准液进样和保留时间选择相对丰度最高的子离子用于定量,第二高的用于定性。二氯喹啉酸及二氯喹啉酸甲酯离子的裂解方式及相应的子离子如图2所示。

表2 二氯喹啉酸及二氯喹啉酸甲酯的保留时间及质谱分析参数Table 2 Retention times and MS/MS parameters of quinclorac and quinclorac methyl ester

图2 二氯喹啉酸甲酯和二氯喹啉酸分子离子的裂解方式及相应的子离子Fig. 2 The cleavage mode of quinclorac methyl ester and quinclorac and the corresponding product ions
二氯喹啉酸及其代谢物二氯喹啉酸甲酯在C18色谱柱上保留效果好,梯度洗脱,提高样品的分析效率并减少了强保留杂质在色谱柱的积累。试验选择了甲醇-0.1%甲酸水溶液、0.1%甲酸水-乙腈组成的流动相体系,研究了不同流动相对二氯喹啉酸及二氯喹啉酸甲酯洗脱效果的影响。以甲醇-0.1%甲酸水为流动相时,二氯喹啉酸及二氯喹啉酸甲酯能获得较好的色谱峰和稳定的信号强度。因此流动相采用甲醇-0.1%甲酸水溶液,在梯度洗脱条件下,溶剂标准溶液色谱图如图5(b)所示。
2.2 净化方法的选择
2.2.1 提取剂的选择
QuEChERS方法中,乙腈为常用的提取溶剂[23],溶解性能好,能够溶解多种物质包括有机、无机以及气体等。由于不同农药结构的不同,pH对提取效果影响较大,实验人员在乙腈中加入不同比例的试剂,如乙酸,取得了更好的回收率[24-26]。参考黄思琦等[3]采用酸化的乙腈作为提取剂,比较了乙腈、1%乙酸乙腈为提取剂时2种土壤的加标回收率。以乙腈为提取剂时(n=6),旱地土和水稻土中二氯喹啉酸的平均回收率分别为25.15%、25.21%,低于NY788—2018标准中所允许的回收率范围(70%~120%)[27];以1%乙酸乙腈为提取剂时,旱地土和水稻土中的二氯喹啉酸的平均回收率分别为86.17%、80.10%(图3);因此选择1%乙酸乙腈为提取剂。1%乙酸乙腈的pKa值为7.642,而二氯喹啉酸的pKa值为4.34。杨丽华[28]研究了得出了高岭石对二氯喹啉酸的吸附量随着pH值的增加而减少,在pH值为4时,其吸附量达到最大值,再加上二氯喹啉酸具有羧基显酸性,根据原理,所以1%乙酸乙腈有利于二氯喹被提取。
2.2.2 净化剂的选择
PSA中含2个氨基,属于氨基吸附剂,通过氢键能够除去有机酸、脂肪酸和糖等物质;C18是一种非极性、广谱性的净化剂,能有效去除提取液中微量的非极性杂质;GCB吸附剂表面有极强的吸附性,能够去除色素。梁亚杰等[22]在测定二氯喹啉酸及其代谢物在糙米中的残留时选用的净化剂中含有C18;本研究分别以PSA、C18、C18+GCB,PSA+GCB为净化剂比较其回收率(n=6)。旱地土采用C18为净化剂时二氯喹啉酸的平均回收率(86.17%)优于PSA、PSA+GCB、C18+GCB为净化剂时二氯喹啉酸的平均回收率(45.84%、40.66%、46.54%),水稻土采用C18为净化剂时二氯喹啉酸的平均回收率(80.10%)优于PSA、PSA+GCB、C18+GCB为净化剂时二氯喹啉酸的平均回收率(49.81%、40.46%、54.96%),如图4所示。
2.3 基质效应、方法的线性范围与定量限
采用旱地土、水稻土基质空白溶液及溶剂配制二氯喹啉酸及其代谢物二氯喹啉酸甲酯质量浓度为1 500、750、150、75、15、7.5、1.5和0.25 ng·mL-1的标准溶液,在步骤1.6优化后的试验条件下测定,横坐标为标准溶液的质量浓度(x,ng·mL-1),纵坐标(y)为相应的峰面积,绘制标准曲线,二氯喹啉酸的回归方程和相关系数如表3所示。结果显示,二氯喹啉酸及其代谢物二氯喹啉酸甲酯在0.25~1 500 ng·mL-1浓度范围内均呈良好的线性关系,回归分析可决系数(R2)为0.9993~1.0000。通过添加回收实验,以最小添加浓度作为方法的定量限(LOQ),二氯喹啉酸及其代谢物二氯喹啉酸甲酯方法LOQ为0.001 mg·kg-1,结果如表3所示。

图3 不同提取剂条件下旱地土和水稻土中二氯喹啉酸及其代谢物二氯喹啉酸甲酯加标回收率Fig. 3 Recovery rates of quinclorac and quinclorac methyl ester in dryland soil and paddy soil with different extracting solution
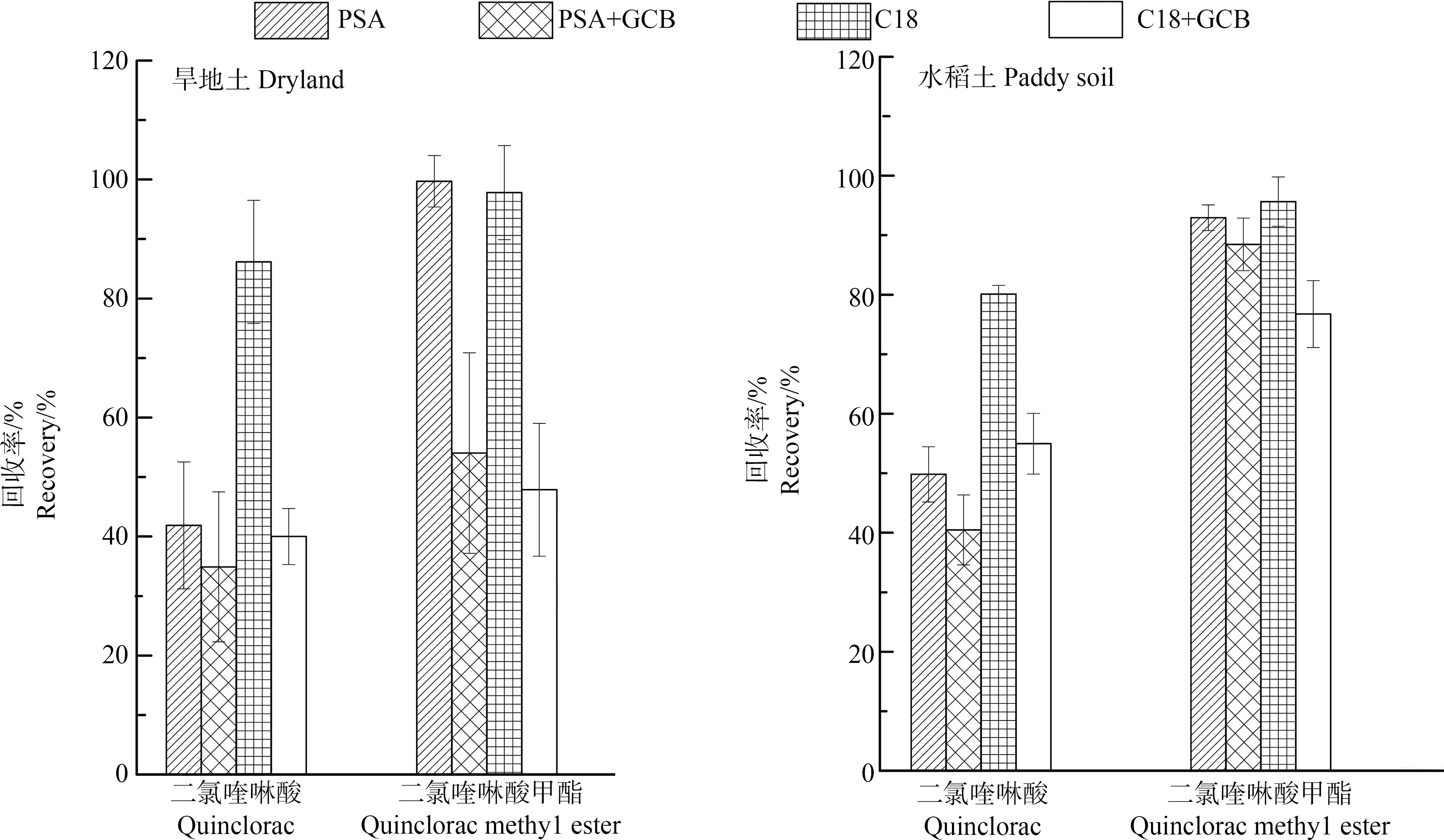
图4 不同净化剂条件下旱地土和水稻土中二氯喹啉酸及其代谢物二氯喹啉酸甲酯加标回收率注:PSA表示N-丙基乙二胺;GCB表示石墨化碳黑。Fig. 4 Recovery rates of quinclorac and quinclorac methyl ester in dryland soil and paddy soil with different purifying agentNote: PSA means N-(n-propyl) ethylendiamine; GCB means graphitized carbon black.
2.4 添加回收试验结果
用不含二氯喹啉酸及其代谢物二氯喹啉酸甲酯的水稻土和旱地土做添加回收实验。结果显示,在0.001、0.030、0.300和3.00 mg·kg-14个添加水平下,旱地土、水稻土中二氯喹啉酸及其代谢物二氯喹啉酸甲酯的回收率在78.20%~110.58%之间,相对标准偏差(RSD)在1.43%~8.98%之间,表明本方法均有较好的精密度和准确度,符合农药残留分析的要求(表4)。水稻土(加标浓度0.3 mg·kg-1)的MRM图谱如图5(c)所示。
如图5所示,空白水稻土中不含二氯喹啉酸及其代谢物二氯喹啉酸甲酯,100 d后水稻土中还有二氯喹啉酸,并且有二氯喹啉酸甲酯生成。
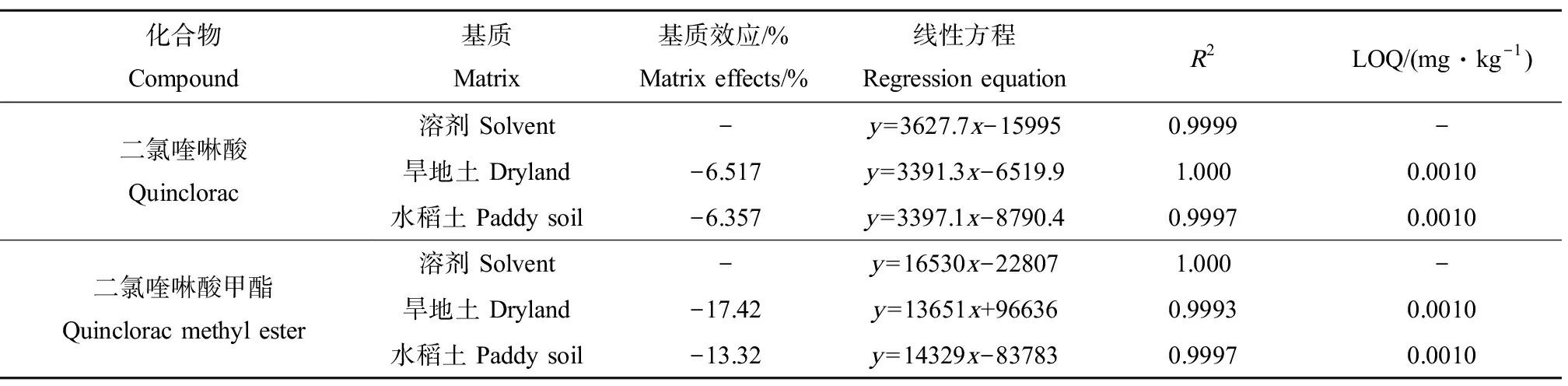
表3 二氯喹啉酸及其代谢物二氯喹啉酸甲酯的基质效应、回归方程、可决系数(R2)和定量限(LOQ)Table 3 Matrix effects, regression equations, coefficient of determination (R2) and limit of quantification (LOQ) of quinclorac and quinclorac methyl ester

表4 旱地土、水稻土中二氯喹啉酸及其代谢物二氯喹啉酸甲酯的加标回收率和RSD (n=6)Table 4 Spiked recoveries and RSD of quinclorac and quinclorac methyl ester in dryland soil and paddy soil (n=6)

图5 空白水稻土基质中二氯喹啉酸及二氯喹啉酸甲酯溶剂标和水稻土添加条件下水稻土样品色谱图注:(a) 水稻土空白;(b) 0.075 mg·kg-1浓度溶剂标;(c) 0.3 mg·kg-1添加;(d) 水稻土100 d样品。Fig. 5 Chromatography of paddy soil matrix blank, quinclorac and quinclorac methyl ester solvent standard and matrix standard, sample with quinclorac and quinclorac methyl ester in paddy soilNote: (a) Paddy soil blank; (b) 0.075 mg·kg-1 solvent standard; (c) 0.3 mg·kg-1 addition; (d) 100 d sample of paddy soil.
2.5 室内培养条件下二氯喹啉酸在2种土壤中的降解动态及二氯喹啉酸基质的生成
经过100 d室内培养,二氯喹啉酸在2种土壤中的消解情况呈现出先快后慢的变化趋势。2个水平的二氯喹啉酸在水稻土中的初始沉积量分别是0.2678 mg·kg-1和2.823 mg·kg-1,在旱地土中分别是0.2519 mg·kg-1和2.387 mg·kg-1。随着实验时间的延长,二氯喹啉酸的残留量逐渐降低。施药100 d后2个水平的二氯喹啉酸在水稻土中的消解率T1为65.09%,T10为64.32%;旱地土T1为27.03%,T10为13.99%。施药100 d后水稻土中二氯喹啉酸最终残留量分别为0.0935 mg·kg-1和1.007 mg·kg-1,旱地土中二氯喹啉酸最终残留量分别为0.1838 mg·kg-1和2.053 mg·kg-1。
二氯喹啉酸的消解动态及二氯喹啉酸甲酯的生成如图6所示。二氯喹啉酸在土壤中的消解动态参数如表5所示。二氯喹啉酸在2种土壤中的半衰期在96~702 d之间,培养100 d后土壤中仍有较高浓度的二氯喹啉酸残留,7 d以后在有氧培养的旱地土中就有二氯喹啉酸甲酯生成,60 d后在厌氧水稻土中才有二氯喹啉酸甲酯生成。所以,残留的二氯喹啉酸对土壤微生物长期风险是可能存在的,会导致动物生长发育不良、发育异常以及生殖异常,从而影响自然界动物的多样性和丰度[29],二氯喹啉酸甲酯的残留量均<0.1 mg·kg-1,低于国家标准中规定的二氯喹啉酸在水稻上的最大残留量(1 mg·kg-1),但由于其在植物体内可以转化为二氯喹啉酸[30],所以二氯喹啉酸残留物的问题不容忽视。

图6 二氯喹啉酸在旱地土和水稻土中的消解及二氯喹啉酸甲酯在旱地土和水稻土中的生成Fig. 6 The dissipation of quinclorac and generation of quinclorac-methyl ester in dryland soil and paddy soil

表5 二氯喹啉酸在旱地土和水稻土中的消解动态参数Table 5 Dissipation parameters of quinclorac in dryland soil and paddy soil
