大鼠Gpnmb基因表达线性回归模型在损伤时间推断中的应用
2022-11-21郗延如刘元新冯娜谷祯孙俊红曹洁靳茜茜杜秋香
郗延如,刘元新,冯娜,谷祯,孙俊红,曹洁,靳茜茜,杜秋香
山西医科大学法医学院,山西 太原 030001
损伤时间推断一直是法医学工作中的重点和难点。目前研究已证实,多种mRNA 在损伤修复中呈时序性变化,可出现表达增强、表达降低或表达沉默的模式,不同mRNA表达的时间顺序和峰值也不相同[1-2]。机体死后,由于受到尸体保存温度、细胞内核酸酶活性变化等因素影响,部分mRNA 的降解与死亡时间(postmortem interval,PMI)呈一定规律性,机体死后保存温度的升高也会加速mRNA 降解[3-6]。由此,利用mRNA 的表达推断损伤时间可能会受到死亡时间及尸体保存温度的影响。
本研究从高通量测序获得的差异基因中筛选出与炎症相关的非转移性黑色素瘤糖蛋白B(glycoprotein non-metastatic melanoma protein B,Gpnmb),有研究[7-8]结果表明,该基因参与组织损伤后的炎症反应和纤维化与损伤修复过程密切联系,在机体损伤后其表达升高。本研究拟采用实时定量反转录聚合酶链反应(reverse transcription real-time quantitative polymerase chain reaction,RT-qPCR)技术检测不同损伤时间、死亡时间及死后保存温度下大鼠骨骼肌中GpnmbmRNA 的表达量,探究GpnmbmRNA 表达与损伤时间、死亡时间及死后保存温度的相关性,建立mRNA 表达与损伤时间的线性回归模型,并在此基础上研究GpnmbmRNA 在损伤时间推断中的作用。
1 材料与方法
1.1 主要试剂和仪器
TRIzol Reagent 购自美国Invitrogen 公司,Prime-ScriptTMRT Master Mix(Perfect Real Time)和Premix Ex TaqTM(Probe qPCR)购自日本TaKaRa 公司。
2-16PK 型台式冷冻离心机购自德国Sigma 公司,Infinite®200 PRO Nano Quant 检测仪购自瑞士TECAN 公司,CFX384 TouchTM荧光定量PCR 检测系统购自美国BIO-RAD 公司。
1.2 大鼠骨骼肌挫伤模型的建立和检材提取
由山西医科大学实验动物中心提供健康雄性成年SD 大鼠共147 只,6~8 周龄,体质量为200~230 g,其中126 只为实验组,21 只为验证组。将实验组大鼠随机分为损伤后0 h、4 h、8 h、12 h、16 h、20 h 和24 h组,每组18 只,使用3%戊巴比妥钠溶液腹腔注射(0.13 mL/100 g)麻醉大鼠,去除其右后肢股四头肌处毛发,将500 g 重力锤从高30 cm 处自由落体砸于大鼠右后肢股四头肌处[9]。将大鼠按设置的时间点颈椎脱臼处死,在0 ℃、16 ℃、26 ℃ 3 个温度下各保存6 只,于死后0 h、12 h、24 h 重复收集肌肉样本(死后0 h 仅取材于其中一个温度组)。每次取大鼠右后肢股四头肌损伤处肌肉组织100 mg 置于液氮中,-80 ℃保存。验证组大鼠分组与处理方式同上,每个损伤组3 只大鼠,死后分别保存在0 ℃、16 ℃、26 ℃下并连续取材。
本研究已通过山西医科大学的伦理审查(审批文号:2019LL095)。
1.3 总RNA 提取与RT-qPCR 检测
使用TRIzol Reagent 提取总RNA,并使用Infinite®200 PRO Nano Quant 检测仪测量总RNA 纯度及浓度,D260/D280在1.8~2.0 可进行后续实验。将400 ng 总RNA 用PrimeScriptTMRT Master Mix(Perfect Real Time)反转录为cDNA。
按照Premix Ex TaqTM(Probe qPCR)试剂盒操作说明书配制反应混合液,使用CFX384 TouchTM荧光定量PCR 检测系统进行qPCR。反应条件:95 ℃30 s,95 ℃ 5 s,62 ℃ 40 s,40 个循环。反应体系为25 μL,包括:TaqDNA 聚合酶12.5 μL,目的基因和内参基因的上下游引物及探针(各0.5 μL)共3 组,去离子水4 μL,cDNA 4 μL。5 倍浓度梯度稀释cDNA,将其作为模板进行qPCR,得到标准曲线,测量内参基因Rpl13、Rpl32及目的基因Gpnmb的扩增效率,扩增效率在90%~110%范围内、相关系数在0.980 以上,可认为体系稳定、扩增良好,可用于后续实验。各组取4 μL cDNA 样本分别加入反应体系,对内参基因和目的基因进行复合扩增,利用2-ΔΔCt法[2]得到GpnmbmRNA 的相对表达量。内参基因Rpl13、Rpl32[10]及目的基因Gpnmb的序列均来自GenBank(http://www.ncbi.nlm.nih.gov/),利用Allele ID 6.0 软件(北京天演融智软件有限公司)进行引物及探针设计,经BLAST检索确认其特异性,由生工生物工程(上海)股份有限公司合成。引物及探针序列详见表1。

表1 引物及探针序列Tab.1 Sequences of primers and probes
1.4 统计分析
2 结果
2.1 Gpnmb mRNA 的提取及表达
所有样本均成功提取RNA,总RNA 的D260/D280值在1.8~2.0。5 倍浓度梯度稀释cDNA 原液进行标准品制备,测得目的基因(Gpnmb)和内参基因(Rpl13、Rpl32)的扩增效率分别为107.4%、104.9%、104.2%,相关系数分别为0.996、0.996、0.999,可用于后续实验。
单因素方差分析结果显示:死亡时间组间差异无统计学意义(P>0.05);死后保存温度组间差异无统计学意义(P>0.05);损伤时间组间差异具有统计学意义(P<0.05),经LSD 检验,各损伤组间差异均有统计学意义(P<0.05)。如表2 所示,大鼠死后分别保存在0 ℃、16 ℃、26 ℃中0 h、12 h、24 h,GpnmbmRNA 在骨骼肌损伤后主要呈持续上调的表达模式。
表2 不同死亡时间、死后保存温度下Gpnmb mRNA 随损伤时间的表达Tab.2 The expression of Gpnmb mRNA varied with the injury time at different time of death and postmortem storage temperature (n=6,)
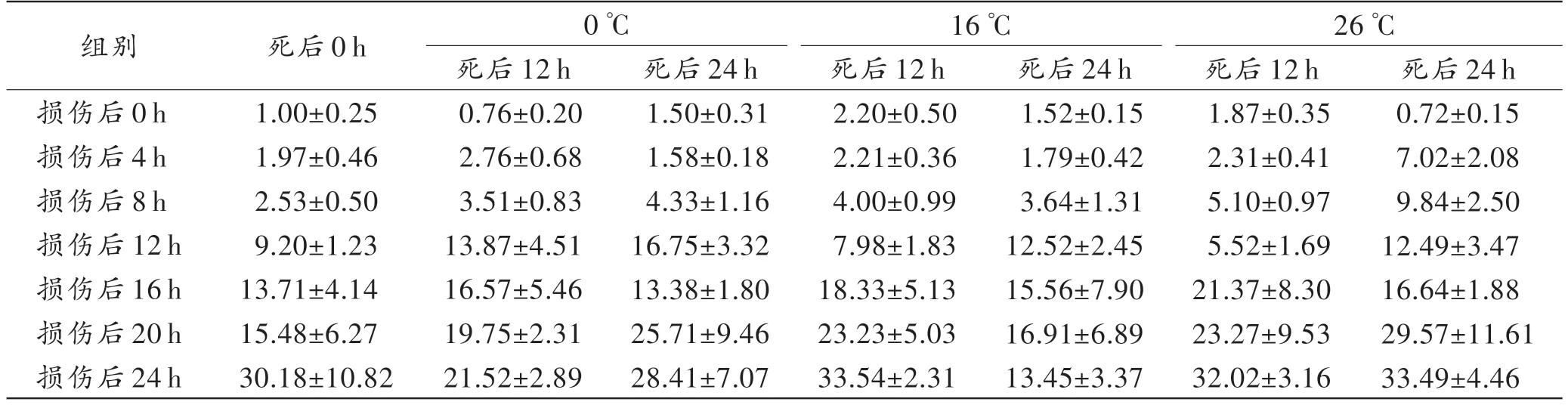
表2 不同死亡时间、死后保存温度下Gpnmb mRNA 随损伤时间的表达Tab.2 The expression of Gpnmb mRNA varied with the injury time at different time of death and postmortem storage temperature (n=6,)
注:各损伤组间差异均有统计学意义(P<0.05)。
2.2 相关性及线性回归模型的建立
损伤时间与GpnmbmRNA 相对表达量的Pearson相关系数为0.837,两变量间呈高度正相关(P<0.05)。死亡时间、死后保存温度与GpnmbmRNA 相对表达量的Pearson 相关系数分别为0.055(P>0.05)、0.008(P>0.05),差异无统计学意义,可认为死亡时间、死后保存温度两变量与GpnmbmRNA 相对表达量基本不相关,可在模型中排除。
剔除死亡时间和死后保存温度这两个影响因素后,建立损伤时间(y)与GpnmbmRNA 相对表达量(x)的回归模型为y=0.611x+4.489。该回归模型经方差检验具有统计学意义(R2=0.701,F=685.774,P<0.05)。
2.3 回代检验
将验证组数据代入拟合的回归方程,损伤时间预测值的均值与实际值最小相差0.63 h,最大相差4.82 h(图1)。配对样本t检验结果显示,损伤时间预测值和实际值之间差异无统计学意义(P>0.05),证明建立的回归模型具有较好的预测能力,可用于损伤时间推断。
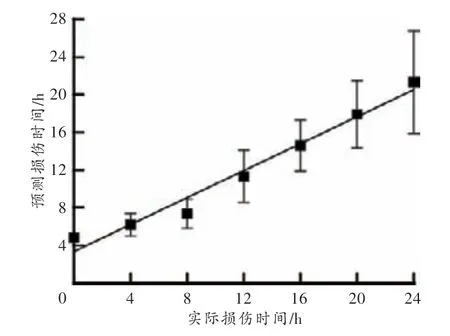
图1 回代检验结果Fig.1 Results of back-substitution test
3 讨论
机体损伤后局部的组织病理学、RNA 含量、蛋白水平、炎症细胞等改变对推断损伤时间均具有重要价值[11-12]。目前研究发现,多种mRNA 在机体损伤后呈时序性变化[2,13-14],也有研究已证实机体死后多种mRNA 在生物酶作用下降解速率不同,且尸体所处环境温度对降解速率影响很大[3,5,15-17]。由此可知,应用mRNA 推断生前损伤时间可能受到死亡时间和死后保存温度影响。
研究[7-8,18-19]发现,Gpnmb基因在成骨细胞、树突状细胞和巨噬细胞等多种细胞中高度表达,是炎症的负调节因子,对损伤有保护作用。正常情况下,Gpnmb基因在机体内处于低水平表达;机体损伤后,Gpnmb的表达随着骨髓源性巨噬细胞的极化和溶酶体应激而增高,并通过IL-4/STAT6 通路促进M2 型巨噬细胞的极化,发挥抑制免疫细胞活化、清除病原体、释放抗感染物质、维持纤维化和纤溶平衡的作用[7-8,20]。因此,Gpnmb基因的表达与组织损伤修复过程联系紧密。由于Gpnmb表达在人类基因组及其他物种间具有同质性,研究该指标在动物模型中的表达规律及作用能够为人体损伤时间推断提供参考[21]。
本研究应用RT-qPCR 技术探讨大鼠骨骼肌GpnmbmRNA 表达随损伤时间、死亡时间和死后保存温度的变化规律,通过Pearson 相关系数评价死亡时间、死后保存温度和损伤时间对GpnmbmRNA 表达的影响。结果表明,GpnmbmRNA 表达与死亡时间和死后保存温度不相关。因此,利用GpnmbmRNA推断损伤时间受到死亡时间或尸体保存温度等死后因素的影响较小或基本无影响。在此基础上进一步研究发现,GpnmbmRNA 在骨骼肌损伤后呈持续上调的表达模式,与损伤时间呈线性关系,建立的回归模型为y=0.611x+4.489,方差齐。通过回代检验可知,外部验证预测值与实际值最小相差0.63 h,最大相差4.82 h,模型预测较准确。因此,从本实验结果来看,GpnmbmRNA 表达量与损伤时间有很强的正相关性,即随着损伤时间的延长,GpnmbmRNA 的表达也随之增高,并且在死后24 h 内可以保持较高的稳定性,降解速率也几乎不受温度变化的影响。
已有研究证实,CAPN5、VEGFA、HAF等多种mRNA 的表达随死亡时间呈规律性变化[17,22];当温度升高时,CDC25B、ACTB、GAPDH等mRNA 的稳定性降低,且随着死亡时间的延长明显降解[23-24]。但也有研究[23]报道,在不同温度影响下,Rpl27、Copb1、Rbfox1等mRNA 在死后24 h 内基本无变化,但这些研究均未考虑大鼠不同损伤时间对mRNA 的影响。本研究对3 种因素综合考虑,将不同损伤时间的大鼠处死后在0 ℃、16 ℃和26 ℃ 3 个温度下保存24 h,发现GpnmbmRNA 的表达几乎不受死亡时间和死后保存温度的影响,而仅与损伤时间相关,这一点极其有利于生前损伤时间推断。该结果进一步提示科研工作者在后期筛选用于损伤时间推断的指标时,应尽量选取不受死亡时间和死后保存温度干扰的指标,从而简化损伤时间推断的问题。
本研究采用线性回归模型探索GpnmbmRNA 表达在损伤时间推断中的应用,但是此模型较简单,在数据信息的挖掘以及预测能力方面稍显不足。因此,在后续的损伤时间推断研究中,应使用多基因联合推断损伤时间,采用机器学习算法等建立更为可靠的指标评价体系,剔除其他对损伤时间推断影响较大的指标,筛查与损伤时间高度相关的mRNA 指标,从而对损伤时间作出更为准确的预测。
