胰岛移植治疗胰腺移植术后移植物失功3 例
2022-11-21段金良白芳杨道朋马雪王树森孙鹏龚金龙林泽鹏朱晓峰何晓顺胡安斌
段金良,白芳,杨道朋,马雪,王树森,孙鹏,龚金龙,林泽鹏,朱晓峰,何晓顺,胡安斌
(1.中山大学附属第一医院器官移植中心,广东 广州 510080;
2.天津市第一中心医院移植中心,天津 300192)
传统的糖尿病治疗方法包括使用外源性胰岛素和降糖药物等,难以将血糖稳定维持在正常水平,且不能阻止糖尿病对眼、肾、心等重要器官微血管损害的病理进程,和代谢障碍等慢性并发症的发生发展,甚至可引起低血糖昏迷、休克等严重事件[1]。胰岛替代治疗包括胰腺移植和胰岛移植,能够实现对血糖的生理性动态调节,是目前治愈糖尿病的理想临床方案。胰腺移植治疗糖尿病疗效确切,但作为复杂的外科手术,发生感染、出血、血栓形成、胰瘘等并发症的风险高,且胰腺移植物术后失功需手术切除,再次胰腺移植的风险明显增加[2]。相比全器官的胰腺移植,胰岛细胞移植操作创伤小,安全性高,且治疗糖尿病的效果也较确切,还可以接受多次胰岛移植,而将胰岛移植用于移植胰腺术后失功的补救性治疗目前尚不常见[3]。中山大学附属第一医院器官移植中心具有多年胰腺移植和胰岛移植经验,现将本中心施行的3 例胰岛移植治疗胰腺移植术后移植物失功的病例报道如下,并总结文献经验。
1 资料与方法
1.1 一般资料:受体在接受胰腺移植术前的一般情况见表1。
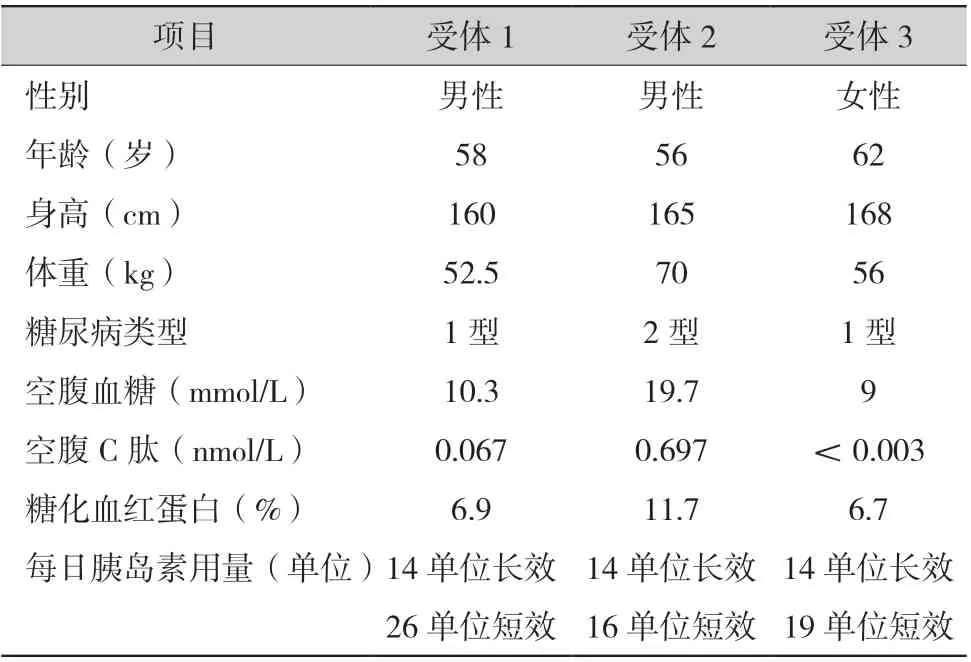
表1 胰腺移植术前患者一般情况
术后1 个月内,受体1、2、3 分别因血栓形成、出血、肠瘘腹腔感染合并出血开腹探查,发现移植胰腺坏死并予以切除。移植肾功能均正常,按肾移植常规予以抗排斥反应治疗并定期复查。为进一步治疗糖尿病,3 例患者接受补救性胰岛移植,胰岛移植前受体的一般情况见表2,并通过βscore 评分对受体术前进行评估[4]。
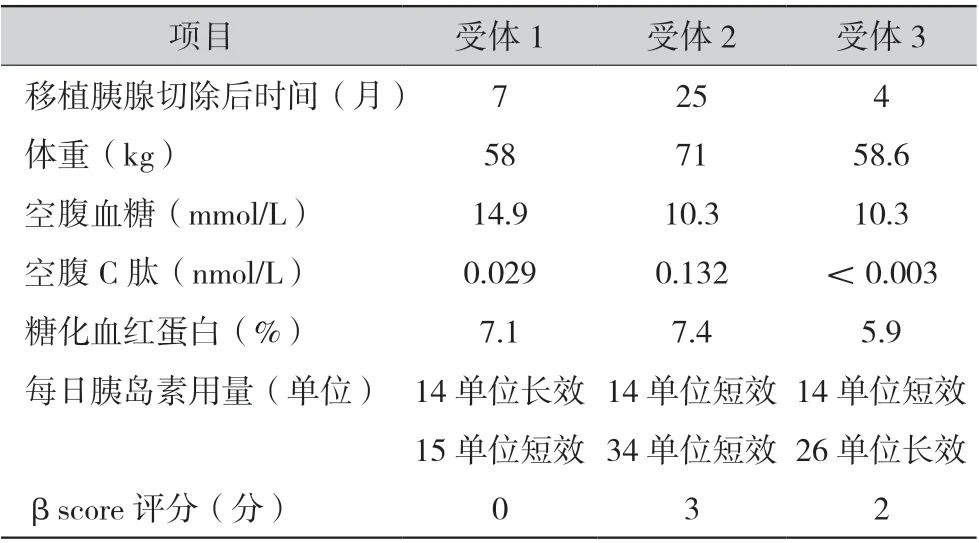
表2 胰腺移植术前患者一般情况
1.2 供体胰岛分离情况:选用年龄20 ~ 50 岁与受体相同血型的脑死亡器官捐献(donation after brain death,DBD)供体的胰腺,获取前供体胰岛功能正常。采用腹部器官联合快速切取技术获取胰腺,热缺血时间为2.5 ~ 4.0 min,冷缺血时间为6 ~ 10 h。获取后将供体胰腺送至产品生产质量管 理 规 范(good manufacturing practice,GMP) 实验室,检查确认供者胰腺适合进行胰岛分离后以胶原酶灌注、消化供体胰腺,采用连续密度梯度离心法利用Cobe2991 细胞分离机对消化产物进行纯化。纯化后对胰岛质量进行评估:要求 胰 岛 数 量 大 于5000 胰 岛 当 量(IEQ)/kg,纯度大于30%,活性大于70%,葡萄糖刺激指数(glucose-stimulated insulin secretion,GSIS)大于1.0,胰岛溶液细菌、真菌镜检阴性,内毒素检测阴性。胰岛质量评估合格后可将胰岛悬浮于移植液中准备进行移植,或在体外培养6 ~ 10 h 后再进行移植。
1.3 胰岛移植治疗情况:在超声引导下将18 G PTC针穿刺受体门静脉右前支,拔出针芯插入导丝,沿导丝将6 F 猪尾型导管置入门静脉主干,注入超声造影剂或生理盐水确认导管末端位于门静脉主干。在超声的全程动态监测下,将胰岛悬液输注到受者门静脉中,每10 min 测量1 次门静脉压力与血糖,控制输注速度将门静脉压力控制在20 mmHg(1 mmHg=0.133 kPa)以内。输注结束后将导管末端退至肝实质中,经验性使用少量白眉蛇毒血凝酶(0.2 KU 溶于1 ml 生理盐水)注入肝穿刺道肝实质内(约0.2 ml 可填充满整个管腔)并通过按压穿刺点止血。撤管后观察20 min 以上,如发生肝脏穿刺道出血即行超声消融止血。
免疫抑制方案:术前2 h 应用巴利昔单抗20 mg、依那西普50 mg,术后第3、7、10 天分别加用依那西普25 mg 1 次,第4 天加用巴利昔单抗20 mg 1 次诱导治疗。术后口服他克莫司和吗替麦考酚酯维持治疗。
术后常规给予抗感染治疗,泵入肝素抗凝,使活化部分凝血活酶时间(activated partial thromboplastin time,APTT)延长10 s 左右,48 h 后改用低分子肝素皮下注射。采用动态血糖监测仪密切监测受体血糖水平,并根据血糖水平泵入胰岛素将血糖控制在4 ~ 7 mmol/L。术后24 h 通过超声检查肝脏内有无血肿和门静脉血栓发生。并监测空腹C 肽、他克莫司浓度、血常规及肝肾功能等。
2 结 果
3 例受体的空腹C 肽均在术后第1 ~ 2 天出现短暂的释放高峰后下降。受体1 的空腹C 肽在第7 天开始明显上升,于第10 天升至正常水平,并可维持稳定。受体2 为2 型糖尿病受体,术后空腹C 肽始终维持在正常水平。受体3 在术后第3 天开始空腹C 肽水平稳定维持在0.16 ~ 0.27 nmol/L,虽未达到正常水平,但较术前有明显提升(图1)。
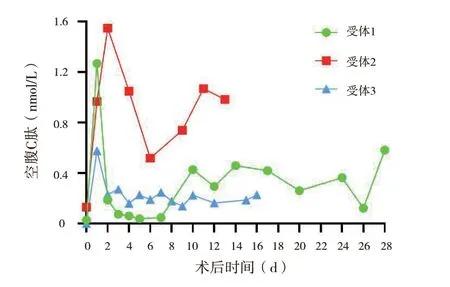
图1 受体术后空腹C 肽水平
在外源性胰岛素方面,3 例受体均在术后3 ~ 5 d 开始逐渐减少外源性胰岛素用量,至出院前受体1 实现胰岛素撤除,受体1 和受体3 胰岛素用量减少2/3 以上。
术后3 例受体的血糖均趋于平稳,保持于4 ~10 mmol/L,未再出现大幅波动。
术后均出现短暂的一过性肝酶异常,予护肝治疗,肝酶均在2 周内恢复正常,未发生其他并发症。
术后6 个月进行随访,3 例受体均血糖控制稳定,无低血糖事件发生,空腹血糖及相关指标均控制良好,βscore的综合性评分较术前均有明显提升 (表3)。
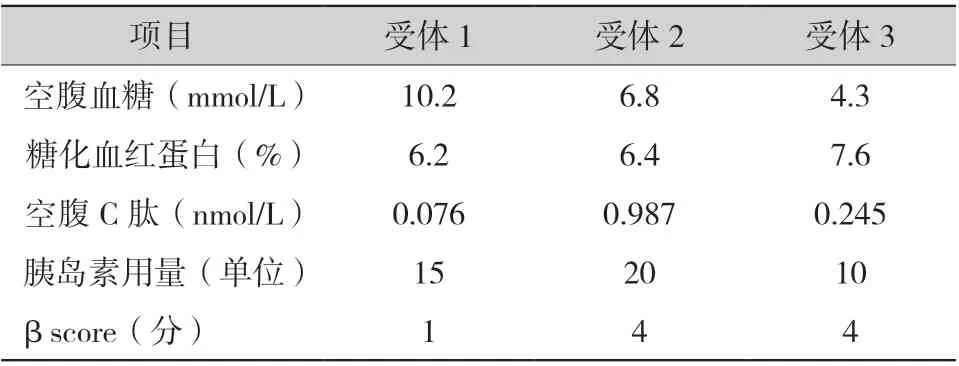
表3 术后6 个月随访受体情况
3 讨 论
胰腺移植是目前治疗糖尿病公认效果最确切的方法,但是并发症风险较高,一旦移植胰腺坏死手术切除后,再次胰腺移植的难度大且移植物存活率低[5-8]。近年来,临床胰岛移植技术进展巨大,治疗糖尿病的效果已得到充分认可[9]。而且,胰岛移植仅需通过经皮门静脉穿刺将胰岛悬液输注进门静脉,创伤小,操作简单,安全性高,还可以接受多次胰岛移植进一步巩固疗效。因此,对于胰腺移植术后移植物失功的病例,胰岛移植可以作为一种补救性治疗手段。
本研究中的3 例患者在接受胰腺移植术后,移植胰腺均坏死被手术切除。在接受补救性胰岛移植前,血糖均无法稳定控制,均空腹血糖>10 mmol/L,空腹C 肽低于检测范围或相比胰腺移植前更低,胰岛素用量相比胰腺移植前均有所增加。而在接受补救性胰岛移植后,血糖均能够稳定控制在正常范围内,空腹C 肽均明显增加,1 例在出院时可以停用外源性胰岛素,其余2 例胰岛素用量减少2/3。术后6 个月随访,βscore 依然均较接受胰岛移植术前有提高。说明胰岛移植治疗胰腺移植术后移植物失功疗效确切。
关于胰岛移植治疗胰腺移植术后移植物失功的文献方面,目前共有2 篇临床研究报导。2015 年,研究人员首次报道了3 例胰腺移植术后移植物切除补救性胰岛移植与2 例胰岛移植失败后补救性胰腺移植的病例,探究胰腺移植和胰岛移植互为失败后补救性治疗措施的可行性。该研究认为,胰岛移植失败后胰腺移植虽然可以实现良好的代谢控制,但因受体已经致敏而且等待合适供体胰腺时间长,该方法难以实施[10]。而胰腺移植术后移植物失功胰岛移植是一种可行的补救性治疗方法。2017 年,研究人员报道了10 例胰腺移植术后移植物切除补救性胰岛移植,随访中位时间为51 个月,其中9 例都实现了糖化血红蛋白<7.0%且无严重低血糖的主要终点。而未接受胰岛移植组中7 例全部未达到该主要终点,再次胰腺移植组3 例虽然均达到该终点,但是其中1 例因血肿再次开腹手术[3]。
随着胰岛移植免疫抑制方案及胰岛分离技术的提高,胰岛移植已经可以实现接近胰腺移植的疗效[11],而且其安全性高,因此有希望成为一种胰腺移植失败后的补救性手段。目前将胰岛移植用于胰腺移植术后移植物失功治疗的研究例数较少,有待积累更多病例以进一步观察其确切性和长期疗效。
