2022年全国乙卷理综化学第11题的评析与变式
2022-11-19河南靳思增
河南 靳思增
元素周期律和元素周期表是帮助学生建构“位—构—性”认知模型和培养学生证据推理与模型认知核心素养的重要载体。从原子结构、分子结构或元素周期律与元素周期表的角度解释物质的宏观性质,发展学生的宏观辨识与微观探析素养。元素周期律是高考的必考考点,近几年高考试题通过优化试题情境,考查学生解决真实情境问题的能力,本文对2022年全国乙卷理综化学第11题评析并进行变式练习,提出有关“元素周期律”的复习备考建议。
1.2018—2022年高考全国乙卷关于“元素周期律”的考查分析
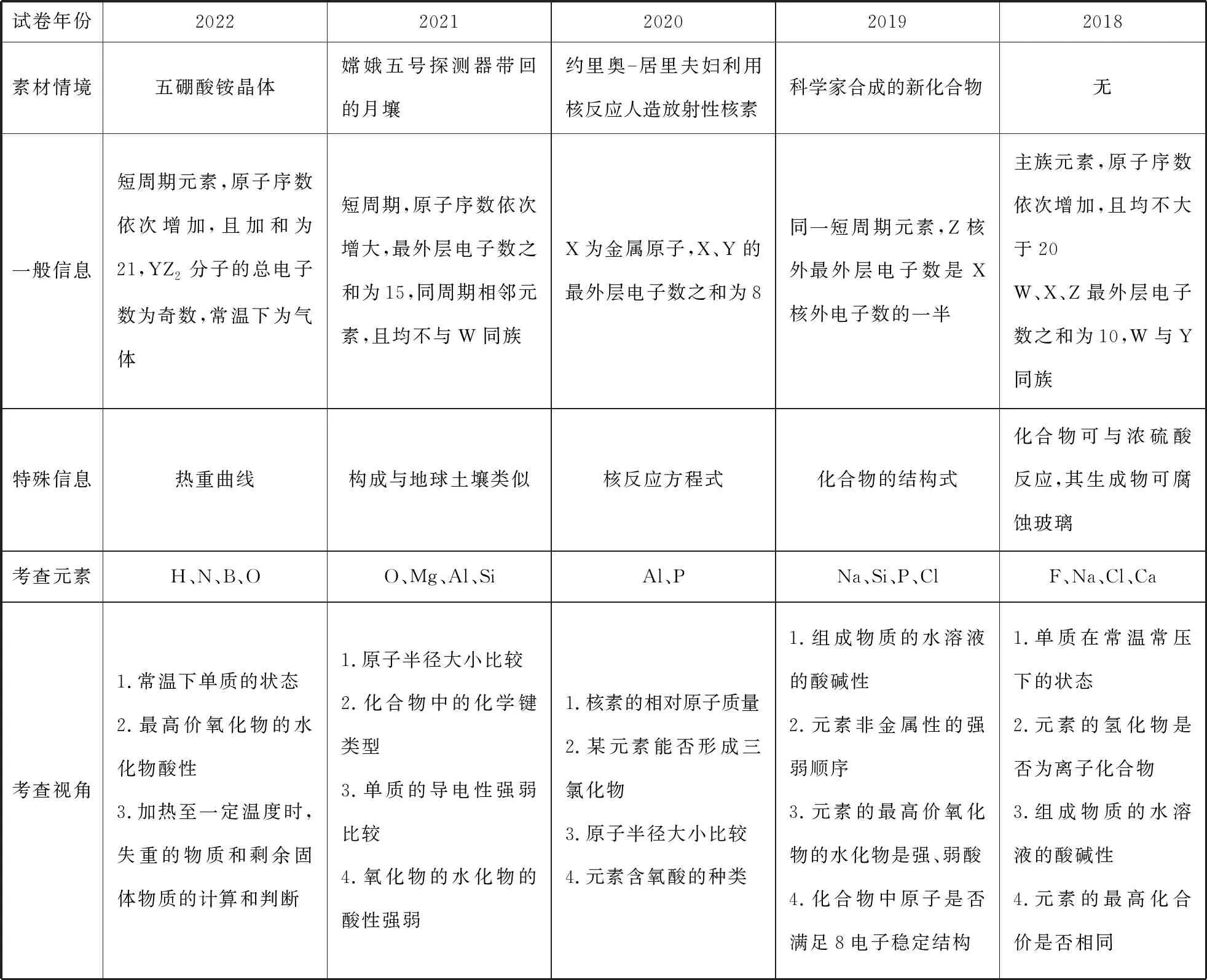
试卷年份20222021202020192018素材情境五硼酸铵晶体嫦娥五号探测器带回的月壤约里奥居里夫妇利用核反应人造放射性核素科学家合成的新化合物无一般信息短周期元素,原子序数依次增加,且加和为21,YZ2分子的总电子数为奇数,常温下为气体短周期,原子序数依次增大,最外层电子数之和为15,同周期相邻元素,且均不与W同族X为金属原子,X、Y的最外层电子数之和为8同一短周期元素,Z核外最外层电子数是X核外电子数的一半主族元素,原子序数依次增加,且均不大于20W、X、Z最外层电子数之和为10,W与Y同族特殊信息热重曲线构成与地球土壤类似核反应方程式化合物的结构式化合物可与浓硫酸反应,其生成物可腐蚀玻璃考查元素H、N、B、OO、Mg、Al、SiAl、PNa、Si、P、ClF、Na、Cl、Ca考查视角1.常温下单质的状态2.最高价氧化物的水化物酸性3.加热至一定温度时,失重的物质和剩余固体物质的计算和判断1.原子半径大小比较2.化合物中的化学键类型3.单质的导电性强弱比较4.氧化物的水化物的酸性强弱1.核素的相对原子质量2.某元素能否形成三氯化物3.原子半径大小比较4.元素含氧酸的种类1.组成物质的水溶液的酸碱性2.元素非金属性的强弱顺序3.元素的最高价氧化物的水化物是强、弱酸4.化合物中原子是否满足8电子稳定结构1.单质在常温常压下的状态2.元素的氢化物是否为离子化合物3.组成物质的水溶液的酸碱性4.元素的最高化合价是否相同
笔者对近五年高考化学试题进行分析发现,关于元素周期律的考查形式有三种:一是“位—构—性”的综合考查,通过纯文字的推断与分析考查内容;二是“位—构—性”的综合考查,通过文字与图示相结合的推断与分析,图示主要有陌生物质的结构式、元素周期表片段等;三是原子晶体和分子晶体结构与性质的考查,该形式主要出现在新高考化学单科试卷中。
2019年以来考查元素周期律的试题中已知条件呈现形式情境化、多样化,考查学生在真实情境中提取学科问题、分析解决问题的能力。如2019年全国卷Ⅰ给出新化合物的结构式、2020年全国卷Ⅰ给出核反应方程式、2022年全国乙卷给出复杂物质的化学式和热重曲线图,考查形式由单一逐渐到综合,充分体现出《中国高考评价体系》中试题的综合性和创新性,在新高考中教师要重点关注物质结构与性质模块在此部分试题的考查,原因是其出题角度可以更加多样灵活,能有效落实高考“服务选才”功能和充分发挥高考“引导教学”功能。
2.真题分析
【例题】(2022·全国乙卷·11)化合物(YW4X5Z8·4W2Z)可用于电讯器材、高级玻璃的制造。W、X、Y、Z为短周期元素,原子序数依次增加,且加和为21。YZ2分子的总电子数为奇数,常温下为气体,该化合物的热重曲线如图1所示,在200℃以下热分解时无刺激性气体逸出。下列叙述正确的是

图1
( )
A.W、X、Y、Z的单质常温下均为气体
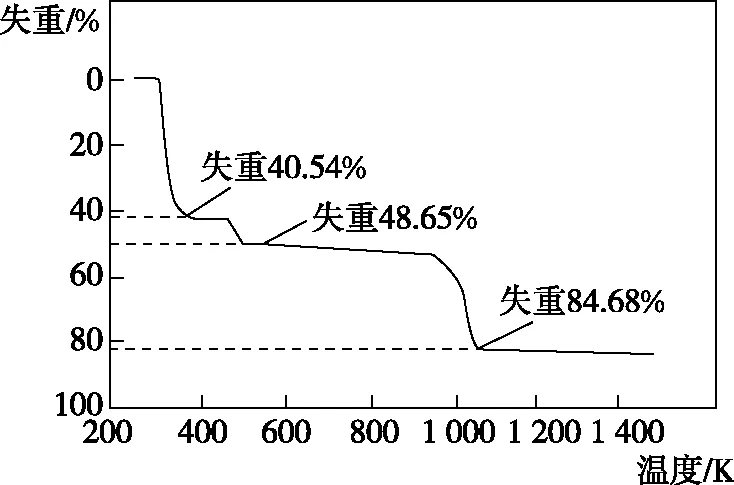
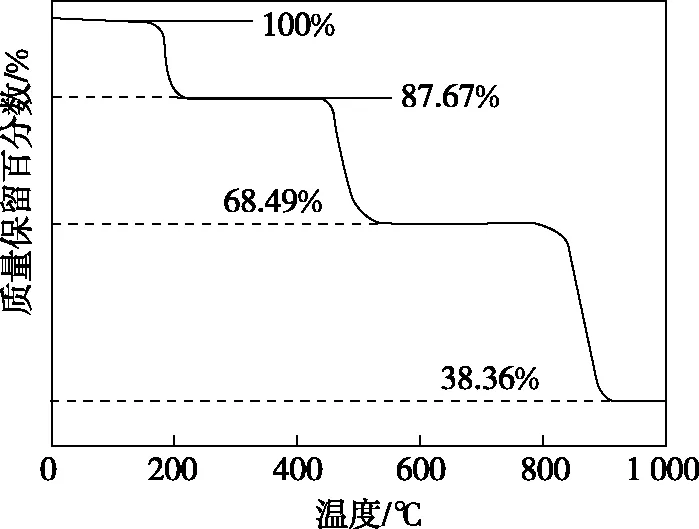
B.最高价氧化物的水化物酸性:Y C.100~200℃阶段热分解失去4个W2Z D.500℃热分解后生成固体化合物X2Z3 【参考答案】D 【试题情境】本题情境属于学术探索情境,以一种制造电讯器材和高级玻璃的材料的组成元素的推断为载体,在陌生的研究对象及问题情境下,体现对物质组成和性质、热重定量分析不同阶段的物质组成的基础性、综合性和创新性的考查。 【必备知识】本题主要考查两个知识点,一是物质结构与性质,主要包括物质的状态、最高价氧化物对应的水化物的酸性强弱;二是定量分析某阶段失去的物质以及推断剩余的物质成分。 【关键能力】本题考查的关键能力有两点:一是理解与辨析能力,要求学生能够掌握原子结构、元素周期律等基础知识;二是分析与推测能力,要求学生根据题给物质的化学式与所组成元素的原子序数的关系,推断出元素,并能结合热重分析曲线进行定量判断某阶段失去的物质以及剩余的物质成分。 【综合素质】本题对考生综合素质的考查侧重于两个方面:一是化学观念,要求考生能够根据原子序数之和、分子中的电子数等微观视角去推断元素,分析物质的性质等;二是思维方法,要求考生能基于证据对物质组成进行定量分析推理,判断失去的物质或剩余物质的化学式等。 【解题思路】 图2 综上所述,答案为D。 热重曲线是利用热分析天平记录的热分析曲线,它反映了样品的残留质量或固体残留率(即质量分数)随温度或时间的变化关系。通过分析热重曲线,就可以知道被测物质在哪个温度段发生了什么变化,有无质量损失、失重率是多少、分几步分解、分解的温度范围、热稳定性、结晶水的鉴定等信息,并且可根据物质失去的重量,求出百分比,由此也可推断出从体系中分离的是什么物质。 图3 a ( ) A.X、Y、Z、W的单质常温下均为固体 B.Z、W的简单离子半径的大小顺序为Z>W C.400℃热分解将失去18个X2Y D.1 100℃热分解后生成固体化合物Z2Y3,且工业上通过电解熔融的Z2Y3制备单质Z 【参考答案】D 【解题思路】 图5 【分析】本题结合化合物Al2(SO4)3·18H2O的热重曲线、沉淀变化图像和元素周期律进行命题,重点考查学生综合分析图像和定量计算的能力。 【变式2】化合物(WY2Z4·X2Z)中的四种元素X、Y、Z、W为前20号元素,且原子序数依次增加,Y和Z位于同周期的不同主族,W最高价氧化物对应的水化物是检验YZ2气体的常用试剂,该化合物的热重分析曲线如图6所示。 图6 下列叙述正确的是 ( ) A.X、Y、Z、W四种元素只能形成一种离子化合物W(XYZ3)2 B.200~400℃阶段热分解将失去1个X2Z C.600℃热分解后生成固体化合物WYZ3,且该反应为非氧化还原反应 D.化合物YZ2中的只有Z原子满足8电子稳定结构 【参考答案】B 【解题思路】 图7 【分析】本题通过典型的常见气体的检验为突破口进行推断,考查C、H和O可以形成多种酸根离子、CO2的结构问题、热重曲线定量计算化合物热分解中各成分的变化及变化过程中反应类型的推理,注重考查的基础性和综合性。 (1)夯实基础,自主构建必备知识导图 扎实掌握元素周期表、元素周期律和元素化合物的必备知识,教师可引导学生主动建构自己的知识网络。对于没有充分思考过的规则进行死背,只能获得表面的知识,而表面的知识是很难在记忆中保持的。因此概括整合、归纳简化是高效学习的关键,学生通过主动整合和理解内化,把必备知识嵌入自己已有的知识结构中,以形成更大的必备知识网络。 (2)创设情境,教研中开展原创试题的命制 集体教研是教师交流研讨、相互学习、统一思路的重要活动,通过全组教师积极寻找素材,模仿创新高考考点及考查视角进行有关习题的命制,注重考查的基础性、综合性、应用性和创新性在命题中的体现,让学生在真实素材情境中解决问题,在有限的复习时间内提高复习备考的效率,也是积极促进教师专业发展的有效途径之一。 (3)精准施策,提升学生解决真问题的能力 基于“审析答”助力学生快速解决问题。“审”就是要找出题干中的显性条件和隐形条件,挖掘图表中信息,把文字、图示转化为具体的化学用语,做醒目标记,以备解答问题时能快速找到信息对应点。“析”就是对信息进行加工和整合,联想回顾已有知识与经验,推测知识进行深度分析。进行尝试、验证、解答。“答”是指作答时要做到:规范性、准确性和完整性。
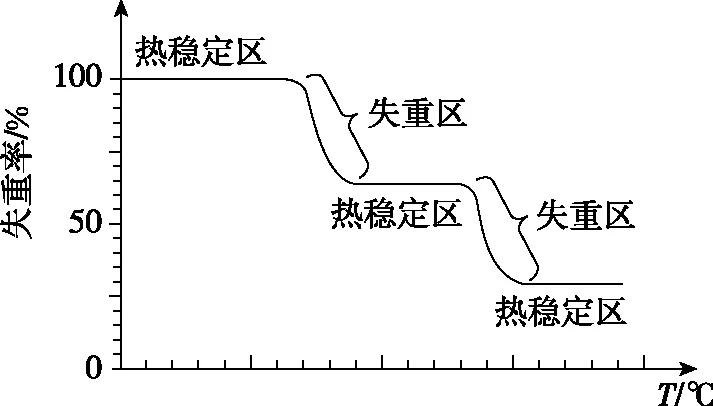
3.热重分析

4.原创变式训练




5.复习备考建议
