小鼠肌球蛋白轻链激酶生物信息学分析
2022-11-19边艳超张传领王万伦刘桐佳邢凯佳
边艳超 张传领 张 浩 王万伦 张 婷 刘桐佳 刘 爽 邢凯佳 肖 瑞▲
1.内蒙古医科大学内蒙古自治区分子病理学重点实验室,内蒙古 呼和浩特 010059;
2.内蒙古医科大学药学院,内蒙古 呼和浩特 010059
肌球蛋白轻链激酶(myosin light chain kianse,MYLK)主要由平滑肌型肌球蛋白轻链激酶和非肌肉肌球蛋白轻链激酶构成,是生物过程重要参与者[1]。MYLK 是一种钙调素依赖酶,使肌球蛋白得以激活肌球蛋白ATP 酶,通过内皮细胞骨架重塑,促进肌球蛋白驱动收缩、应力纤维形成、黏附、细胞迁移和细胞增殖[2-4]。有研究发现,MYLK 蛋白与精子运动性有紧密的关系,Ashizawa[5]在脱膜精子内加入MYLK 特异性抑制剂,脱膜精子在30℃下的运动性明显被抑制;还有研究发现,MYLK1 对囊胚的形成及雌性生育力的维持是必不可少的[6-7],由此可见,MYLK 在改善雄性生育力问题上可能起着重要的作用。鉴于MYLK 的重要作用,本研究借助生物信息学方法对MYLK 基因的结构以及编码蛋白质的结构和功能等方面进行预测,为进一步研究MYLK 蛋白的功能调节机制奠定理论基础,更有利于了解其影响人类生育力的生物学作用。
1 材料与方法
采用美国国家生物信息中心(National Center for Biotechnology Information,NCBI) 查 找 小 鼠MYLK 基因序列,获得MYLK 基因全长编码区序列,对其基因编码的产物及理化性质、信号肽、跨膜结构、二级结构、三级结构、功能结构域、亚细胞定位、磷酸化位点及蛋白质互相作用网络等进行生物信息学分析与预测。
2 结果与分析
2.1 MYLK基因编码产物及理化性质分析
MYLK 基因位于16 号染色体,含35 个外显子,转录产物片段大小为7809 bp。将MYLK 基因编码的氨基酸序列通过ExPASy 中的ProtParam 工具进行氨基酸理化性质预测,MYLK 蛋白分子结构式为C9310H14884N2642O2955S78,含1950 个氨基酸残基,分子量为213 609.21 kD,理论等电点为5.92,原子总数为29 869;氨基酸组成中,Glu 含量最高,为8.8%;MYLK 的不稳定系数为44.46,≥40,判定其为不稳定蛋白质;脂肪系数为71.57,亲水性评估系数为-0.563。
使用ProtScale 数据库对MYLK 蛋白的亲疏水性进行预测[8],结果表明,MYLK 蛋白亲水性最大的氨基酸是Glu,分值为-3.167,疏水性最大的氨基酸是Cys,分值为2.944。从氨基酸序列亲疏水性分布图(图1)可以看出,MYLK 蛋白的亲水性氨基酸要明显多于疏水性氨基酸,表明MYLK 为亲水性蛋白。

图1 MYLK 蛋白亲水性/疏水性分析
2.2 MYLK信号肽分析
利用在线分析工具SignalP[9-10],对MYLK 编码的氨基酸序列进行信号肽预测。结果表明(图2),MYLK 蛋白的1 ~70 个氨基酸可能是其信号肽序列,但未见其信号肽剪切位点,表明该蛋白为非分泌性蛋白。
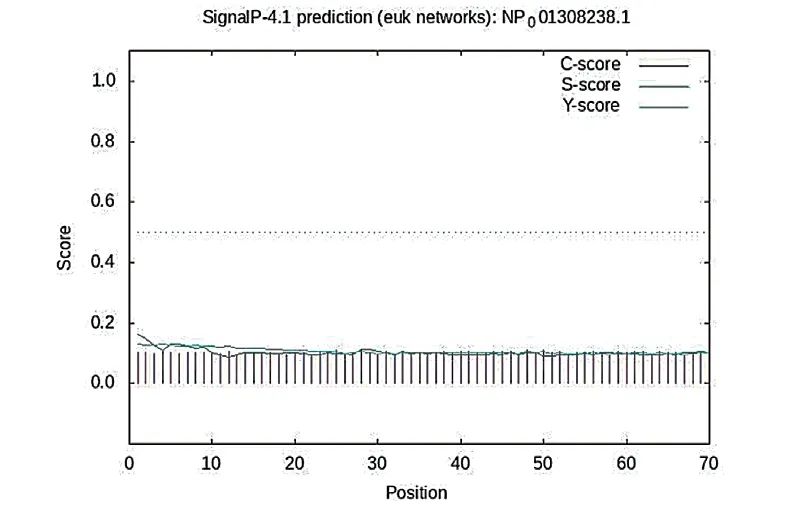
图2 MYLK 蛋白信号肽分析
2.3 MYLK蛋白跨膜结构预测分析
选用TMHMM 2.0 对MYLK 蛋白跨膜结构进行预测[11],结果表明(图3),MYLK 不存在跨膜区域,说明MYLK 蛋白质不是跨膜蛋白质,因此,推测MYLK 主要进入细胞核中参与RNA 的形成过程,主要作用区域分布于细胞核。

图3 MYLK 蛋白跨膜结构分析
2.4 MYLK蛋白二级结构预测
利用SMOPA 软件预测MYLK 蛋白质的二级结构[12],结果表明(图4),MYLK 蛋白质的二级结构中无规则卷曲占49.85%,α 螺旋占22.82%,延伸链占20.10%,β 折叠占7.23%,提示MYLK 蛋白质二级结构主要由无规则卷曲和α 螺旋构成。
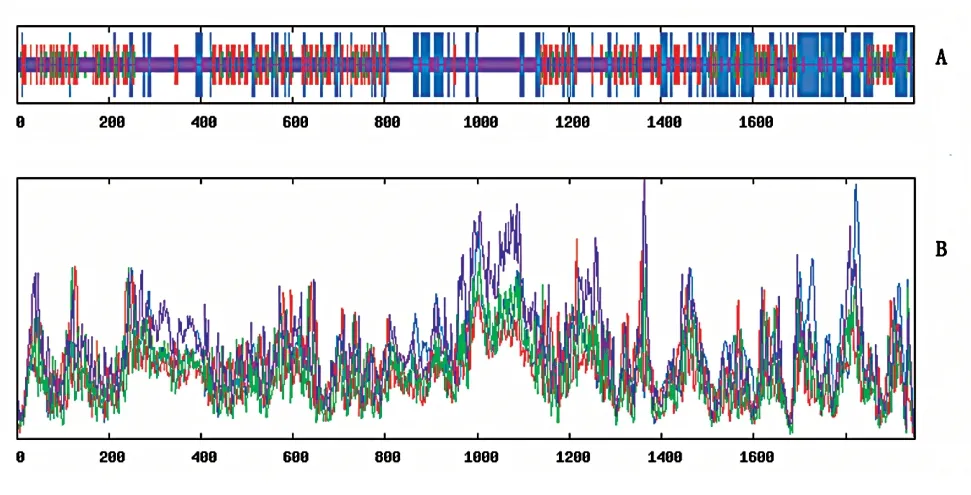
图4 MYLK 蛋白二级结构预测
2.5 MYLK蛋白三级结构预测
采用同源建模法Swiss-Model 进行建模[13-14],基于唐氏综合征细胞黏附分子(DSCAM)原子结构进行同源建模,两者的序列一致性可以达到44.31%,GMQE 值为0.12,QMEAN 值达到-3.93,以上评分说明建模质量较好(图5)。
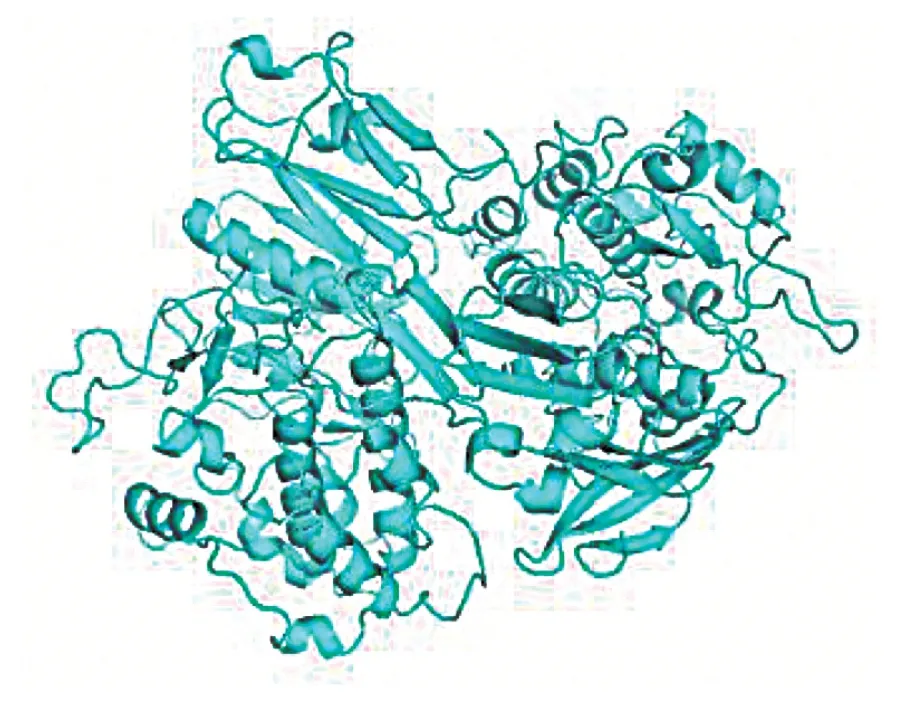
图5 MYLK 蛋白三级结构预测
2.6 MYLK蛋白结构域预测
使用SMART 在线工具对MYLK 蛋白功能结构域进行预测,结果表明(图6),MYLK 蛋白有四种结构域,在整个蛋白序列上共有八处免疫球蛋白C-2型(IGc2)功能结构域,IG 功能结构域、FN3 结构域、S_TKc 结构域各一处。在FN3 结构域中存在Arg-Gly-Asp(RGD)序列;S_TKc 属于催化结构域,为丝氨酸/苏氨酸特异性激酶亚家族。

图6 MYLK 蛋白结构域预测
2.7 MYLK蛋白亚细胞定位和磷酸化分析
经过亚细胞定位分析显示,该序列主要在细 胞 核(30.40%)、细 胞 质(26.10%)、高 尔 基 体(13.00%)、内质网(13.00%)、线粒体(8.70%)、分泌小泡(4.30%)等结构内发挥其生物学作用。该蛋白质经磷酸化分析表明(图7),小鼠MYLK 蛋白质有较多的Thr、Ser 磷酸化位点,Tyr 磷酸化位点相对较少。
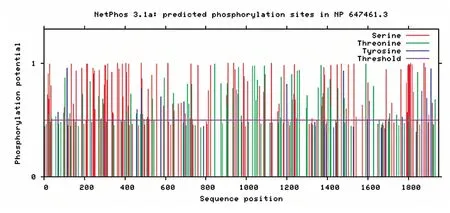
图7 小鼠MYLK 蛋白磷酸化位点预测
2.8 MYLK相互作用蛋白分析
运用STRING 数据库构建MYLK 的蛋白与蛋白互作网络(protein-protein interaction,PPI)[15],从PPI 中发现(图8),相互作用蛋白包括肌球蛋白家族和钙调蛋白家族蛋白成员。
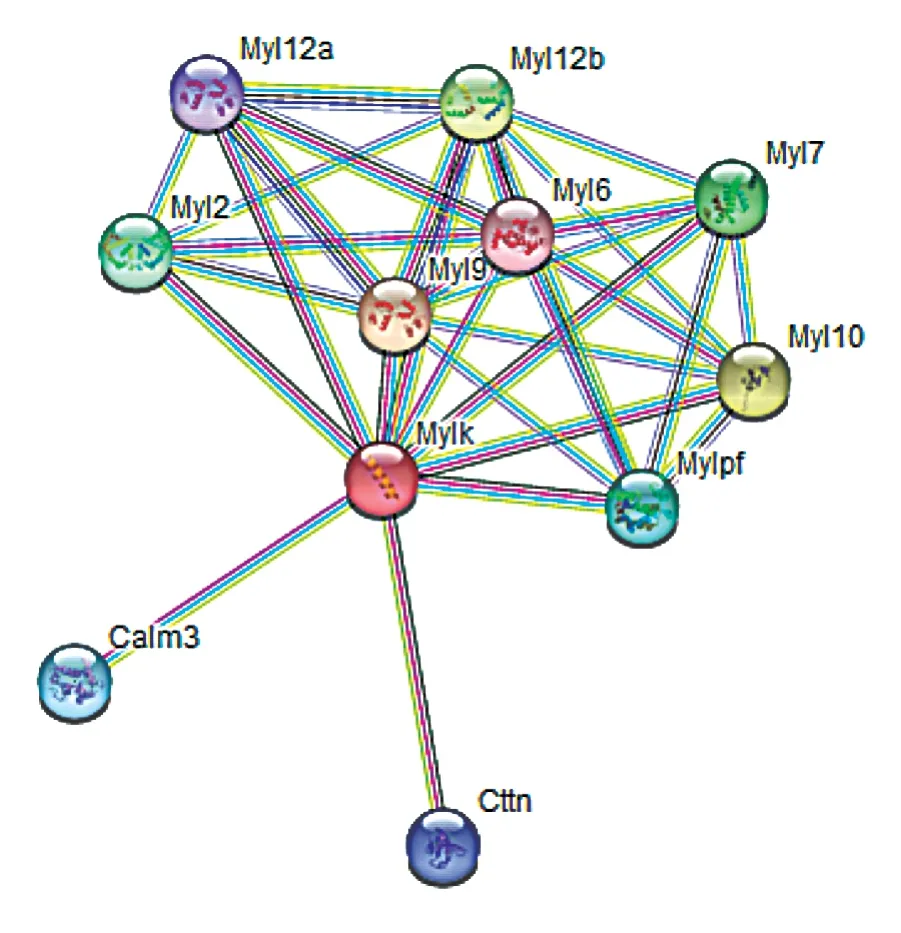
图8 小鼠MYLK PPI
3 讨论
MYLK 是一种依赖于钙调蛋白激活肌球蛋白轻链磷酸化的重要激酶,其在多种细胞中都有表达,在细胞黏附、迁移、凋亡等生理活动中发挥重要作用[16]。
本研究应用生物信息学方法,对MYLK 基因的结构以及编码蛋白质的结构和功能等方面进行预测,发现MYLK 由1950 个氨基酸构成,为理论等电点为5.92、评估系数为-0.563 的亲水性不稳定蛋白,MYLK 的亲水性结构有利于MYLK 蛋白在细胞质或细胞核中游离,当其发挥功能时,可迅速与RNA/DNA 结合,使其内部的疏水结构被外部的亲水结构保护[13]。此外,经预测分析,MYLK 为非分泌型、非跨膜蛋白质,因此,推测MYLK 主要进入细胞核中参与RNA 的形成过程,主要作用区域分布在细胞核,不经内质网和高尔基体修饰运输,通过核孔复合体直接进入细胞核,参与RNA 的形成。
对MYLK 蛋白进行二级结构预测,其49.85%的氨基酸组成无规则卷曲。因此,小鼠MYLK 蛋白的功能可能与其中较多的无规则卷曲结构密切相关。通过MYLK 功能结构域分析,发现其有四种结构域,其中IGc2 功能结构域参与多种功能,包括细胞-细胞识别、细胞-表面受体、肌肉结构和免疫系统。此外还有IG 功能结构域以及FN3 结构域,在各种FN3 结构域中发现存在RGD 序列,含有RGD 序列的小肽可以调节与血栓形成、炎症和肿瘤转移相关的各种细胞黏附发生。S_TKc 属于磷酸转移酶或苏氨酸特异性激酶亚家族,其在多种细胞过程中发挥作用,包括分裂、增殖、凋亡和分化。小鼠MYLK 蛋白质经磷酸化分析表明,其有较多的Thr 以及Ser 磷酸化位点,Tyr 磷酸化位点相对较少。而Thr 和Ser 磷酸化的主要作用是激活蛋白质的活力,提示小鼠MYLK 蛋白质酶活力较强。通过STRING 数据库建立PPI,得到十个互作蛋白,主要由肌球蛋白和钙调蛋白两种蛋白构成。
综上所述,通过对小鼠MYLK 基因结构与功能的生物信息学分析,发现MYLK 是具有核定位、无跨膜结构、非分泌型、亲水性不稳定的蛋白质,MYLK 无需跨膜转运的过程,通过核孔复合体直接进入细胞核,参与RNA 的形成,其酶活力较强,在细胞黏附、迁移、凋亡等生理活动中具有极为重要的意义。
