近红外荧光探针用于生物硫醇的高灵敏检测
2022-11-18蓝敏焕赵少静潘唐纳
蓝敏焕,庞 娥,赵少静,潘唐纳
(中南大学化学化工学院,湖南 长沙 410083)
细胞内的生物硫醇,如半胱氨酸(Cys)、同型半胱氨酸(Hcy)及谷胱甘肽(GSH),通过氧化还原反应参与机体代谢,其浓度的变化与多种疾病有关[1-2]。例如GSH浓度异常与恶性肿瘤、艾滋病、肝损伤和神经退行性疾病有关,Cys的浓度变化与生长缓慢、脱发和肝损伤相关,而Hcy是心血管疾病和阿尔茨海默病的标志物之一[3-5]。因此,生物硫醇的高灵敏检测对于疾病的早期诊断和评估进展具有非常重要意义[6-8]。
近年来,科研人员开发了多种方法用于检测细胞内生物硫醇的浓度,包括电化学发光法[9]、酶联免疫法[10]和比色法[11]等。然而这些方法仍然存在一些不足,例如电化学发光法重现性差、酶联免疫法容易出现假阳性结果,而比色法灵敏度较低。荧光探针技术具有操作简单、灵敏度高、选择性好,可以在线监测等优点,在生物硫醇的检测领域具有独特的优势。汤等人选择2'-羟基查尔酮作为荧光团,2,4-二硝基苯磺酸酯基团作为识别基团,设计合成了一个荧光开启型荧光探针。该探针与生物硫醇反应后释放出查尔酮并恢复其荧光,实现了水溶液和细胞中生物硫醇的高灵敏检测[12]。张等人以香豆素为荧光团,2,4-二硝基苯磺酰胺为识别单元,基于分子内光诱导电荷转移机制,开发了一种香豆素类新型荧光增强型探针CPH,当检测到苯硫酚后,香豆素荧光团被释放,溶液的荧光恢复,从而实现水溶液中苯硫酚的检测[13]。郭等人制备了氮、硫掺杂的碳点,在碳点水溶液中加入Cu2+后导致荧光猝灭,当向碳点-Cu2+体系中加入硫醇衍生物后,由于硫醇与Cu2+具有更强的结合能力,可以将Cu2+从碳点的表面被移除,碳点的荧光恢复[14]。然而,很多荧光探针水溶性较差,有的需要在较高或较低pH条件下进行检测,有的选择性较差。因此,开发一种能够克服这些缺点的荧光探针具有十分重要的意义[15]。
本文以三苯氨基噻吩基团为强给电子基团,以氰基作为强吸电子基团,合成了一种可检测生物硫醇的有机小分子荧光探针TTCNPy。进一步利用纳米沉淀法将其制备成具有良好水溶性的纳米颗粒,用于检测水溶液和细胞中的生物硫醇。该纳米颗粒具有近红外荧光发射(λem=727 nm)及较大的斯托克斯位移(260 nm),能够在pH=7的缓冲溶液中灵敏地检测到生物硫醇,并具有较高的选择性和抗干扰能力。生物硫醇中巯基的强亲核进攻能力能够破坏荧光探针的共轭π键,导致探针荧光猝灭,从而实现对细胞中生物硫醇的定量检测。TTCNPy纳米颗粒具有合成简便、水溶性好、灵敏度高、选择性高、细胞毒性低的优点[16]。
1 实验方法
1.1 实验材料与仪器
实验中使用的试剂均购自希恩斯和J&K,未进行额外的提纯。所用溶剂均为高效液相色谱级;所用无水溶剂均按照有机溶剂纯化手册进行处理;所用柱层析硅胶为200~300目。在400MHz核磁共振仪器(Bruker)上测试了1H NMR和13C NMR谱。用Xevo G2 QTOF MS(Waters)记录化合物的高分辨质谱(HRMS)。紫外可见吸收光谱在岛津UV2600分光光度计上测量;荧光光谱在岛津RF-6000荧光分光光度计上测量;细胞成像实验使用荧光倒置显微镜进行。
1.2 TTCNPy的合成及表征
TTCNPy分子的合成路线如图1所示。
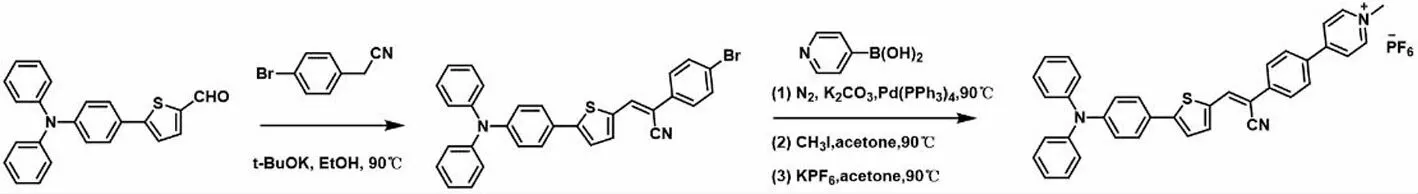
图1 TTCNPy的合成路线Fig.1 Synthetic route of TTCNPy
1.2.1 TTCN-Br的合成
将1 mmol对溴代苯乙腈和1.5 mmol t-BuOK依次加入到10 mL无水乙醇中,常温搅拌10 min后,将0.5 mmol的TT-CHO加入到该溶液中,90 ℃回流4 h后,冷却到室温,旋蒸除去溶剂,粗产物用硅胶纯化,正己烷/乙酸乙酯梯度洗脱可以得到黄色固体,产率约为75%。1H NMR(400 MHz,CDCl3),δ 7.60(s,1H),7.58~7.48(m,7H),7.24~7.34(m,5H),7.26(s,8H),7.16~7.11(m,4H),7.07(d,J=11.8,4.9 Hz,4H).
1.2.2 TTCNPy的合成
将0.2 mmol TTCN-Br,0.5 mmol CH3I溶解到5 mL乙腈中,90 ℃回流8 h,冷却到室温,加入25 mL乙醚,收集过滤固体,在真空干燥箱中烘干后,溶解于10 mL丙酮,5 mmol KPF6溶于2 mL水中后,加入丙酮溶液中,混合液室温搅拌24 h,旋蒸除去溶剂,粗产物用硅胶纯化,CH2Cl2/CH3OH=8/1作为洗脱剂,分离得到深红色固体,产率约为50%。1H NMR(400 MHz,CD3CN),δ 8.52(d,J=6.9 Hz,2H),8.18(d,J=7.0 Hz,2H),8.01(s,1H),7.94(d,J=8.6 Hz,2H),7.85(d,J=8.6 Hz,2H),7.63(d,J=4.0 Hz,1H),7.57~7.52(m,2H),7.36(d,J=4.0 Hz,1H),7.27(d,J=10.6,5.3 Hz,4H),7.06(t,J=7.8 Hz,6H),6.94(d,J=8.7 Hz,2H),4.19(s,3H).红外光谱,1 635,1 573,1 496和1 429 cm-1为苯环骨架C=C环呼吸振动峰。615 cm-1为噻吩环上的C-S键振动。2 206 cm-1为C≡N的红外吸收峰。
1.2 TTCNPy纳米颗粒的制备
TTCNPy纳米颗粒通过纳米沉淀法制备。首先将1 mmol TTCNPy溶于2 mL THF中,在超声下加入到50 mL超纯水中,2 h后转入到100 mL烧瓶中,并在室温下不断搅拌24 h除去溶液中的THF,得到橙红色液体,然后用0.22 μm的水相滤膜过滤,得到制备好的TTCNPy荧光探针纳米颗粒[17]。
1.3 紫外可见吸收光谱和荧光光谱
用空白溶剂校准后,向比色皿中加入TTCNPy纳米颗粒的水溶液。用移液枪吹匀后,加入不同浓度的生物硫醇,并在测试前再次吹匀,收集其紫外可见吸收光谱和荧光光谱。
1.4 探针的检测限计算
计算好不同比例的生物硫醇所需要母液的体积,取10 μL浓度为2 mmol的TTCNPy纳米颗粒母液加入2 mL缓冲溶液中,然后用移液枪移取一定体积的生物硫醇滴加到含TTCNPy纳米颗粒的缓冲溶液中。测试TTCNPy探针溶液的荧光光谱,按照下式计算探针的检测限。
LOD =Kσ/κ
上述符号的含义:K代表置信水平系数,光谱测试中K=3;σ代表空白样品测量20次以上信号的标准偏差;κ是727 nm处探针的荧光强度与生物硫醇浓度之间的线性关系的斜率。
1.6 选择性实验
在探针溶液中分别加入相同浓度的Hcy、Cys、GSH或其他不含巯基的氨基酸中,反应相同的时间后,分别检测其荧光光谱。
1.7 细胞毒性实验
通过3-(4,5-二甲基噻唑-2-基)-2,5-二苯基四唑溴化物(MTT)分析评估TTCNPy纳米颗粒对4T1细胞的毒性。将4T1细胞培养在含10%胎牛血清(FBS)的培养基中,在37 ℃下,体积分数为5% CO2和95%空气环境中培养,将细胞接种在96孔板中,24 h后更换含(2~10 μmol)的TTCNPy纳米颗粒的培养基,再经过24 h孵育后添加200 μL带有MTT(5 mg/mL)溶液的新鲜培养基。在37 ℃下孵育4 h后,弃去MTT溶液,并加入200 μL DMSO。在酶标仪下测量每个孔在490 nm处的吸光度。
2 结果与讨论
2.1 TTCNPy纳米颗粒的表征
我们首先通过扫描电子显微镜(SEM)观察确定TTCNPy纳米颗粒的尺寸。如图2a所示,TTCNPy纳米颗粒呈球状结构,直径约为20~30 nm左右,这种尺寸的纳米颗粒有利于细胞吞噬。具有近红外荧光且大斯托克斯位移的荧光材料在生物成像

λ/nm
应用中具有背景干扰低、对生物样品的光损伤小、样品穿透性强、检测灵敏度高等优点。TTCNPy纳米颗粒水溶液的紫外可见吸收光谱和荧光光谱如图2b所示,其在467 nm处有最大吸收峰,在727 nm处有荧光发射峰,斯托克斯位移达到260 nm。
1.5 TTCNPy纳米颗粒在不同pH条件下对生物硫醇的光谱响应
在不同pH条件下,不同荧光探针对生物硫醇的响应有一定规律性[18]。我们系统研究了TTCNPy荧光探针在不同pH条件下对3种生物硫醇的响应,如图3所示,在相同时间内,加入10 μmol的Hcy、Cys、GSH后TTCNPy纳米颗粒的荧光强度显著降低;并且随着pH的增加,TTCNPy纳米颗粒的光谱对生物硫醇的响应也逐步增加(如图3d),这是由于在碱性条件下,巯基变成了亲核能力更强的硫负离子,更容易进攻碳碳双键,导致TTCNPy探针的荧光被更高效地猝灭。
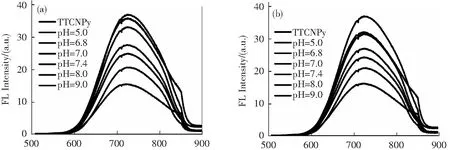
λ/nm λ/nm
2.3 TTCNPy纳米颗粒对不同浓度生物硫醇的吸收和荧光光谱响应
为了探究TTCNPy纳米颗粒与生物硫醇识别过程的响应时间,向配制好的10 μmol TTCNPy纳米颗粒中加入相同浓度的Hcy、Cys、GSH,每隔10 min测试1次TTCNPy纳米颗粒的紫外可见吸收光谱和荧光光谱。如图4所示,随着时间的延长,TTCNPy纳米颗粒的荧光逐渐被猝灭,在100~150 min荧光强度几乎没有变化,说明此时反应已经基本结束,则可以确认TTCNPy纳米颗粒与生物硫醇的反应时间约为100 min[19-20]。
2.4 TTCNPy纳米颗粒对生物硫醇的灵敏度测试
为了考察TTCNPy纳米颗粒对生物硫醇的灵敏度测试,我们通过紫外吸收变化及荧光光谱滴定实验来进行评价(图5)[21-22]。在配制好的TTCNPy探针(10 μmol)中逐渐滴加Hcy、Cys、GSH(1~8 μmol),可以观察到随着生物硫醇的加入,纳米颗粒在467 nm的吸光度和727 nm处荧光逐渐降低。当加入8 μmol的生物硫醇时,荧光强度不再降低。通过对TTCNPy纳米颗粒在727 nm处的荧光发射与生物硫醇滴加的浓度进行线性拟合,可以观察到荧光发射与浓度在0~6 μmol的生物硫醇之间有良好的线性关系(插图)。根据实验结果,可以计算出荧光探针TTCNPy纳米颗粒对Hcy、Cys、GSH的检测限分别为0.479,0.429,0.480 μmol。上述结果表明TTCNPy纳米颗粒对生物硫醇具有较高的检测灵敏度[12]。
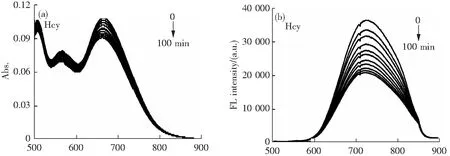
λ/nm λ/nm

λ/nm λ/nm
2.5 TTCNPy纳米颗粒对生物硫醇的选择性和检测机理解释
我们考察了TTCNPy纳米颗粒对生物硫醇或常见不含巯基氨基酸的荧光响应[23-25]。如图6a所示,向配制好的TTCNPy纳米颗粒(10 μmol)中分别加入相同浓度的Hcy、Cys、GSH、Lys、Pro、Tyr、Arg、Leu、Ala、Thr、His、Asp、Trp、Glu、Cystine、Gly、Ser、Met、Pre、Val,等待反应100 min。通过对比,可以观察到只有加入生物硫醇,TTCNPy纳米颗粒的荧光才会被显著猝灭,在加入其他不含巯基的氨基酸时,TTCNPy纳米颗粒的荧光强度几乎没有明显变化。上述结果表明TTCNPy探针对生物硫醇具有良好的选择性。
为了探究TTCNPy纳米颗粒对生物硫醇具有选择性的原因,我们通过TTCNPy与Cys反应前后的质谱进行了验证。由于氰基的吸电子能力极强,导致碳碳双键上的电子分布不均,而生物硫醇中巯基中的硫原子含有一对孤对电子,具有强亲核能力,发生Michael加成反应,破坏了TTCNPy探针的共轭,从而导致荧光猝灭(图6b、6c)。为了进一步研究其荧光猝灭机理,对TTCNPy纳米颗粒与生物硫醇反应前后的荧光寿命进行了测试。结果显示,反应前的TTCNPy纳米颗粒的荧光寿命为1.25 ns,而与Hcy、Cys和GSH生物硫醇反应后,其寿命均降低至0.78 ns左右,说明这是一个静态猝灭的机制。
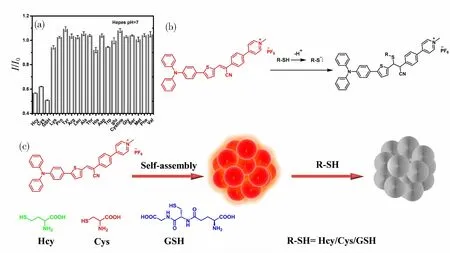
图6 (a)在HEPES缓冲液(pH=7)中TTCNPy纳米颗粒对常见氨基酸的选择性测试,(b)TTCNPy 与生物硫醇反应机理示意图。(c)TTCNP纳米颗粒的自组装以及检测生物硫醇的示意图。Fig.6 (a) Selectivity test of TTCNPy nanoparticles and common amino acids in HEPES buffer(pH=7),(b) schematic representation of the reaction mechanism of TTCNPy with biothiols.(c) Schematic diagram of self-assembly of TTCNP nanoparticles and detection of biothiols.
2.6 细胞毒性
鉴于TTCNPy纳米颗粒对生物硫醇有着的良好识别功能,我们进一步通过MTT检测法探究了TTCNPy纳米颗粒的生物相容性[26]。如图7所示,随着纳米颗粒浓度的增加,4T1细胞的存活率只有很微小的降低,在浓度高达10 μmol时,4T1的细胞存活率均可以达到95%以上。这些结果说明TTCNPy探针具有很好的生物相容性。

Concentration/μmol图7 不同TTCNPy纳米颗粒浓度下的细胞存活率Fig.7 Cell viability at different TTCNPy nanoparticle concentrations
2.7 TTCNPy纳米颗粒的细胞荧光成像
通过荧光倒置显微镜采集经TTCNPy纳米颗粒孵育的4T1细胞的荧光图像,以验证探针对检测细胞内生物硫醇的能力。将4T1细胞分为A、B、C、D四组,向培养基中分别加入10 μmol的TTCNPy纳米颗粒,在孵育4 h后,向B、C、D三组中再分别加入10 μmol Hcy、Cys、GSH,并继续孵育100 min,在PBS缓冲液冲洗两遍后,用荧光倒置显微镜观察并采集细胞图像[26],如图8所示,A组显示出强烈的红色荧光,B、C、D组只能观察到微弱荧光,细胞成像实验证明了生物硫醇可以有效地猝灭TTCNPy纳米颗粒的荧光。

图8 4T1细胞与仅含TTCNPy纳米颗粒、 TTCNPy与Hcy孵育、TTCNPy与Cys孵育和 TTCNPy与GSH孵育后的细胞成像照片。
3 结论
本文合成并制备了一种可检测生物硫醇的小分子TTCNPy荧光探针,进一步制备了水溶性纳米颗粒。该纳米颗粒具有近红外荧光发射(λem=727 nm),和较大的斯托克斯位移(260 nm)。能够在pH=7的缓冲溶液中灵敏地检测到生物硫醇,对Hcy、Cys、GSH的检测限分别为0.479,0.429,0.480μmol。基于生物硫醇中巯基的强亲核进攻能力破坏荧光探针的共轭π键的原理,导致探针荧光猝灭,TTCNPy与GSH/Hcy/Cys作用后展现出明显的荧光“开-关”的变化,从而实现对细胞中生物硫醇的可视化检测。
