福建青枯雷尔氏菌的遗传多样性及其生防放线菌的筛选
2022-11-18郑雪芳陈燕萍肖荣凤陈梅春刘欣王阶平
郑雪芳,陈燕萍,肖荣凤,陈梅春,陈 峥,刘欣,王阶平,刘 波
(福建省农业科学院农业生物资源研究所, 福州 350003)
青枯雷尔氏菌Ralstonia solanacearum(简称青枯菌)可导致多种重要经济作物毁灭性枯萎[1],在世界范围内,尤其是中国危害极大,严重威胁世界农业经济发展[2]。青枯菌因其侵染性强,寄主范围大,地域分布广,生存能力强,被认为是世界上危害最大植物病原菌之一[3]。由青枯菌引起的茄科作物青枯病在我国南方地区普遍发生,其中以福建、广东、湖南、浙江及广西危害最为严重[4]。随着全球气侯变䁔,世界范围内青枯病发生危害呈现越来越严重的趋势。
青枯菌是一个非常复杂的类群,呈现出高度种下分化的多态性。例如,根据寄主范围差异,可将青枯菌分为5个生理小种[5];根据青枯菌对3种双糖(麦芽糖、乳糖、纤维二糖)和3种已醇(甘露醇、山梨醇、甜醇)的氧化能力,可将其划分为6个生化型[6,7]。Fegan和Prior[8]根据青枯菌的基因型提出了演化型分类框架,通过特异性多重 PCR将青枯菌划分为 4个主要的演化型,并根据内源葡聚糖酶基因(endoglucanase gene,egl)的序列相似性确定序列变种。Safni等[9]综合生理生化分析、脂肪酸测定、16S rRNA序列、egl基因序列和DNA杂交分析结果,将青枯菌的不同菌株进行了重新分类和命名,包括演化型Ⅰ和Ⅲ的Ralstonia pseudosolanacearum,演化型Ⅱ的Ralstonia solanacearum,演化型Ⅳ的R.syzygiisubsp.celebesensis、R.syzygiisubsp.syzygii和R.syzygiisubsp.indonesiensis。
放线菌是产生天然生物活性物质的重要微生物资源[10]。据报道,微生物来源的生物活性物质中,约70%由放线菌产生,且这些放线菌中的 80%是链霉菌[11]。链霉菌具有促进植株生长(Plant growth promoting,PGP)和/或病害生防作用,在农业研究领域越来越受到重视[12]。一些链霉菌如金色链霉菌Streptomyces aureofaciens、阿维链霉菌Streptomyces avermitilis、潮湿链霉菌Streptomyces humidus、吸水链霉菌Streptomyces hydroscopicus、铅青链霉菌Streptomyces lividans、利迪链霉菌Streptomyces lydicus、橄榄绿链霉菌Streptomyces olivaceoviridis、褶皱链霉菌Streptomyces plicatus、玫瑰黄链霉菌Streptomyces roseoflavus、结痂链霉菌Streptomyces scabies和紫黑链霉菌Streptomyces violaceusniger能产生各种不同的抗菌物质,抗菌活性强,已被用于土传病害的防治[13-15]。
本研究通过对分离自福建省不同地区番茄、茄子和辣椒3种茄科作物的青枯菌菌株,进行菌株的生化型、演化型和序列变种鉴定,评价其遗传多样性;同时针对不同类群的青枯菌,筛选出具有拮抗作用的生防放线菌,为茄科青枯病的防控探寻新的自然资源奠定基础。
1 材料与方法
1.1 供试材料
供试56株青枯菌分离自福建省不同地区和寄主的青枯病植株,供试的14株放线菌均分离自福建漳州番茄根系土壤,由福建省农业科学院农业生物资源所菌种库保存。青枯菌的参比菌株 GMI1000由福州大学生物科学与工程学院馈赠,菌株的详细信息见表1。青枯菌培养所需的培养基为2, 3, 5-氯化三苯基四氮唑(2,3,5-triphenyltetrazolium chloride, TTC),参照Kelman[16]方法配制(1% 蛋白胨、0.1%水解酪蛋白、0.5%葡萄糖、1.8% 琼脂和0.05% 2,3,5-氯化三苯基四氮唑);蔗糖蛋白胨(sugar and peptone, SP)培养基,用蒸馏水将蔗糖20 g、蛋白胨5 g、磷酸氢二钾0.5 g和硫酸镁0.025 g定容至1 L,pH为7.2,121℃灭菌20 min。放线菌培养所需的培养基为高氏1号培养基:用蒸馏水将可溶性淀粉20 g,氯化钠0.5 g,硫酸亚铁0.01 g,硝酸钾1 g,磷酸氢二钾0.5 g,硫酸镁0.5 g,重铬酸钾0.05 g,定容至1 L,pH为7.2,121℃灭菌20 min。
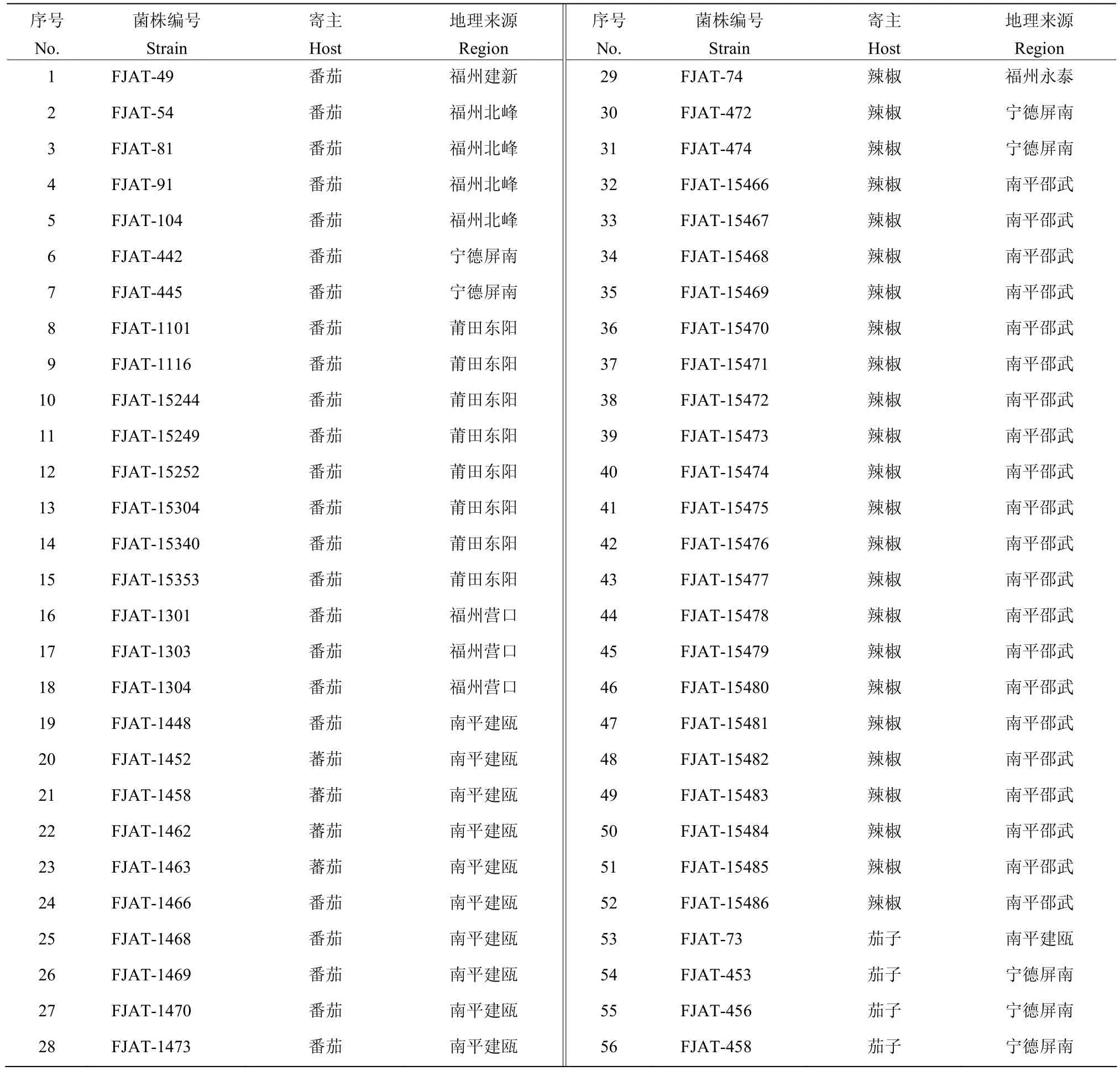
表1 供试青枯雷尔氏菌菌株信息Table 1 Ralstonia solanacearum strains used in this study
试剂及仪器:2,3,5-氯化三苯基四氮唑,美国Sigma公司;细菌DNA提取试剂盒、2×TaqPCR MasterMix,杭州博日科技有限公司;其它试剂均为国产分析纯。Life Eco PCR仪,杭州博日科技有限公司;Gel Doc-ItTM凝胶成像系统,美国UVP公司;Eppendorf 5418R高速台式冷冻离心机,德国Eppendorf公司;SW-CJ-1F超净工作台,苏州安泰空气技术有限公司;BI-250AG恒温培养箱,施都凯仪器设备有限公司。
1.2 试验方法
1.2.1 供试菌株的生化型鉴定 基础培养基配方为NH4H2PO41.0 g,MgSO4·7H2O 0.2 g,KC1 0.2 g,蛋白胨1.0 g,1%溴百里酚蓝水溶液6.0 mL,琼脂15 g,蒸馏水定容至1000 mL,调节pH值至7.2,121 ℃灭菌20 min。将3种双糖(麦芽糖、乳糖、纤维二糖),3种己醇(甘露醇、山梨醇和甜醇)用0.22 µm的微孔滤膜过滤灭菌后,分别加入到基础培养基,使其终浓度为1%。24孔板上每孔加入1 mL 6种不同生化型鉴定培养基和25 mL供试青枯菌菌悬液(107cfu/mL),28 ℃培养21 d,根据各鉴定培养基中指示剂颜色变化的情况,分析菌株对3种双糖和3种己醇的利用能力,确定各代表菌株的生化型的分类归属。
1.2.2 供试菌株的演化型鉴定 采用细菌基因组DNA提取试剂盒提取青枯菌基因组DNA,根据Fegan和Prior[8]的报道合成青枯菌演化型特异性复合PCR引物(表2)。采用复合PCR法对供试菌株进行PCR扩增。PCR 反应体系为(25 μL):12.5 μL 2×TaqPCR MasterMix,引物Nmult22: RR 4 μL,其他6个引物各1 μL,模板DNA 1 μL和无菌水1.5 μL。PCR反应程序为95 ℃预变性5 min;94 ℃变性30 s,55 ℃退火50 s,72 ℃复性90 s,30个循环;最后72 ℃延伸10 min。PCR产物利用2%琼脂糖凝胶进行电泳检测,DNA Marker为DS2000。
1.2.3 供试菌株的序列变种鉴定 利用引物Endo-F/Endo-R[17]对供青枯菌的egl基因进行PCR扩增,引物序列见表2。PCR反应体系为(25 μL):12.5 μL 2×TaqPCR MasterMix,上下游引物各1 μL,模板DNA 1 μL和无菌水10.5 μL。PCR反应程序为95 ℃预变性5 min;94 ℃变性30 s,55 ℃退火30 s,72 ℃复性90 s,30个循环,最后72 ℃延伸10 min。PCR产物经1.5 %琼脂糖凝胶电泳测定为目标单一条带后,送至福州博尚生物技术有限公司进行序列测定。序列经NTI11.5.3软件编辑后,提交GenBank数据库(菌株登入号见表3),并通过NCBI进行同源性比对;从GenBank数据库下载每个变种1~3个代表性菌株的egl基因序列,用CLUSTAL_X软件进行序列多重比较,采用Mega version 6.0软件[18]和邻接法(Neighbor -Joining,NJ)[19]构建系统发育树,确定供试青枯菌在系统发育树中的位置,明确其归属地位。

表2 供试青枯菌演化型特异性多重PCR和egl基因序列变种的PCR鉴定引物Table 2 Primers used for phylotype specific multiplex PCR and egl gene sequevar identification of the tested strains
1.2.4 青枯菌的生防菌筛选 采用琼脂扩散法,以上述鉴定不同类型青枯菌FJAT-91和FJAT-15304为靶标菌,筛选出具拮抗作用的放线菌。将1 mL菌浓度为1×108cfu/mL的FJAT-91和FJAT-15304分别与9 mL约50 ℃的LB培养基混合后,倒入已制备好的LB固体培养基中,制成含病原菌的双层培养基;待培养基凝固后,用灭菌的打孔器在平板上打孔(直径为7 mm)。供试放线菌经高氏1号液体培养基,30 ℃、170 r/min振荡养7 d后,将培养液过0.22 μm滤膜,随后将200 μL滤液加入双层培养基的孔中,孔中加入双蒸水为阴性对照,孔中加入潮霉素(100 mg/mL)为阳性对照,30 ℃培养3 d后,观察并测量抑菌圈直径。试验设3次重复。
1.2.5 生防菌16S rDNA序列分析及系统发育树的构建 按细菌基因组提取试剂盒(购自上海捷瑞生物工程有限公司)操作步骤提取菌株FJAT-31547的基因组DNA,采用16S rRNA通用引物27F(5′-GAGTTT GATCCTGGCTCAG-3′)和 1492 R(5′-ACGGCTACCTTG TTACGA CTT-3′)[20]进行 PCR 扩增。PCR 反应程序为94 ℃预变性5 min;94 ℃变性30 s,55 ℃退火60 s,72 ℃复性90 s,重复33个循环;最后72 ℃下延伸10 min。PCR产物纯化和测序由北京华大基因研究中心完成。获得的16S rRNA序列提交到GenBank。供试菌株16S rRNA序列与EzTaxon数据库(hhtp://eztaxon-e.ezbiocloud.net/)的已知序列进行比对[21],分析系统发育关系,用CLUSTAL_X软件进行序列多重比较,用Mega version 6软件和NJ法构建系统发育树。
2 结果与分析
2.1 青枯菌的生化型鉴定
根据对3种糖(乳糖、麦芽糖、纤维二糖)和3种醇(甘露醇、山梨醇、甜醇)的利用情况将供试的56株青枯菌划分为不同的生化型(表3),53株青枯菌能利用3种双糖和3种已醇,鉴定为生化型Ⅲ;菌株FJAT-15304能够利用3种糖,不能利用3种醇,鉴定为生化型Ⅱ;菌株FJAT-49能利用3种醇、乳糖和麦芽糖,不能利用纤维二糖,菌株FJAT-15466能利用3种糖、山梨醇和甜醇,不能利用甘露醇,这表明菌株FJAT-49和FJAT-15466为非标准型生化型。
2.2 青枯菌的演化型鉴定
演化型复合PCR检测结果表明,供试的56株青枯菌均扩增出大小分别为280和144 bp的2条特异性条带(图1),其中280 bp为青枯菌特异扩增条带,144 bp为演化型Ⅰ的特异性扩增条带。表明这56株青枯菌均属于演化型Ⅰ,即亚州分支菌株。
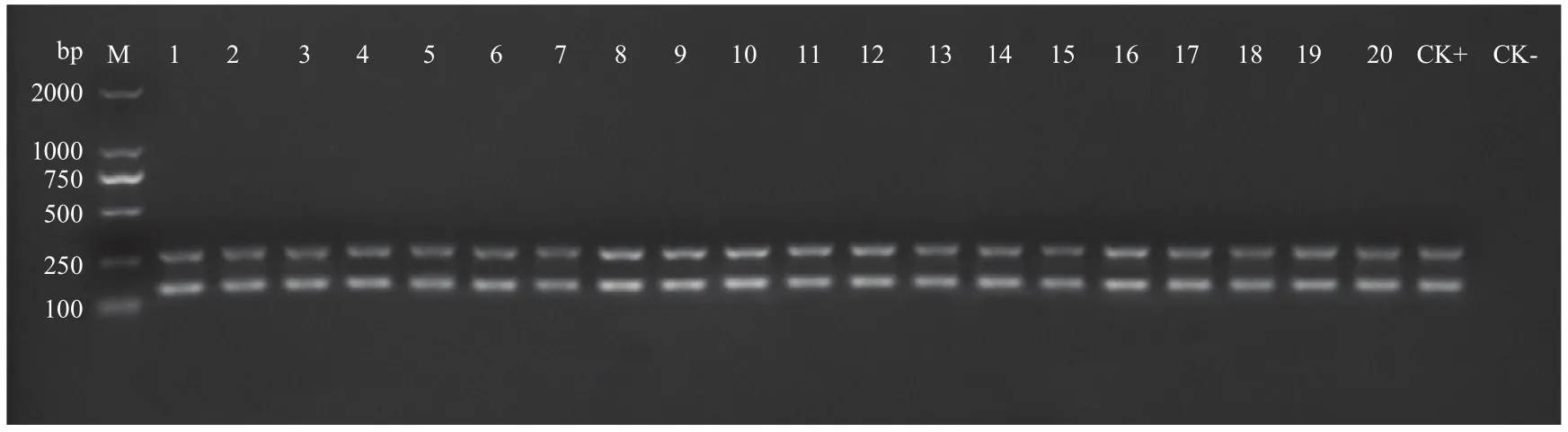
图1 部分供试青枯菌演化型复合PCR扩增结果Fig.1 Phylotype specific multiplex PCR product patterns of partial strains of Ralstonia solanacearum
2.3 青枯菌的egl基因序列变种鉴定
基于egl基因序列对福建不同地区及寄主的56株青枯菌进行序列变种鉴定,采用邻接法构建系统发育树,供试菌株均聚集在亚洲分支,即演化型I分支上(表3,图2)。分离自茄子的青枯菌均属于以PSS358为参比菌株的序列变种15;24株分离自辣椒的青枯菌(除了FJAT-74)均与序列变种14的参比菌株PSS81聚在同一类群;分离自番茄的青枯菌中,序列变种15最多,有9株,其次是序列变种16,共7株,序列变种14有3株,属于序列变种13、17、44和55的青枯菌均为2株;从总体来看序列变种14和15为福建省茄科青枯菌的优势菌系,分别占供试菌株48.21%和23.21%。
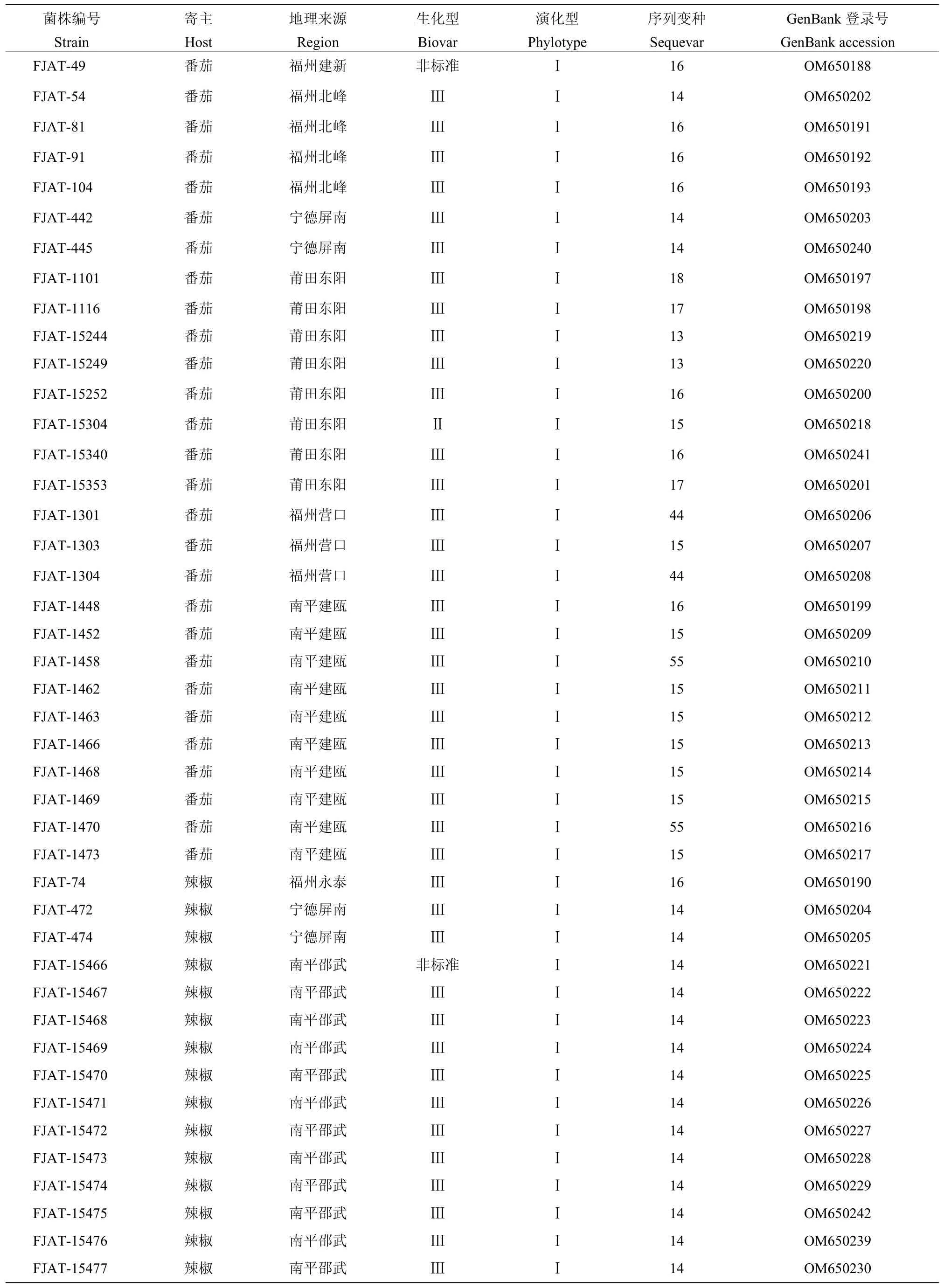
表3 福建省青枯菌egl基因序列变种的分布及寄主来源Table 3 Distribution and host sources of egl sequevars in Ralstonia solanacearum strains isolated from Fujian province
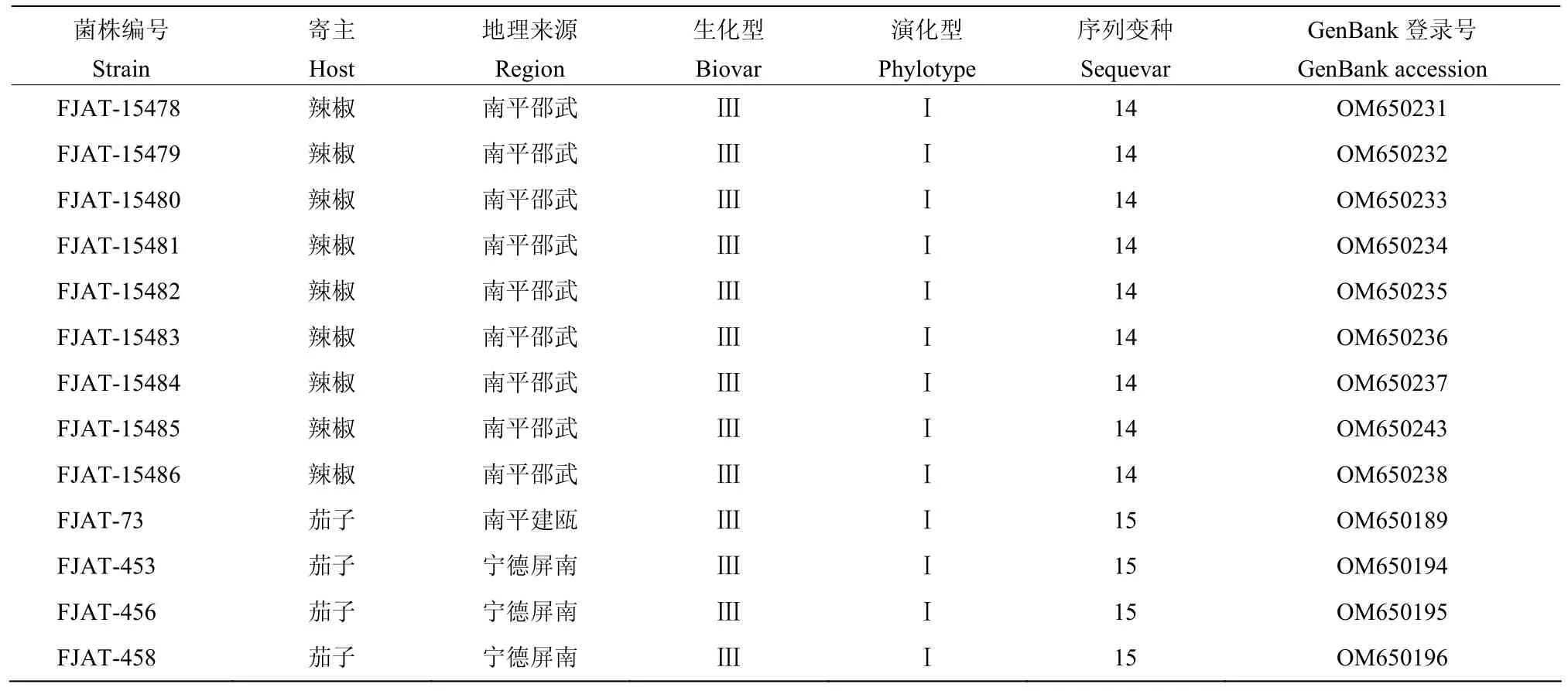
续表3
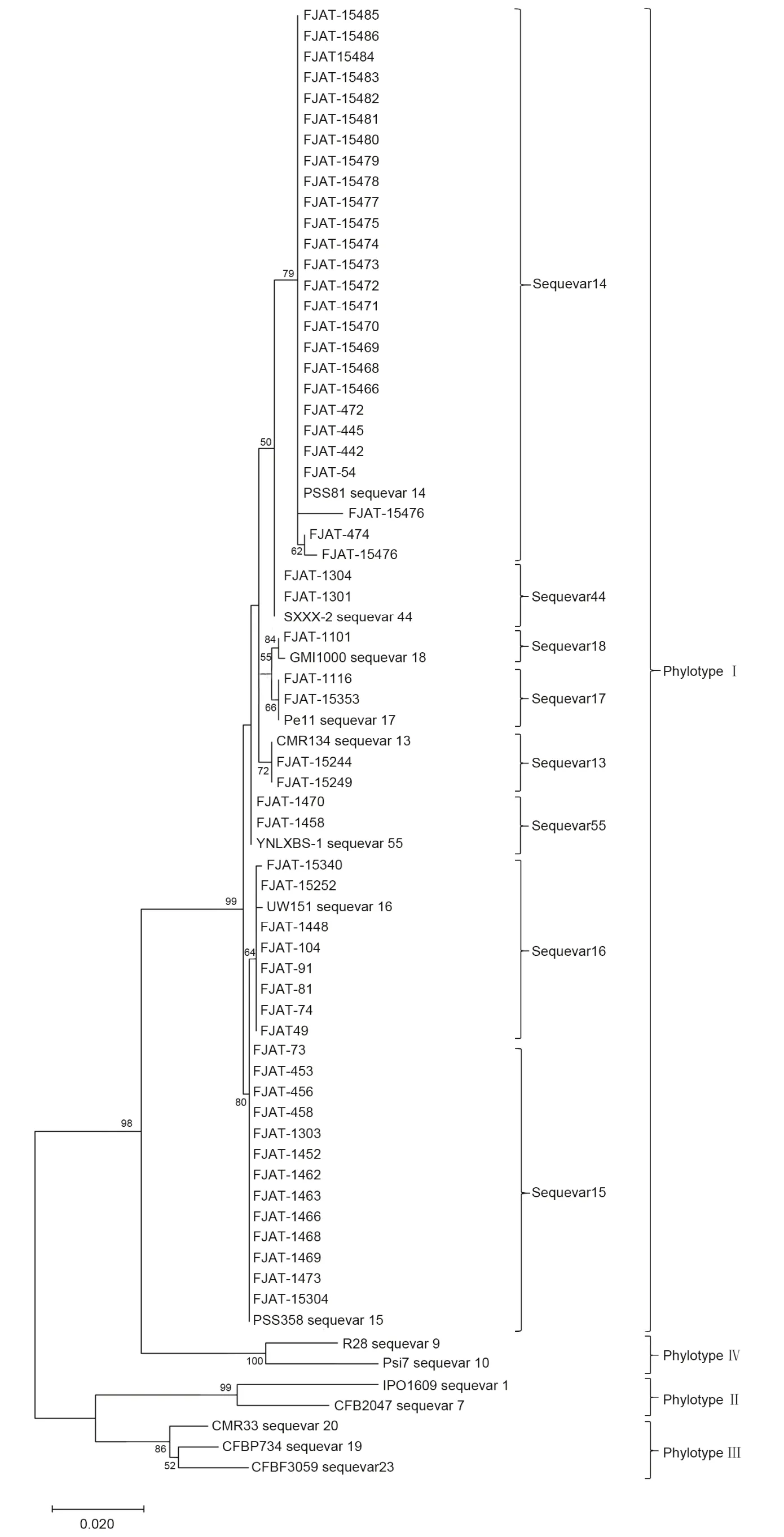
图2 基于egl基因序列构建的青枯菌系统发育进化树Fig.2 A phylogenetic tree of Ralstonia solanacearum based on egl gene sequences
2.4 不同变种青枯菌的生防放线菌筛选
供试的14株放线菌中只有菌株FJAT-31535对生化型Ⅲ、序列变种16的青枯菌FJAT-91具有抑菌活性,抑菌圈直径为13.87 mm,略低于阳性对照的抑菌圈直径(15.54 mm),未筛选到对生化型Ⅱ、序列变种15的青枯菌FJAT-15304有抑菌效果的放线菌(表4)。
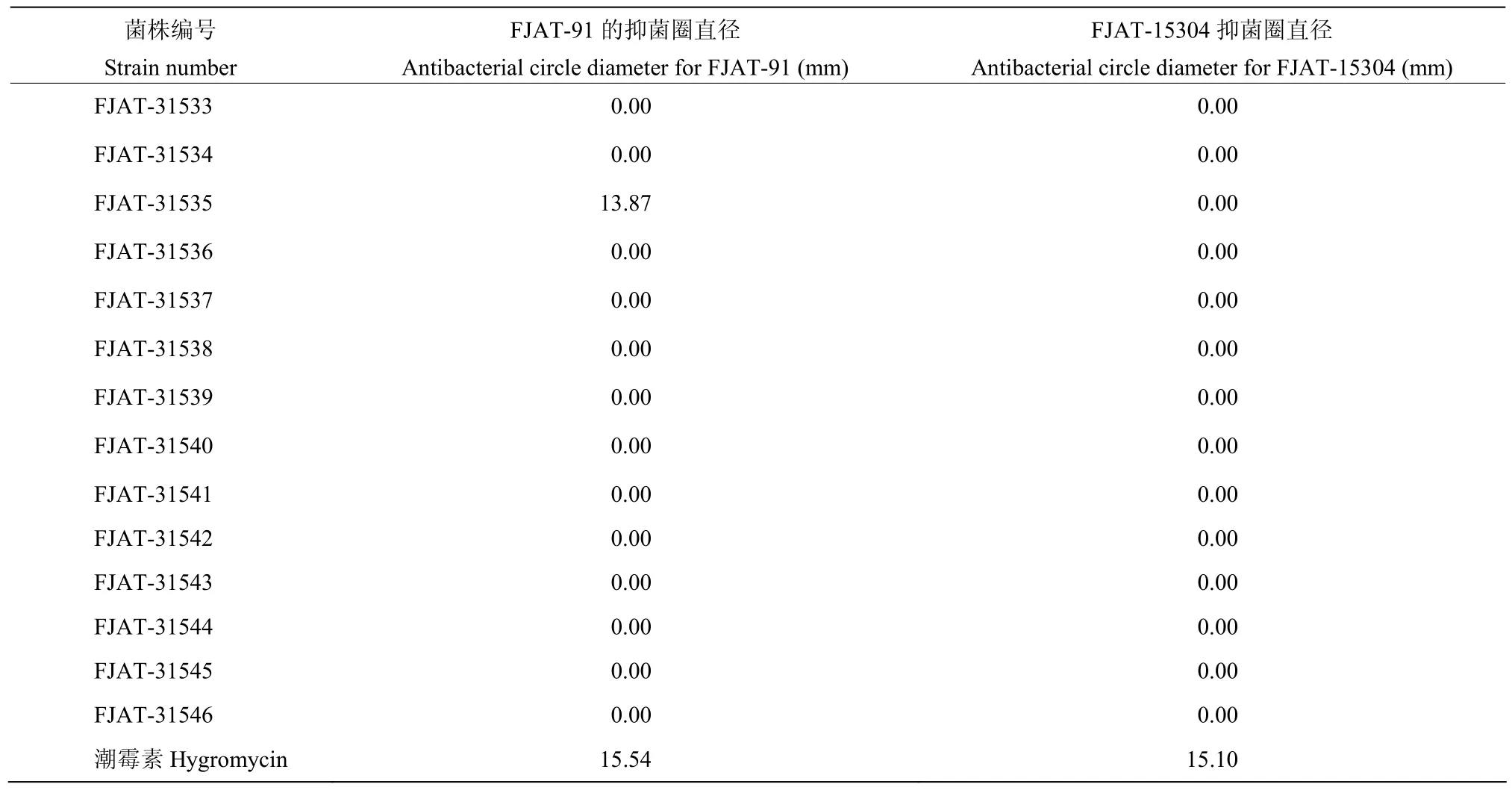
表4 不同放线菌对青枯雷尔氏菌的抑菌活性Table 4 Antibacterial activities of the different actinomycete strains against Ralstonia solanacearum
2.5 生防菌FJAT-31535的鉴定
菌株FJAT31535在高氏1号培养基上生长良好,30℃培养7 d,FJAT31535的菌落形态为圆形、灰白色、边缘细丝状突起,表面干燥、有褶皱,贴紧培养基生长,不易挑起(图3A,B)。

图3 菌株FJAT31535在高氏1号平板上(A)和体视镜下(B)的菌落形态特征Fig.3 Colony morphology of the strain FJAT31535 on a Gause’s No.1 plate (A) and under a stereomicroscope (B)
利用细菌16S rRNA通用引物扩增菌株FJAT31535的16S rRNA基因序列,获得序列长度为1396 bp,序列提交GenBank(登录号:ON038371)。FJAT-31535序列与GenBank和Ezbioclound数据库已知序列比对,结果表明,其与弗氏链霉菌模式菌株RSU15T的16S rRNA基因序列相似性最高,为100%。利用MEGA 6.0软件NJ法构建系统发育树(图4),结果表明,FJAT-31535与弗氏链霉菌模式菌株RSU15T聚在一类群(图4)。基于形态、生理生化特性和16S rRNA基因序列相似性,菌株FJAT-31535鉴定为链霉菌属。
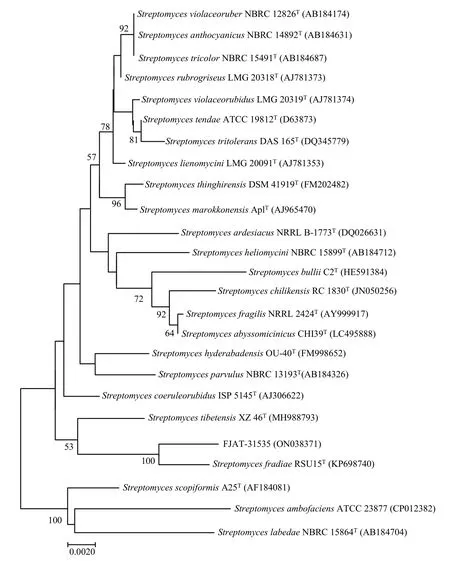
图4 基于16S rRNA序列构建菌株FJAT31535系统发育树Fig.4 The phylogenetic tree of the strain FJAT31535 based on 16S rRNA sequences
3 讨论
青枯菌具有丰富的种内遗传多样性[22,23],其致病性和菌系变化与寄主作物品种、栽培方式及外界环境均存在较大关系[24]。通过生理小种和生化型进行的青枯菌菌系划分存在一定的局限性,不能有效地反映出病原菌在遗传进化及地理起源上的差异[25]。Fegan等[8]在第三届青枯病国际会议上提出青枯菌演化型分类框架,将青枯菌依次划分为种(Species)、演化型(Phylotype)、序列变种(Sequevar)以及克隆(Clone)4个不同水平的分类单元,并建立了与之相对应的鉴定方法。
本研究采用演化型复合PCR检测体系结合传统的生化型鉴定方法对分离自福建8个地区的番茄、辣椒和茄子寄主的 56株青枯菌进行演化型划分和生化型鉴定,结果表明,福建茄科青枯菌大部分属于生化型Ⅲ、演化型Ⅰ,为亚州分支菌株,与前人研究结果相吻合[4]。Xue等[26]、She等[27]研究证实我国青枯菌可分为生化型Ⅲ和Ⅳ,以生化型Ⅲ为主;而生化型Ⅲ和Ⅳ均属于演化型Ⅰ菌株。徐进等[4]对45株福建烟草青枯菌演化型和生化型鉴定结果表明,45株青枯菌均属于演化型Ⅰ,43株属于生化型Ⅲ,说明福建茄科寄主青枯菌中,生化型Ⅲ是占居优势或普遍存在,但这个生化型在南、北美洲和奥洲并不多见[27]。本研究从番茄寄主分离的1株青枯菌FJAT-15304,鉴定为生化型Ⅱ、演化型Ⅰ,一方面说明青枯菌生化型分布的复杂性,另一方面也证明同一省同一寄主上存在不同生化型。青枯菌生化型在地理来源和寄主范围分布的复杂性,可能与种苗带毒和频繁调运有关[28]。
根据演化型分类框架,基于egl基因序列,每个演化型可进一步划分为一系列的序列变种。目前,青枯菌有超过15个序列变种[27,29]。序列变种分类与生理小种、寄主和地理来源相关[30]。潘哲超等[6]、刘海龙等[31]研究福建、贵州、湖北等地烟草青枯菌序列变种时发现,来自相同烟区的序列变种相对单一;He等研究发现,采集同一乡镇或毗邻乡镇的同一寄主的青枯菌,大多具有相同的序列变种[23]。本研究发现,福建茄科青枯菌种以下分类存在亚州分支的7个序列变种。寄主番茄存在的序列变种较多,遗传多样性较为丰富,与前人研究结果一致[32],表明福建番茄青枯菌的遗传多样性较高,这个研究结果将为抗病品种的选育和青枯病的防控提供理论参考。
Anuratha和 Gnananickam[33]研究表明,青枯菌具有复杂的遗传多样性,在离体条件下生防菌 DZ-9、BS2004和DZ-42对青枯菌生化型Ⅲ均表现出较显著的拮抗效果,但对生化型V却未显示明显的抑制作用。本研究同样发现,生防放线菌FJAT-31535对生化型Ⅲ的青枯菌FJAT-91具有明显的拮抗作用,而对生化型Ⅱ的青枯菌FJAT-15304无拮抗作用,这说明生防菌并非对所有生化型青枯菌都有抑制作用,从而给病害防治带来了一定的难度。此外,放线菌已被广泛用于生防菌剂的开发与利用[34],它们通常寄居根系土壤,保护植株免受病原真菌或细菌侵染[35]。本研究筛选到一株放线菌 FJAT-31535,对生化型Ⅲ的青枯菌具有明显的拮抗效果,未来可以考虑利用这个菌株防治由生化型Ⅲ的青枯菌引起的茄科青枯病。
