PDE5抑制剂介导ASK1/JNK蛋白低表达对输尿管梗阻大鼠肾组织损伤保护机制研究
2022-11-17马晓倩纪金宏何昆仑
马晓倩,纪金宏,唐 菲,何昆仑
输尿管梗阻是临床上最常见的尿路梗阻类型,属于慢性肾病的一种,会导致输尿管功能障碍及肾损伤,若不及时治疗很可能会导致尿路感染、肾积水,甚至是肾衰竭,因此探寻一种有效的治疗手段对其的预防及早期治疗具有深远意义[1-2]。肾脏纤维化是慢性肾病进展到终末期肾病的最终转归,故如何延缓和抑制肾纤维化的发生、发展己成为肾病专业医生与患者共同面对的共识与挑战[3]。近年来有研究发现,内质网应激诱导的细胞凋亡是导致肾纤维化的重要因素,其中凋亡信号调节激酶1(apoptotic signal regulated kinase 1,ASK1)及氨基末端激酶(jun N-terminal kinase,JNK)在细胞因子及应激诱导的细胞凋亡过程中起着关键作用[4]。磷酸二酯酶5(phosphodiesterase 5,PDE5)是机体内一种重要的水解酶,广泛分布于前列腺、膀胱及尿道等部位,其可特异性的水解一种细胞内关键第二信使环磷酸鸟苷,而环磷酸鸟苷是维持机体生物学稳态的重要因子,所以近年来医学专家对PDE5抑制剂的研究和开发表现出了极大热情[5]。但其在输尿管梗阻方面研究较少,因此本文就PDE5抑制剂介导ASK1/JNK蛋白表达对输尿管梗阻大鼠肾组织损伤保护机制进行研究探讨,为临床治疗输尿管梗阻提供理论基础。
1 材料与方法
1.1 材料动物材料:本实验选取斯贝福(北京)生物技术有限公司提供的40只SPF级SD雄性大鼠(合格证书为:SCXK(京)2019-0087),体质量150~200 g,大鼠单笼喂养,室温生长,模仿昼夜交替,昼夜各12 h,在常温下进行无菌自由进食、饮水2周,按照《实验动物管理条例》规定进行实验。
1.2 仪器与试剂本研究所用到的仪器及试剂如表1所示。
表1 仪器及试剂一览表
1.3 实验步骤
1.3.1 分组与模型制备选取40只SPF级SD雄性大鼠,随机分为正常组(N组),模型组(M组),刺芒柄花素组(F组),PDE5抑制剂组(P组),每组10只。取M、F、P组大鼠用10%水合氯醛进行麻醉,无菌条件下游离右侧出输尿管,用缝合线在肾盂处和输尿管上处分别结扎,并从两结扎点中间剪断输尿管,将其置于原位后,局部给与适量青霉素药粉,随后逐层缝合伤口,术后切口处碘伏消毒,清理血迹并注意观察渗血情况,当大鼠出现精神萎糜、形体瘦弱、粪便时软或不成形等现象时,则视为建模成功,N组不建立该模型,同期给与同体积生理盐水。建模成功后,对F组灌胃50 mg/kg的刺芒柄花素,对P组灌胃12 mg/kg的PDE5抑制剂,两组均1/d,持续14 d,N组、M组同期给与灌胃同体积生理盐水[1]。
1.3.2 检测步骤①标本采集:各组大鼠在实验结束后使其安乐死并称重,然后取双肾,PBS冲洗后称重,4%多聚甲醛固定48 h,进行常规梯度脱水、透明、浸蜡、石蜡包埋切片处理后放入冰箱中密封保存,同时于腹主动脉取血,在3000 r/min的条件下离心10 min(离心半径为8 cm),取上清液置于离心管中,放入冰箱中密封保存。②大鼠肾功能检测:取各组大鼠血清,用全自动生化分析仪检测血清中血肌酐(serum creatinine,Scr)及尿素氮(blood urea nitrogen,BUN),实验应严格按照仪器及试剂盒说明书进行操作。③大鼠肾组织HE染色:取部分肾组织,进行脱蜡、复水处理,然后用苏木素-伊红染液进行HE染色,除去多余染液后,梯度乙醇脱水、二甲苯透明,中性树胶封片处理,用光学显微镜进行组织病理学观察。④大鼠肾组织Masson染色:取部分肾组织,进行脱蜡、复水处理,然后用苏木素染色10 min,流水冲洗后,加入1%的盐酸乙醇分化5 s,水洗,再用丽春红酸性品红溶液染色10 min,0.2%的醋酸水洗5 min,1%的磷酸铝分化5 min,甲苯胺蓝溶液染色5 min,水洗后60℃烘干,梯度乙醇脱水、二甲苯透明后中性树胶封片处理,用光学显微镜进行组织病理学观察,并用病理影像分析系统分析计算出肾间质纤维化面积,即测定间质纤维化面积占同视野小管间质总面积的百分比。⑤大鼠肾组织中PDE5检测:采用免疫组化法检测,取部分肾组织,二甲苯脱蜡,乙醇进行梯度水化后,3%过氧化氢封闭15 min以进行组织抗原修复,完成后PBS洗涤3次,然后用10%的山羊血封闭30 min,加入稀释后的PDE5一抗(1:100),4℃孵育过夜,PBS洗涤3次,室温平衡30 min,加入生物素标记的二抗,37℃孵育30 min,PBS洗涤3次,用DAB显色试剂盒进行显色10 min,水洗后乙醇梯度脱水,二甲苯透明,中性树胶封片后用电子显微镜进行观察。⑥大鼠肾组织中ASK1/JNK蛋白表达检测:免疫印迹法检测,取部分肾组织,剪碎后加入1 mL RIPA裂解液,充分搅拌后冰上裂解10 min,在4℃、12000 r/min条件下离心20 min(离心半径为8 cm),取上清液,用BCA法测定蛋白表达,首先制作浓度梯度的BSA标准品及BCA工作液,然后将各组蛋白调整至等浓度后加入BCA工作液,用电泳仪进行电泳,电泳完成后将凝胶上蛋白用半干法转移至甲醇活化的PVDF膜上,转膜、封闭后,加入稀释的ASK1、JNK的一抗(1∶1000),4℃摇床振荡孵育过夜后洗膜;加入稀释的ASK1、JNK二抗(1:5000),37℃轻摇,然后在室温下孵育2 h;洗膜后,用ECL荧光试剂盒测定结果,计算与GAPDH比值求得ASK1、JNK蛋白的相对表达含量。⑦体外细胞实验:取对数生长的肾小管上皮细胞,一组给与PDE5抑制剂记为A组,一组给与等体积生理盐水,记为B组,免疫印迹法检测ASK1/JNK蛋白表达。
1.4 统计学处理采用SPSS 23.0进行统计分析,实验数据符合正太分布及方差齐性,描述采用均数±标准差();多组比较采用单因素方差分析,事后检验采用SNK法或t检验进行组间两两比较,P<0.05表示差异有统计学意义。
2 结果
2.1 各组大鼠肾功能相关指标检测结果与N组比较,M组肾脏指数、Scr及BUN含量明显增多(P<0.05),与M组比较,F、P两组肾脏指数、Scr及BUN含量减少(P<0.05),且P组肾脏指数、Scr及BUN含量比F组降低显著(P<0.05)。见表2。

表2 肾功能相关指标检测结果
2.3 各组大鼠HE染色结果N组肾组织结构、肾小球、肾小管形态正常且排列整齐,未见系膜细胞与基质增生及硬化肾小球组织等损伤情况,而M组肾小管可见空泡样变性和明显皮质扩张,肾小管上皮细胞出现萎缩、脱落和坏死,且可见大量炎性细胞浸润,而与M组比较,F组、P组肾小球、肾小管情况明显改善,炎细胞浸润等现象明显减轻。见图1。

图1 各组大鼠肾组织HE染色(×200)
2.3 各组大鼠各组Masson染色结果N组可见细胞核呈红色,肾间质无明显纤维组织增生,而M组可见大量纤维组织增生,肾间质胶原相对面积增大,与M组比较,F组、P组肾间质纤维化增生程度、炎性细胞浸润程度明显减轻,肾间质胶原相对面积明显缩小。见图2。
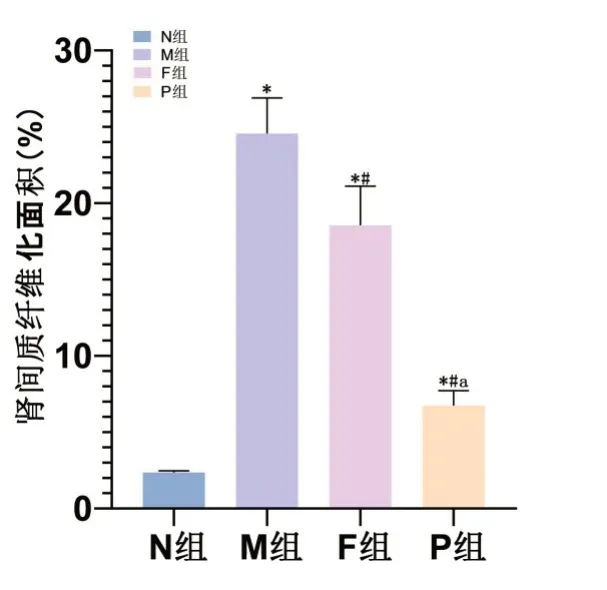
图2 各组大鼠Masson染色下肾间质纤维化面积与N组比较,*P<0.05,与M组比较,#P<0.05,与F组比较,aP<0.05
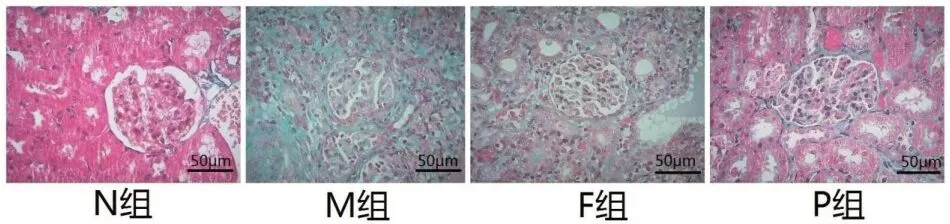
图3 各组大鼠肾组织结构Masson染色(×200倍)
2.4 各组大鼠肾组织中PDE5免疫组化结果与N组比较,M组肾组织中PDE5阳性表达升高(P<0.05),与M组比较,F、P两组肾组织中PDE5阳性表达降低(P<0.05),且P组肾组织中PDE5阳性表达比F组降低显著(P<0.05)。见图4,图5。
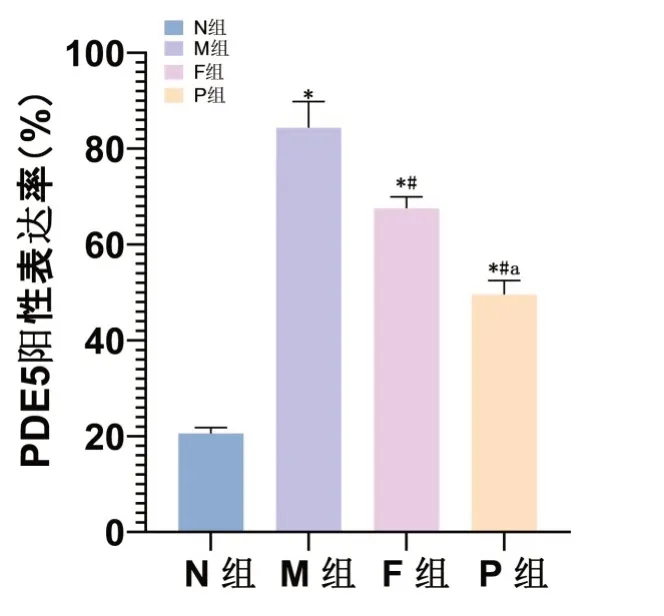
图4 各组大鼠肾组织中PDE5的阳性表达与N组比较,*P<0.05,与M组比较,#P<0.05,与F组比较,aP<0.05
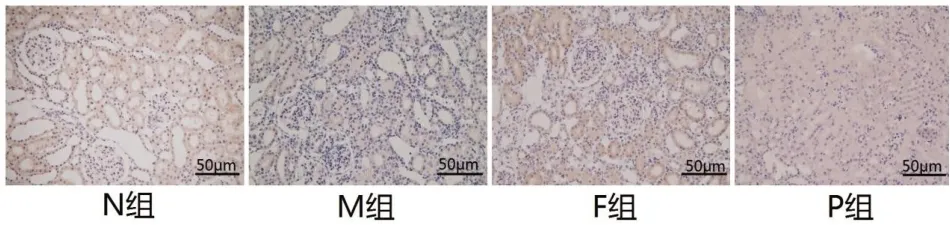
图5 各组大鼠肾组织PDE5免疫组化染色(×200)
2.5 各组大鼠肾组织中ASK1/JNK蛋白表达结果与N组比较,M组肾组织中ASK1、JNK蛋白表达升高(P<0.05),与M组比较,F、P两组肾组织中ASK1、JNK蛋白表 达 降低(P<0.05),且P组 肾 组织中ASK1、JNK蛋白表达比F组降低显著(P<0.05)。见图6,图7。
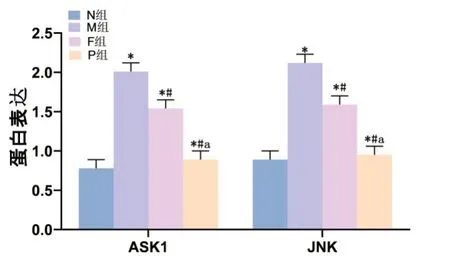
图6 各组大鼠肾组织中ASK1、JNK蛋白表达与N组比较,*P<0.05,与M组比较,#P<0.05,与F组比较,aP<0.05

图7 各组大鼠肾组织中ASK1、JNK蛋白表达电泳图
2.6 体外实验结果与B组比较,A组肾小管上皮细胞中ASK1、JNK蛋白表达显著降低(P<0.05)。见图8,图9。
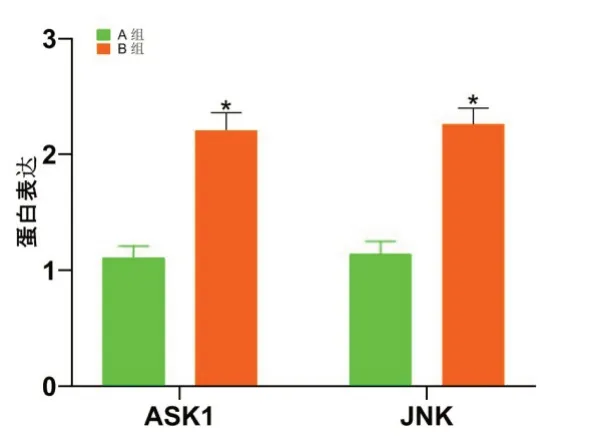
图8 各组肾小管上皮细胞中ASK1、JNK蛋白表达与A组比较,*P<0.05

图9 各组肾小管上皮细胞中ASK1、JNK蛋白表达电泳图
3 讨论
输尿管梗阻一般是由先天或后天因素导致的输尿管发生缩窄、变性、扭曲、损伤的一种慢性肾病,而随着人们生活习惯的不断变化,该病的患病率呈逐年上升趋势[6]。输尿管梗阻的治疗及预后都不容乐观,这导致其已经成为全球主要的公共健康问题之一,这对患者的生产、生活造成了一定的负担,因此探寻一种有效的治疗手段就显得尤为重要[7]。
本文研究发现,与M组比较,F、P两组肾脏指数、Scr及BUN含量显著减少,且P组比F组降低显著,这说明PDE5抑制剂可显著改善大鼠肾功能。刺芒柄花素为异黄酮类化合物,有研究表明其在抗细胞凋亡、改善肾脏病理损伤及肾功能等方面占有重要地位,可对肾脏起到保护作用[8]。而PDE5抑制剂是临床上治疗勃起功能障碍的一线药物,其具有免疫调节、抗炎、抗聚集等作用,同时也可广泛用于良性前列腺增生症以及下尿路综合症等疾病[9]。Scr是含氮的有机物代谢的终产物,BUN则是蛋白质代谢的终产物,这两者是反应肾功能的重要指标[10]。输尿管梗阻造成的肾损伤会导致肾小球毛细血管的孔径大小与电荷屏障出现异常,从而促使肾的代谢滤过作用降低,进而导致Scr及BUN过度蓄积,最终对机体产生毒害作用,并进一步对肾功能造成影响[11]。而对于输尿管梗阻大鼠,PDE5抑制剂可能是通过抑制氧化应激及炎症反应,影响细胞因子表达,调节糖脂代谢、细胞增殖及凋亡等,来增强大鼠肾功能,修复肾损伤,从而减少Scr及BUN沉积,进而降低其毒害作用,最终改善肾功能。许春花等[12]研究发现,西地那非能减轻肾纤维化引起的肾功能损伤,可有效降低输尿管梗阻大鼠血清中Scr及BUN含量,这与本文结果类似。
本文研究表明,PDE5抑制剂可显著改善大鼠肾组织病理形态,减少纤维组织增生,降低肾组织纤维化面积,这说明其疗效显著,可有效改善肾损伤并对肾脏起到一定保护作用。输尿管梗阻在病理状态下,肾小管上皮细胞基底膜会受到破坏,从而使由活化上皮细胞转变的间充质细胞顺利通过受损的基膜,运动到间质中增殖分化为成纤维细胞,最终使肾脏逐渐纤维化[13-14]。而对于输尿管梗阻大鼠,PDE5抑制剂可能是通过促进相关因子的表达,抑制促炎基因的细胞内信号级联反应表达等,来改善内皮功能,从而提高上皮细胞间的粘附性,抑制上皮细胞分化,抑制细胞外基质过度积聚和沉积等,进而抑制成纤维细胞增殖与活化,最终减轻肾功能损伤,抑制肾纤维化病变。孙伟等[15]研究发现,PDE5抑制剂他达拉非对肾脏具有保护作用,其可有效改善肾纤维化及肾小管萎缩情况;张翠等[16]研究发现,刺芒柄花素对输尿管梗阻大鼠具有显著疗效,其可抑制ASK1、JNK蛋白表达,阻止细胞凋亡,从而减缓梗阻性肾病病理进程的发生和发展,这与本文结果类似。
本文研究发现,与M组比较,F、P两组肾组织中PDE5、ASK1、JNK表达显著降低,且P组比F组降低显著,这说明PDE5抑制剂可显著抑制ASK1/JNK蛋白表达,且体外实验表明,PDE5抑制剂可显著抑制ASK1、JNK表达,提示PDE5抑制剂可能通过抑制ASK1/JNK蛋白表达发挥作用。有研究表明,PDE5在肾脏等相关疾病中扮演着重要角色,其参与调控了平滑肌的动态活力、腺组织的分泌和组织细胞增殖等疾病相关进程[17]。ASK1是维持细胞稳态的关键分子,JNK是ASK1的下游效应分子,也是凋亡蛋白酶连锁反应的必要条件,当ASK1在病理条件下被激活后,就会激活下游JNK信号通路,从而诱导细胞凋亡和形态学改变,进而导致包括肾脏疾病等多种疾病的发生[18-19]。而对于输尿管梗阻大鼠,PDE5抑制剂可能是通过抑制PDE5的表达,来增加环磷酸鸟苷的浓度使其发挥特有的生物学作用,从而抑制内质网应激等应激反应,抑制相关上游信号激活等,从而抑制ASK1过度活化,进而减轻其下游JNK通路激活,抑制上皮细胞凋亡,减少炎症反应及纤维化,最终对肾脏起到一定保护作用。张思琪研究发现[20],刺芒柄花素能够保护肾间质纤维化大鼠的肾功能,降低ASK1、JNK蛋白的表达,从而阻止肾小管上皮细胞凋亡所致的肾间质纤维化,这与本研究结果类似。
综上所述,PDE5抑制剂可有效改善输尿管梗阻大鼠肾组织损伤,提高肾功能,抑制PDE5水平,其机制可能与降低ASK1/JNK蛋白表达有关。
