整合SV40 Large T抗原基因的人胚肺成纤维细胞IMR90的蛋白质组和代谢组研究
2022-11-17向升,余巍
向 升,余 巍
(复旦大学 生命科学学院,上海 200438)
随着质谱仪器的进步和实验方法的发展,组学分析发展成为生命科学的热门研究领域。蛋白质是许多细胞生物学过程中的关键角色。蛋白质的表达、功能和相互作用是细胞动态过程的基础[1]。此外,细胞的整体蛋白质水平会响应外部刺激而发生波动,具有动态性。蛋白质组学能够帮助我们捕捉细胞整体蛋白质水平的变化,是理解基因功能最重要的方法之一,并且对于疾病的早期诊断、发展和预后检测至关重要[2]。细胞中的代谢物反映了细胞的新陈代谢水平。细胞产生的代谢物参与细胞内众多生物学过程,如表观遗传调控、酶催化的化学反应等,对细胞功能至关重要[3]。因此,代谢组拥有大量信息,被认为可以预测表型[4]。蛋白质组学和代谢组学联合分析,能够帮助我们探究将基因型与表型联系起来的潜在因果机制。
蛋白质稳态是细胞维持正常功能的基础。细胞衰老伴随着功能障碍蛋白和受损细胞器的逐步积累。这些无效成分的积累和聚集使得细胞蛋白稳态被破坏,并增加了细胞死亡的风险[5]。对秀丽隐杆线虫5 000多种蛋白质进行组学分析,结果表明该线虫的蛋白质组在衰老过程中经历了广泛的重塑[6]。此外,在细胞代谢过程产生并逐步积累的分子损伤也是衰老的主要驱动力[7-9]。通过非靶向代谢组学,研究人员发现,随着年龄的增长,代谢物的多样性(不同代谢物的总数)会增加[10]。因此,蛋白质组学和代谢组学的联合分析有望帮助我们深入理解细胞衰老过程中基因型与表型之间的潜在联系。
IMR90是人胚肺成纤维细胞,具有有限的增殖寿命,会随着不断传代而进入危机期。前人研究表明,SV40转化IMR90细胞(未进入增殖危机)后,该细胞具有有限的增殖寿命,并表现出衰老相关表型,但不会进入衰老周期停滞状态[11]。在这项研究中,我们通过SA-β-Gal染色实验表明,整合SV40 Large T抗原基因的IMR90细胞——IMRT细胞,β-半乳糖苷酶(β-Gal)表达水平升高;与此同时,IMRT细胞中的衰老相关标志物表达水平显著升高,与IMR90细胞相比,表现出衰老样分化的迹象。我们通过蛋白质组学和靶向代谢组学进行联合分析,比较IMR90与IMRT中的差异蛋白质和差异代谢物。发现一些差异性代谢物如6-磷酸葡萄糖、肉碱、磷酸胆碱、亮氨酸-异亮氨酸、谷氨酰胺和丙氨酸等与蛋白质组学中鉴定的代谢通路中的蛋白水平的变化有密切联系,有望用作体内衰老成纤维细胞的潜在生物标志物。进一步在IMR90细胞中沉默谷胱甘肽过氧化物酶1基因GPX1则显著促进了IMR90细胞衰老标志物的表达升高,表明GPX1在细胞衰老进程中的重要作用。
1 材料与方法
1.1 材料与试剂
Gluta-max(Invitrogen,35050),NEAA(Invitrogen,11140),Sodium pyruvate(Invitrogen,11360070),MEM培养基(Gibco,2913505)和FBS(Gibco,51411C)购于赛默飞公司。反转录试剂盒(KR116-02)购于上海天根生物有限公司。溶酶体β-半乳糖苷酶染色试剂盒(C0605)购于碧云天公司。IMRT细胞由同济大学毛志勇实验室馈赠,IMR90细胞购于中国科学院典型培养物保藏委员会干细胞库。
1.2 SV40 Large T抗原基因的验证
培养IMRT和IMR90细胞,待细胞长满之后,用TRIzol(Life Technologies,Rockville,美国)法提取总RNA。使用反转录试剂盒,将RNA反转录成cDNA,以cDNA为模板,分别用SV40 Large T抗原基因和GAPDH的特异性引物进行PCR。使用的引物为:SV40-F(5′-CTG ACTTTGGAGGCTTCTGG-3′)和SV40-R(5′-GCAGTAGCAATCAACCCACA-3′)。GAPDH-F(5′-ATGTTCGTCATGGGTGTGAACCA-3′)和GAPDH-R(5′-TGGCAGGTTTTTCTAGACGGCAG-3′)。PCR结束后,用1%的琼脂糖凝胶电泳检测。
1.3 SA-β-Gal染色实验
细胞生长密度良好时,吸除培养基,PBS洗去表面残余培养基,加入2 m Lβ-半乳糖苷酶染色固定液,室温固定15 min。吸除细胞固定液,用PBS清洗细胞,3 min,洗3次。吸除PBS,每瓶加入2 m L染色工作液。用封口膜封住培养瓶,37℃孵育过夜。普通光学显微镜下观察,拍照。
1.4 蛋白质组学样品制备及上机
培养IMRT和IMR90细胞。消化,离心收集细胞,计数。每组细胞设置3个生物学重复,确保每组细胞的数量为1×106个。预冷的PBS清洗细胞,除尽培养基,获得细胞沉淀。液氮速冻,样品保存在-80℃。蛋白质组学分析在复旦大学人类表型组研究院蛋白质组平台上进行。采用非标记定量蛋白质组学(Label-free)技术,不同样品分别经蛋白提取、Trypsin酶解、肽段分级以及高精度质谱分析后,比较各样本质谱数据进行蛋白质的相对定量。
1.5 代谢组学样品制备及上机
培养IMRT和IMR90细胞。每组细胞设置3个生物学重复,确保每组细胞的数量为1×106个。预冷的PBS洗去细胞表面的残留培养基,加入80%甲醇(HPLC级),-80℃孵育20 min;4℃,4 000 g离心10 min,保留上清。干燥浓缩样品,干燥后的代谢物样品保存在-80℃。干燥后的样品加入100μL的乙腈,涡旋30~60 s;4℃,16 000 r/min,离心15 min。取80μL上清,转移至进样小瓶中,上机分析。代谢组学分析在复旦大学代谢与整合生物学研究院平台上进行。
1.6 差异蛋白和差异代谢物的选择
在分析质谱数据时,通过比较不同样本中同一肽段的质谱信号强度和谱图计数对相应的蛋白质进行相对定量。基于质谱得到的数据,对鉴定到的两组蛋白的丰度进行差异分析(t-test),以两组蛋白丰度平均值的Fold Change>2,P<0.05为阈值确定差异表达蛋白。代谢组学的质谱数据对应的是代谢物的浓度。基于质谱得到的数据,对鉴定到的两组蛋白的丰度进行差异分析(t-test),以两组蛋白丰度平均值的Fold Change>2,P<0.05为阈值确定差异表达蛋白。
1.7 生物信息学分析
为进一步比较IMRT和IMR90两组生物学功能的差异,我们采用基因本体(Gene Ontology)数据库(http:∥www.geneontology.org/),按照细胞组分、生物学过程、分子功能对差异蛋白质进行GO分类。采用京都基因与基因组百科全书(KEGG)(http:∥www.genome.jp/kegg/)注释通路数据库分析差异蛋白质和差异代谢物富集的代谢通路。
1.8 si-RNA基因沉默
依托于上海吉玛制药技术有限公司,合成siRNA:GPX1-F(5′-AUUCUCGAUAAGUAGUACCTT-3′)和GPX1-R(5′-GGUACUACUUAUCGAGAAUTT-3′);阳性对照GAPDH-F(5′-UGACCUCAACUACAUGGUUTT-3′)和GAPDH-R(5′-AACCAUGUAGUUGAGGUCATT-3′),阴性对照-F(5′-UUCUCCGSSCGUGUCSCGUTT-3′)和R(5′-ACGUUGACACGUUCGGAGAATT-3′),使用Lipofectamine®RNAiMAX Reagent(Invitrogen)对细胞进行瞬时转染,siRNA最终浓度为100 nmol/L。转染6 h更换培养基,48~60 h后,提取RNA检测。
1.9 RT-PCR检测
通过TRIzol法提取RNA,反转录合成cDNA,以cDNA为模板进行检测。使用的RT-PCR引物:IL6-F(5′-CACCGGGAACGAAAGAGAAG-3′)和IL6-R(5′-TCATAGCTGGGCTCCTGGAG-3′),IL8-F(5′-ACATGACTTCCAAGCTGGCC-3′)和IL8-R(5′-CAGAAATCAGGAAGGCTGCC-3′),CDKN1A-F(5′-TCACTGTCTTGTACCCTTGTGC-3′)和CDKN1A-R(5′-GGCGTTTGGAGTGGTAGAAA-3′),GPX1-F(5′-GCGGGGCAAGGTACTACTTA-3′)和GPX1-R(5′-CTCTTCGTTCTTGGCGTTCT-3′),GAPDH-F(5′-AGCCACATCGCTCAGACAC-3′)和GAPDH-R(5′-GCCCAATACGACCAAATCC-3′)和内 参L3MBTL2-F(5′-CCAAGACCAAGAGGTTCTGC-3′)和L3MBTL2-R(5′-TTTGGTCGGTGGTTTTCC-3′)。所有PCR程序均进行44个循环。
1.10 数据统计
数据采用Excel 2015、SPSS 22.0和R 3.5.1分析软件进行统计分析和作图。
2 结果
2.1 SV40病毒的Large T抗原基因的整合
SV40病毒的Large T抗原基因能够诱导细胞的转化并激发细胞的增殖潜能[12]。将SV40 Large T抗原基因整合进正常的人胚肺成纤维细胞IMR90的基因组中,能够诱导IMR90细胞转化。我们先对IMRT细胞中的SV40 Large T抗原基因进行验证。结果如图1(a)所示,在IMR90细胞中已整合了SV40病毒的Large T抗原基因。通过SA-β-Gal染色实验,比较IMR90与IMRT细胞,结果如图1(b)所示,视野中的IMRT细胞被染成蓝色,而正常传代的IMR90细胞没有被染上颜色。这表明,IMRT细胞与衰老相关的β-半乳糖苷酶活性高,表现出衰老细胞相关的表型。
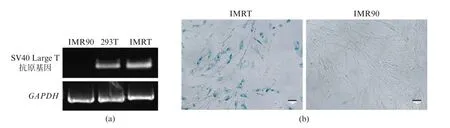
图1 SV40 Large T抗原基因的插入及相关表型的验证Fig.1 Verification of the phenotype and insertion of SV40 Large T in IMR90
2.2 IMRT和IMR90的蛋白质组学分析
我们通过非标记定量蛋白质组学的方法,对IMRT和IMR90细胞的蛋白质组学进行分析(图2,见第618页)。图2(a)为蛋白质组学鉴定到的结果,我们在IMRT组和IMR90组细胞中,都鉴定到了约3 300种蛋白。相关性分析结果(图2(b))显示IMRT与IMR90组内样本的相关性明显高于组间样本的相关性。主成分分析(Principal Component Analysis,PCA)结果(图2(c))显示IMRT和IMR90的蛋白质组具有明显的差异。结果表明,SV40 Large T抗原基因插入后的IMR90细胞中蛋白质含量和种类发生了变化。
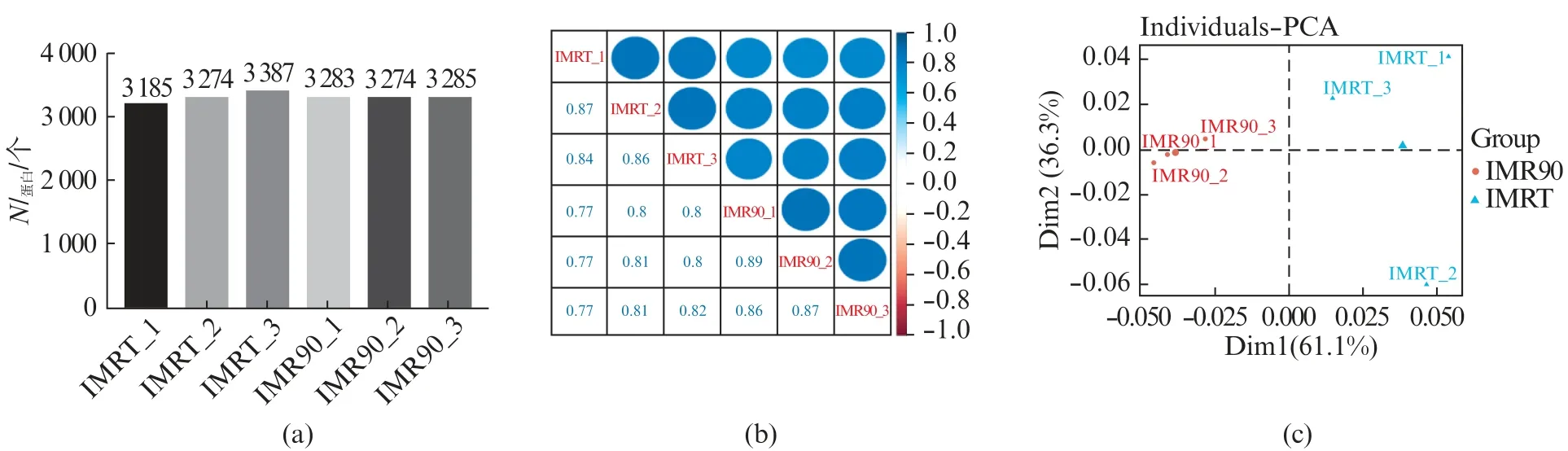
图2 IMRT和IMR90的蛋白质组学鉴定与分析Fig.2 Identification and analysis of proteomics of IMRT and IMR90
基于质谱鉴定的蛋白,我们对每个样品中的每个蛋白的表达量进行了可视化。如图3(a)所示,IMRT组的蛋白质表达量与IMR90组蛋白质的表达量有显著不同。我们对两组蛋白的丰度进行差异分析(ttest),以两组蛋白丰度平均值的Fold Change>2或<0.5(IMRT/IMR90),P<0.05为阈值确定差异表达蛋白。一共鉴定到了402个差异表达蛋白,其中在IMRT组中表达上调的蛋白有210个,在IMRT组中表达下调的蛋白有192个,如图3(b)所示。
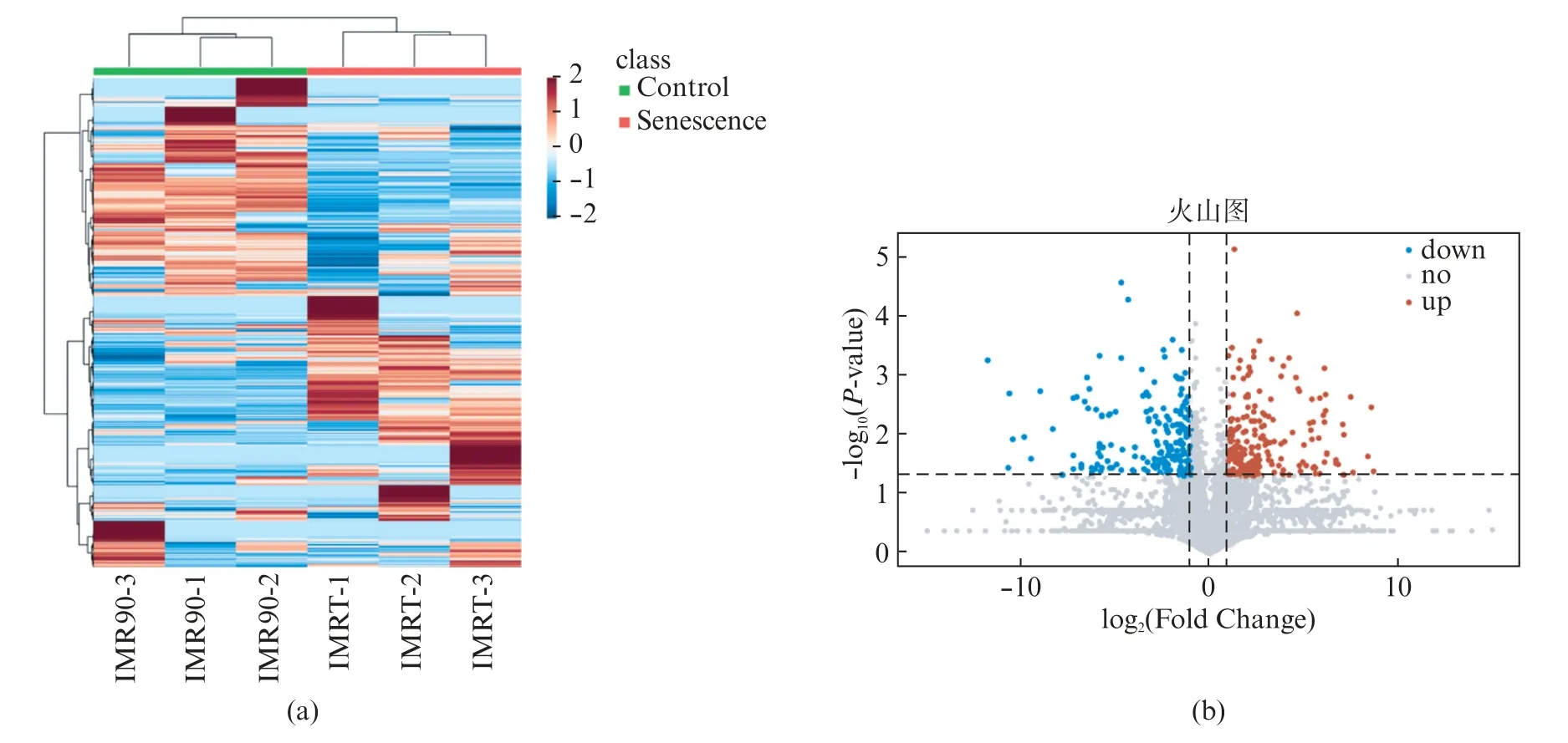
图3 IMRT和IMR90组间差异表达蛋白质分析Fig.3 Analysis of differentially expressed proteins between IMRT and IMR90 groups
2.3 差异蛋白的GO功能注释分析和KEGG通路分析
对IMRT和IMR90中差异表达的蛋白质进行GO功能注释分析,分别从生物过程、细胞组成和分子功能等方面进行注释。分析结果表明,IMRT/IMR90的下调蛋白参与36个生物过程,22个细胞组成和24个分子功能;IMRT/IMR90的上调蛋白参与46个生物过程,41个细胞组成和26个分子功能。根据P值进行排序,选择前15个进行可视化作图(图4)。在生物过程分类中,代谢过程和细胞过程等过程占据较大的比例。上调蛋白质参与r RNA剪切、三羧酸循环、蛋白质转运和氧化还原等过程;下调蛋白质参与糖酵解过程、糖异生过程、凋亡过程的调控和细胞增殖等过程;在细胞组成分类中,大部分差异蛋白质位于细胞质基质和细胞器中。上调蛋白质参与构成线粒体的各个部分,包括线粒体内膜,线粒体基质以及线粒体呼吸链复合体Ⅰ等细胞组分;下调蛋白参与构成细胞质、细胞核、细胞外泌体和细胞与细胞之间的黏附连接(Cell-cell adherens junction)等细胞组分。在分子功能分类中,酶的催化活性和蛋白质结合活性所占比例较高。上调蛋白具有蛋白质结合、电子载体活性(Electron carrier activity)、NADH脱氢酶活性和GTPase活性(GTPase activity)等功能;下调蛋白质具有蛋白质结合、poly(A)RNA结合(poly(A)RNA binding)、镁离子结合、微管结合和转录因子结合等功能。
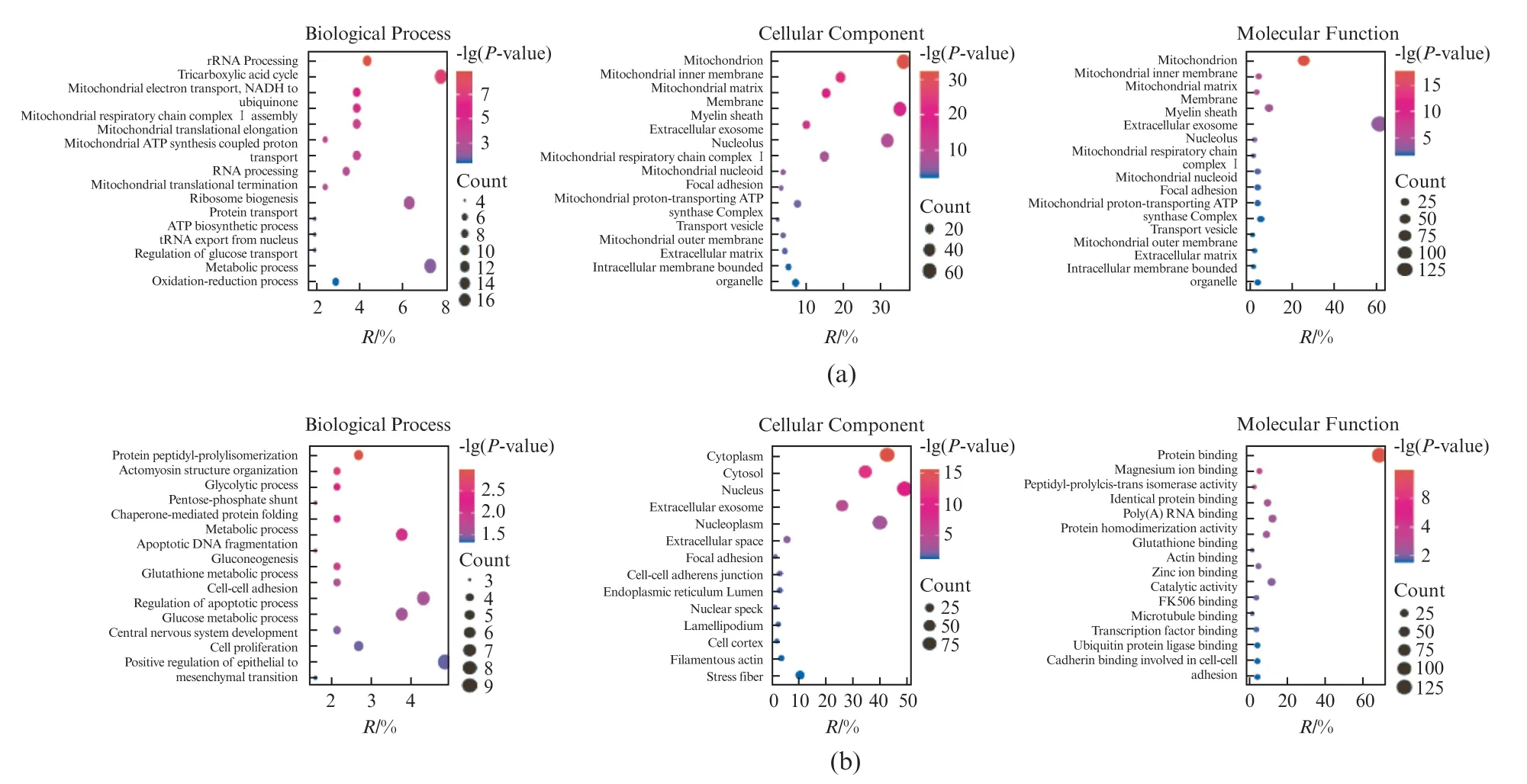
图4 差异表达蛋白的GO分析结果Fig.4 GO analysis of differentially expressed proteins
为进一步比较IMRT和IMR90两组细胞生物学功能的差异,我们使用KEGG对两组的差异蛋白进行通路富集。通过KEGG通路显著性富集发现,在IMRT组中上调的差异蛋白质主要富集于三羧酸循环((TCA cycle)、氧化磷酸化(Oxidative phosphorylation)、丙酸酯代谢(Propanoate metabolism)、丙酮酸代谢(Pyruvate metabolism)、脂肪酸降解(Fatty acid degradation)等代谢途径,以及帕金森病(Parkinson disease)、亨廷顿病(Huntington disease)、阿尔茨海默病(Alzheimer's disease)、非酒精性脂肪肝病(Non-Alcoholic Fatty Liver Disease,NAFLD)等衰老相关疾病的通路中(图5(a),见第620页)。下调蛋白质显著富集于谷胱甘肽代谢(Glutathione metabolism)、磷酸戊糖途径(Pentose phosphate pathway)、糖酵解/糖异生(Glycolysis/Gluconeogenesis)、丙氨酸,天冬氨酸和谷氨酸代谢(Alanine,aspartate and glutamate metabolism)等代谢途径(图5(b),见第620页)。
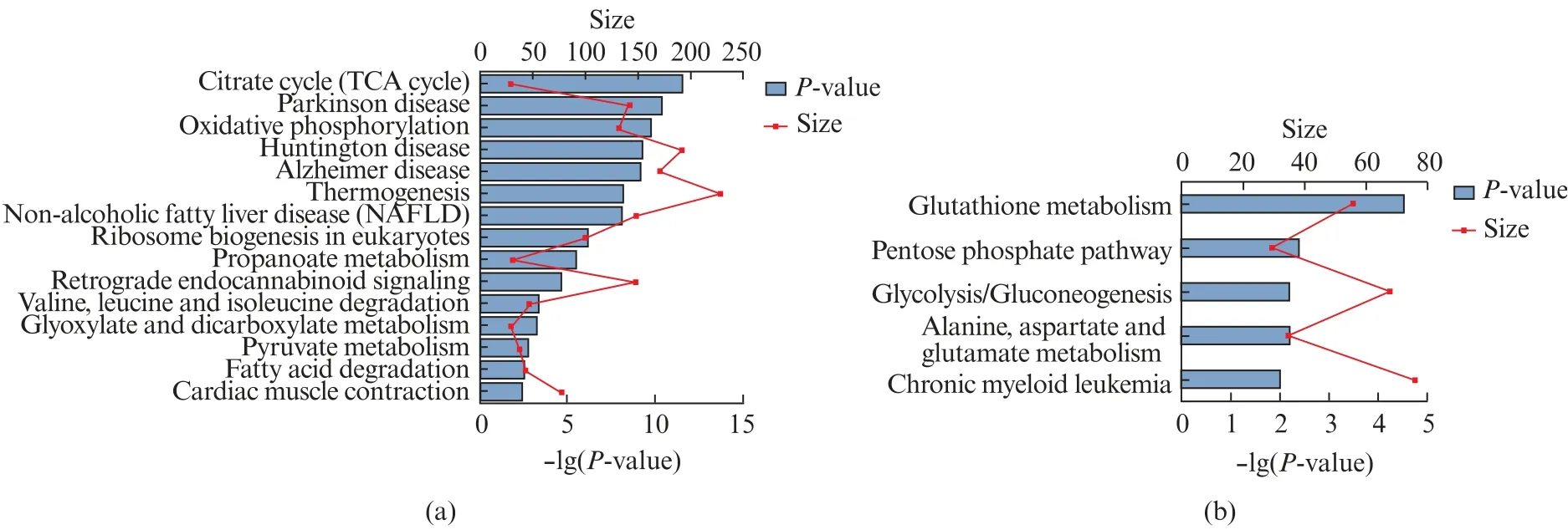
图5 差异蛋白通路富集分析结果Fig.5 Analysis of differential protein pathway enrichment
2.4 IMRT和IMR90的代谢组质谱鉴定分析
代谢物质谱鉴定采用三重四极杆5500TMLC/MS/MS系统。该系统是对样品进行靶向代谢物分析,可以检测和(半)定量分析约280种代谢物。对两组样品的质谱结果进行相关性分析,结果显示IMRT与IMR90组内样本的相关性明显高于组间样本的相关性(图6(a),见第620页)。主成分分析结果(图6(b),见第620页)显示IMRT和IMR90的代谢物组具有明显的差异。结果表明,IMRT细胞中的代谢水平发生了显著变化。
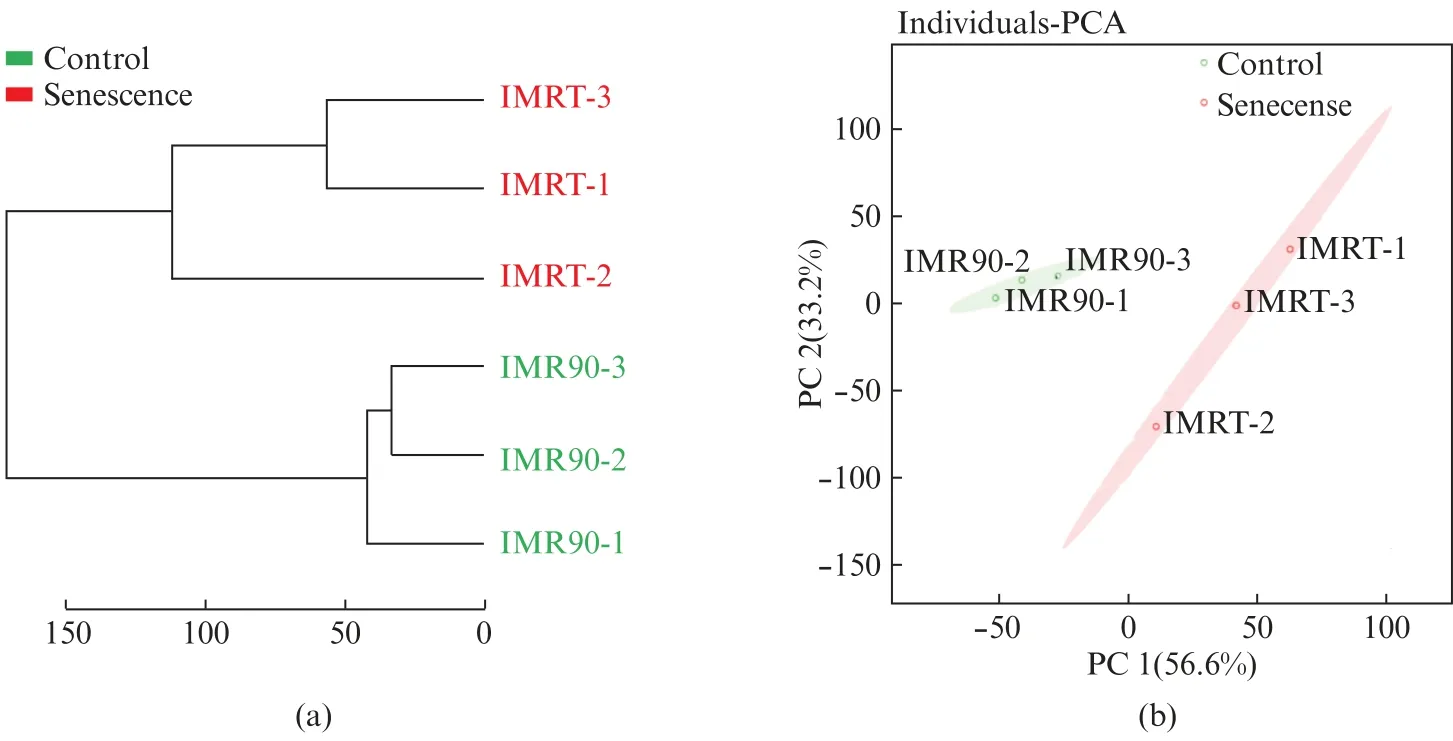
图6 IMRT和IMR90的代谢组学鉴定分析Fig.6 Metabolomics analysis of IMRT and IMR90
基于质谱鉴定的代谢物,我们对每个样品中的代谢物,依据t-test的分析结果,根据P值选择了前30的代谢物的浓度进行可视化。如图7(a)(见第621页)所示,IMRT组的代谢物浓度与IMR90组的代谢物浓度有显著不同。基于此,我们对两组代谢物的丰度进行差异分析(t-test),以两组蛋白丰度平均值的Fold Change>2或<0.5(IMRT/IMR90),P<0.05为阈值确定差异代谢物。一共鉴定到了16个差异代谢物,其中在IMRT组中上调的代谢物有5个,在IMRT组中下调的代谢物有11个(图7(b))。
2.5 差异代谢物的KEGG通路富集分析
为进一步比较IMRT和IMR90两组细胞生物学功能的差异,我们使用KEGG对两组的差异代谢物进行通路富集。KEGG通路富集结果(图8)显示差异代谢物主要富集在氨基酸代谢通路、糖类代谢通路、脂质代谢通路以及核苷酸代谢通路中。包括丙氨酸,天冬氨酸和谷氨酸代谢(Alanine,aspartate and glutamate metabolism)、精氨酸生物合成(Arginine biosynthesis)、赖氨酸降解(Lysine degradation)、淀粉和蔗糖代谢(Starch and sucrose metabolism)、戊糖和葡萄糖醛酸酯的相互转化(Pentose and glucuronate interconversions)、膦酸酯和次膦酸酯代谢(Phosphonate and phosphinate metabolism)、甘油磷脂代谢(Glycerophospholipid metabolism)、嘌呤代谢(Pyrimidine metabolism)和嘧啶代谢(Purine metabolism)。
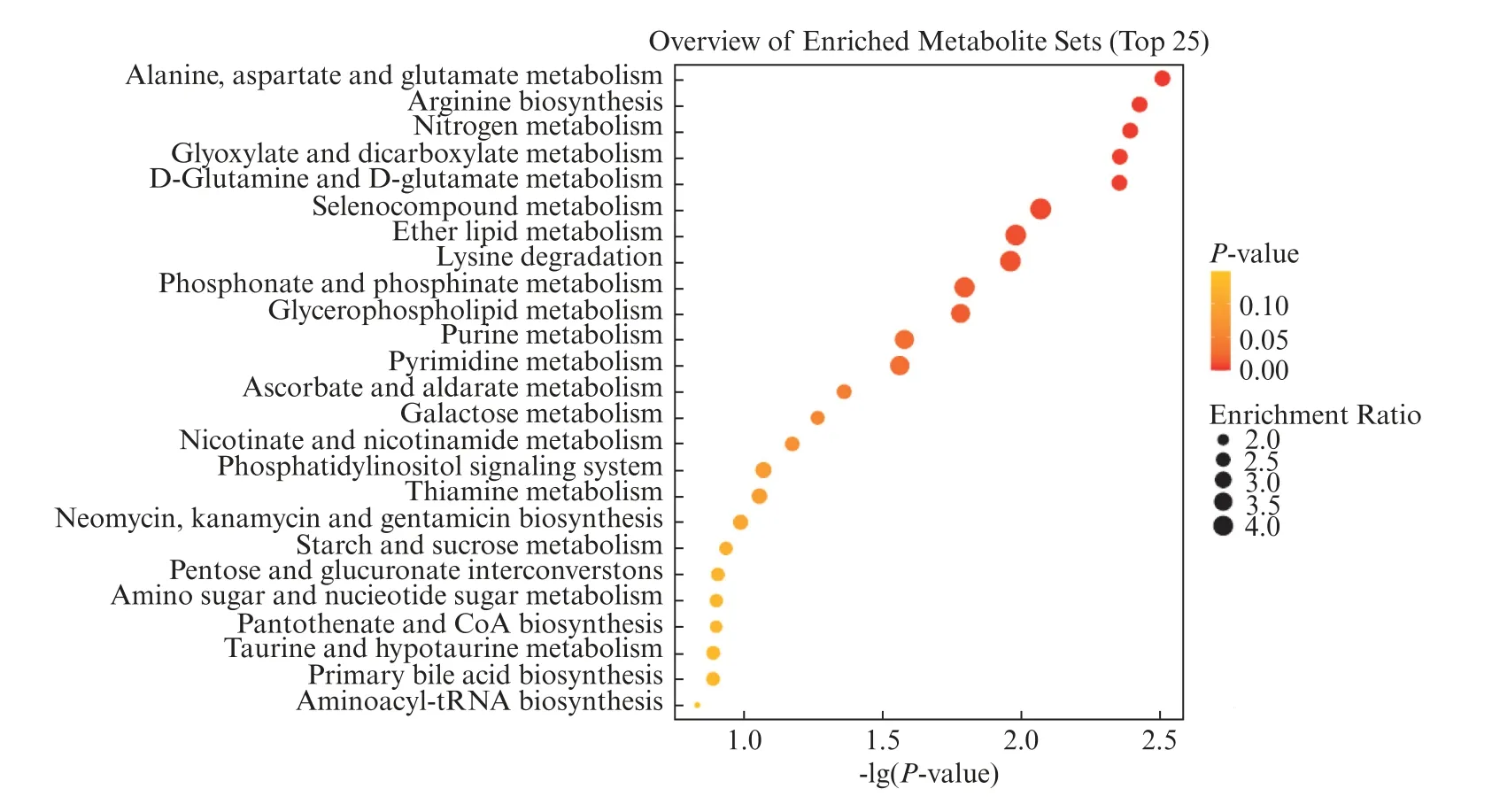
图8 差异代谢物通路富集分析结果Fig.8 Analysis of differential metabolites pathway enrichment
2.6 IMRT细胞的代谢组学分析证实蛋白组学的改变
在IMRT细胞中,依据代谢组数据的分析,6-磷酸葡萄糖、丙氨酸、谷氨酰胺、亮氨酸-异亮氨酸和胆碱以及磷脂酰胆碱等,相较于IMR90组有显著差异(图9,见第622页)。6-磷酸葡萄糖显著减少,而6-磷酸葡萄糖是糖酵解和磷酸戊糖途径的重要中间产物。这与蛋白质组学中鉴定到葡萄糖磷酸变位酶1(PGM1)和6-磷酸葡萄糖脱氢酶(G6PD)的表达下调相关。肉碱在细胞内能够把脂肪酸运输到线粒体,磷酸胆碱在细胞能够与胆碱互相转化,胆碱参与脂肪酸代谢,肉碱和磷酸胆碱含量上调,与脂肪酸降解途径中特长链特异性酰基辅酶A脱氢酶(ACADVL)以及短链烯酰辅酶A水合酶(ECHS1)上调相关。亮氨酸-异亮氨酸的上调,与蛋白质组学中鉴定到的乙酰辅酶A乙酰转移酶1(ACAT1)的上调相关,该酶调控异亮氨酸的分解代谢。丙氨酸的下调与蛋白质组学观察到的丙氨酸、天冬氨酸和谷氨酸的代谢通路下调相吻合。谷氨酰胺在细胞内能够参与合成谷胱甘肽,谷氨酰胺的下调与蛋白质组学中鉴定到的谷胱甘肽过氧化物酶1(GPX1),谷胱甘肽S-转移酶M2(GSTM2),谷胱甘肽S-转移酶M3(GSTM3),谷胱甘肽S-转移酶P1(GSTP1)以及谷氨酸-半胱氨酸连接酶(GCLM)的下调相关。
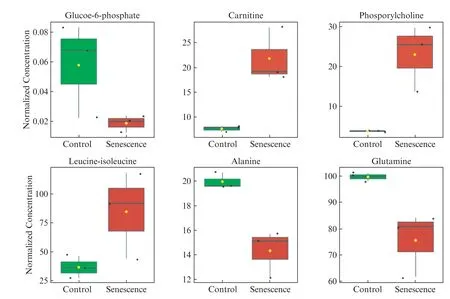
图9 6种差异代谢物的浓度分析Fig.9 Concentration of six differential metabolites
2.7 沉默GPX1促进IMR90细胞衰老标志物的表达升高
在IMRT细胞中,蛋白质组学中鉴定到的谷胱甘肽过氧化物酶1(GPX1)含量下调,与此同时,代谢组中鉴定到谷氨酰胺显著下调。GPX1属于谷胱甘肽过氧化物酶家族,在细胞内能够催化谷胱甘肽还原有机氢过氧化物和H2O2,从而保护细胞免受氧化损伤。在IMRT细胞中,与IMR90细胞相比,衰老相关标志物表达显著升高,结果如图10(a)所示。我们在IMR90细胞中,用siRNA沉默GPX1(图10(b)),并检测处理之后IMR90细胞中衰老标志物的表达,结果显示,GPX1沉默之后,衰老标志物的表达升高(图10(c))。SA-β-Gal染色显示,处理组中,阳性细胞的比率占91.1%(图10(d))。
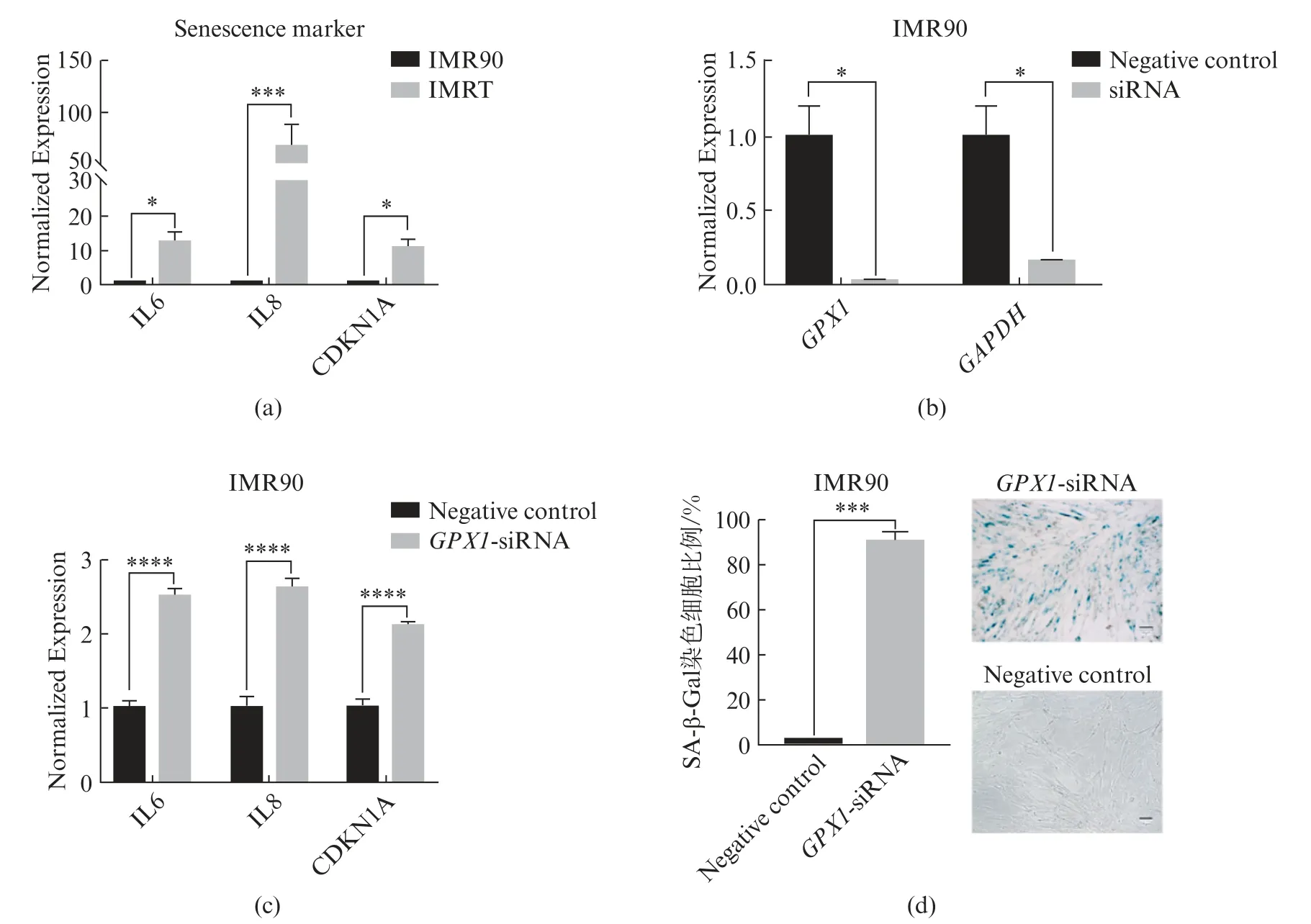
图10 siRNA沉默GPX1促进IMR90细胞衰老Fig.10 siRNA silencing GPX1 promotes IMR90 cell senescence
3 讨论
质谱技术和生物信息学分析的发展为蛋白质组学和代谢组学研究提供了有力的技术支持,并且质谱已成为蛋白质和代谢物鉴定与定量的重要工具[13]。蛋白质稳态是细胞正常功能的基础,疾病通常伴随着多种水平的蛋白质功能障碍[14]。蛋白质组学能够快速确定细胞,组织或生物体中的总蛋白质含量,因此可作为联系基因型和表型的方法[15]。代谢组学反应了复杂分子网络过程的结果,包括基因组,表观遗传学,转录组学和蛋白质组学,这意味着代谢组可能反映了整个系统的衰老和表型[16]。因此,通过衰老相关的代谢组学分析也可以帮助我们可以更好地理解衰老的机制。目前,正常细胞与诱导的衰老细胞的蛋白质水平差异以及代谢活性相似程度尚不清楚,因此在此项研究中,我们通过蛋白质组学和代谢组学的联合分析,探究了细胞衰老在基因型和表型方面的相关性。
本研究利用非标记定量蛋白质组学方法研究IMR90和IMRT细胞之间的蛋白差异。通过对蛋白质组学数据的分析,在IMRT细胞中,葡萄糖磷酸变位酶1(PGM1),6-磷酸葡萄糖脱氢酶(G6PD)等糖酵解途径中的催化酶,特长链特异性酰基辅酶A脱氢酶(ACADVL),短链烯酰辅酶A水合酶(ECHS1)等脂肪酸降解途径中的关键酶,乙酰辅酶A乙酰转移酶1(ACAT1)等参与氨基酸代谢的相关酶,以及谷胱甘肽过氧化物酶1(GPX1),谷胱甘肽S-转移酶(GST)等谷胱甘肽代谢通路中相关酶的含量变化显著。我们的研究还鉴定了差异蛋白富集通路,在IMRT细胞中上调的通路,如三羧酸循环,丙酮酸代谢和脂肪酸降解等,在阿霉素诱导衰老的人乳腺癌细胞MCF7中进行的蛋白质组学研究中同样表现为上调[17]。此外,在IMRT细胞中,上调蛋白也显著富集于帕金森病、亨廷顿病、阿尔茨海默病、非酒精性脂肪肝病等衰老相关疾病的通路中。
基于三重四极杆5500TMLC/MS/MS系统[18],我们对IMR90和IMRT进行靶向代谢物鉴定。代谢组学分析结果显示,差异代谢物主要富集在氨基酸代谢通路,糖类代谢通路,脂质代谢通路以及核苷酸代谢通路中。其中,6-磷酸葡萄糖,肉碱,磷酸胆碱,亮氨酸-异亮氨酸,谷氨酰胺和丙氨酸等在IMRT细胞中有显著变化。6-磷酸葡萄糖是糖酵解过程中的产物,也能够参与己糖胺途径和磷酸戊糖途径[19]。我们的研究发现,IMRT细胞中,糖酵解和磷酸戊糖通路蛋白水平下降,G6PD的表达下降,相关代谢物6-磷酸葡萄糖含量下调,这些结果为进一步认识细胞衰老与葡萄糖代谢之间的关系提供了新的思考。肉碱是将脂肪酸运输到线粒体以进行β氧化所必需的。线粒体脂肪酸氧化途径与衰老过程可能发生的各种分子和代谢机制密切相关。有文献报道,酰基肉碱的积累表明线粒体功能障碍[20],线粒体功能障碍会导致细胞的氧化还原状态失衡,进而引起细胞的氧化应激反应[21-22]。而在我们的研究中,发现在IMRT细胞中的肉碱水平升高,与脂肪酸降解通路中的蛋白质水平上调吻合。
细胞衰老表现出甘油磷酸胆碱与磷酸胆碱的比率增加,暗示了磷脂代谢在细胞衰老中的重要作用[23]。Quijano等[24]通过质谱分析发现在致癌基因诱导的成纤维细胞衰老过程中脂质代谢发生了明显变化。另一项研究通过NMR光谱法确定了WI-38成纤维细胞中甘油磷酸胆碱(GPC)的水平升高是其衰老的代谢指标,并且与引起衰老状态的触发因子无关[25-26]。在我们的研究中,衰老IMRT细胞中的磷酸胆碱水平显著升高,进一步证实了衰老细胞中的磷脂代谢的变化,这与前人的研究相同。因此,磷酸胆碱有望作为细胞衰老的潜在分子指标。
代谢组学的分析结果表明,IMRT细胞中亮氨酸含量增加。Perez等[27]的研究表明,在肝星状细胞中,亮氨酸通过影响线粒体功能进而引起细胞的ROS水平升高。此外,亮氨酸通过抑制过氧化氢酶(CAT)和谷胱甘肽过氧化物酶等抗氧化酶以及蛋白质硫醇基团的氧化而在大脑皮层中引起氧化应激[28]。谷氨酰胺本身可以促进核苷酸的生物合成和尿苷二磷酸N-乙酰氨基葡萄糖(UDP-Glc NAc)的合成,以支持蛋白质折叠和运输[29],或者通过谷氨酰胺酶(GLS或GLS2)转化为谷氨酸[30]。谷氨酸可参与谷胱甘肽的合成,并在细胞中参与其他的代谢过程[31],对于维持细胞的氧化还原状态十分重要。因此,IMRT细胞中谷氨酰胺含量的下降,不利于细胞的ROS的清除,从而进一步维持细胞的衰老状态。研究表明,在果蝇中,丙氨酸的含量也会随着年龄的增长而改变[32]。IMRT中丙氨酸的含量下调,与丙氨酸、天氨酸和谷氨酸的代谢下调相关,但丙氨酸与细胞衰老的关系并不清楚。
与此同时,我们鉴定到谷胱甘肽过氧化物酶1(GPX1)在IMRT细胞中显著下调,相关代谢物谷氨酰胺也显著下调。因此,我们在IMR90细胞中沉默GPX1,结果显示,沉默GPX1的IMR90细胞衰老相关标志物表达升高,并且SA-β-Gal染色为阳性。这表明GPX1蛋白水平对于IMR90细胞的衰老进程至关重要。
综上,本研究的结果表明,IMRT表现出衰老细胞的表型,与IMR90相比,IMRT细胞的蛋白组和代谢组发生了明显变化,组学分析表明,这些差异与细胞衰老高度相关,并且GPX1蛋白对于IMR90细胞的衰老进程至关重要。细胞衰老是正常的生理过程,某些参与调节衰老的代谢物,如谷氨酰胺[33],已得到充分研究和认识。但许多其他的代谢物,例如肉碱,磷酸胆碱和丙氨酸等,如何调控细胞衰老进程,目前仍不清楚。围绕这些代谢物的研究将帮助我们更好地了解介导细胞衰老的信号传导途径。本研究从多组学的角度分析了细胞衰老过程中与衰老相关的蛋白质和代谢物的变化,旨在寻找与细胞衰老发生发展相关的特异性蛋白和代谢物,进而为探究细胞衰老机制,筛选细胞衰老的潜在生物标志物及靶向清除衰老细胞药物提供理论依据。
