1α羟化酶的真核表达和生物信息学特征及其在成年肉鸡组织中的差异表达
2022-11-16尚书凤赵小龙杨书洋郭素芬
尚书凤, 赵小龙, 杨书洋, 郭素芬, 樊 阔, 李 天, 王 琦
(1.陕西理工大学生物科学与工程学院,陕西汉中723000;2.汉中市中心医院,陕西汉中723000)
还原态细胞色素P450(CYP)与一氧化碳结合后,在450 nm处有特殊吸收峰,故命名为P450。类似P450超家族单链蛋白质在生物界中广泛分布[从低等生物(细菌)到高等哺乳动物中均有分布],它们在外源性化合物代谢和外源性疏水化合物(如致癌物、环境污染物、食品添加剂、药物)解毒过程中起重要作用,也在具有生物活性的内源性化合物(如维生素D)的生物转化过程中起着重要作用[1-2]。
维生素D3(VD3)也叫胆钙化醇,参与鸡体内的钙磷代谢和免疫调节,与鸡骨骼肌生长、骨生长及矿化、生殖等有关[3-4]。但是,VD3必须经过连续的两步羟化反应才能生成生物活性最高的代谢产物。首先,肝脏中的多种P450在维生素D3的C-25位点羟化使其生成钙二醇(25-OH D3);然后在1α 羟化酶的催化下,以25-OH D3为底物,在其C-1α位点加羟基,产生活性最高的1α,25-2羟基-维生素D3,即1α,25(OH)2D3。鸡1α羟化酶仅作用于羟化25-OH D3,不作用于维生素D3,因此鸡1α羟化酶是1α,25(OH)2D3生成过程的关键限速酶[5-6]。由于催化的特异性不同于其他种属动物,鸡1α羟化酶具有很大的应用潜力。目前,人、猪、小鼠等多种脊椎动物细胞色素P450 1α羟化酶已经陆续被克隆和鉴定[7-8],然而目前尚未见克隆、表达鸡细胞色素P450 1α羟化酶(CYP27C1)的报道。
对鸡细胞色素P450基因cyp27c1编码区(Coding sequence, CDS)序列进行扩增,构建其真核表达载体,再用真核表达载体瞬时转染293T细胞,使其在293T细胞中高表达。用qPCR分析其组织表达特征,用生物信息学方法分析CYP27C1蛋白的理化性质、亚细胞定位,用同源建模和分子对接法分析CYP27C1的三级结构及其与底物识别、血红素结合相关的关键氨基酸,以期为深入研究CYP27C1的结构、功能、催化机制提供参考。
1 材料与方法
1.1 试验材料
免疫蛋白Marker全式金Easysee Western Marker 25-90 kDa,购自北京全式金生物技术有限公司;大肠杆菌(Escherichiacoli)DH5α感受态细胞、DNA marker Ⅲ,购自北京鼎国昌盛生物技术有限责任公司;KOD FX高保真 DNA聚合酶,购自东洋纺(上海)生物科技有限公司;限制性内切酶NotⅠ、KpnⅠ,购自宝生物工程大连有限公司;Myc小鼠单克隆抗体、辣根过氧化物酶(HRP)标记的山羊抗小鼠免疫球蛋白(IgG),购自上海碧云天生物技术有限公司;双抗(链霉素、青霉素)、DMEM (Dulbecco’s modified Eagle’s medium)高糖培养基,购自赛默飞世尔科技(中国)有限公司;胎牛血清,购自浙江天杭生物科技股份有限公司;Servicebio®RT First Strand cDNA Synthesis Kit、2×SYBR Green qPCR Master Mix,购自武汉赛维尔生物科技有限公司。293T 细胞、pc DNATM3.1/myc-His(-) A,由笔者所在实验室保存;其他常用试剂如氯化钠、三羟甲基氨基甲烷(Tris)、溴化乙锭、丙烯酰胺、N,N′-亚甲基双丙烯酰胺(Bis)、过硫酸铵(AP)、十二烷基硫酸钠(SDS)、四甲基乙二胺(TEMED)等均为分析纯,购自中国医药集团有限公司。
1.2 基因合成及真核表达载体的构建
根据GenBank提供的基因序列(登录号:XM_422077.2)编码区,合成基因cyp27c1的开放阅读框(ORF),由生工生物工程(上海)股份有限公司将ORF插入克隆载体(pMD18-T载体),并将该载体命名为pMD-cyp27c1,经测序验证正确后于-20 ℃保存备用。
以质粒pMD-cyp27c1为模板,设计引物(cyp27c1F1:5′-ATAAGAATGCGGCCGCAA ̄T ̄G ̄T ̄C ̄T ̄T ̄T ̄C ̄C ̄T ̄C ̄A ̄CGCGAGTTCTTGAATCCG-3′;cyp27c1R1:5′-CGGGGTACCTTTTCTGTCAGAAAATCT ̄C ̄A ̄C ̄A ̄T ̄T ̄G ̄ATGGAGCCTCC-3′),在正向F1引物的ATG前引入限制性酶切位点NotⅠ(用下划线标注),由于NotⅠ只有8个碱基,为了避免移码,在编码区ATG前多加了1个碱基A(用斜体字母标注)。在编码区的 3′端引入KpnⅠ位点,并去掉TGA,将cyp27c1的ORF插入pc DNATM3.1/myc-His(-) A的NotⅠ/KpnⅠ,所以cyp27c1的编码区融合了载体的myc-His表达标签,以载体的TGA终止翻译。用 KOD FX 高保真酶扩增cyp27c1的编码区,参见说明书配制反应混合液,分装后上机扩增,退火温度为55 ℃,共设30个循环。将PCR 产物经 1%琼脂糖凝胶电泳分离后,切胶回收目的条带。用NotⅠ、KpnⅠ配制双酶切反应液,加入DNA片段和空载体,于37 ℃反应6 h。将回收纯化的cyp27c1和载体的双酶切产物用T4 DNA连接酶连接反应过夜,反应液参照说明书配制。随后用反应液热激转化E.coliDH5α 感受态,于37 ℃生长过夜。挑选阳性克隆菌落,用引物cyp27c1F1、cyp27c1R1及KOD FX 高保真聚合酶配制PCR反应液,筛选阳性转化子。将质粒进行DNA测序,测序引物用载体通用引物,经过比对后,将测序正确的质粒于-20 ℃保存备用。
1.3 293T细胞培养和转染
293T细胞由笔者所在实验室保存,培养条件:采用DMEM完全培养基(含10%胎牛血清,100 U/ml青霉素和100 g/ml链霉素),培养温度为37 ℃,CO2质量分数为5%。293T细胞转染:转染前将细胞接种于10 cm平皿上,培养过夜,待铺板率达到70%~80%即可进行转染,分别用pcDNA-cyp27c1、空载体pcDNA瞬时转染293T细胞。转染试剂用线性聚乙烯亚胺(PEI),详细步骤参见说明书,转染后培养 48 h(培养温度为37 ℃,CO2质量分数为5%),收集细胞。
1.4 蛋白质免疫印迹
用Tris-HCl(pH值为7.4)悬浮方法1.3收集的细胞,超声破碎(冰浴,工作5 s+暂停5 s,共20次)后,离心(3 000g,4 ℃)、去上清液,沉淀用Tris-Cl(pH值为7.4)重悬。蛋白质浓度的测定用Bradford法。将1 μg 蛋白质样品用于十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)分离,详细步骤参考陈思航等[9]的方法。
1.5 cyp27c1基因的表达分析
各取100 mg 2月龄雌/雄鸡(青脚麻肉鸡,购自汉中市石马坡老马家禽店)的肝、肾、腿肌、胸肌、胸腺、小肠、脾、肾上腺、睾丸、卵巢,加入匀浆管中,再分别加入1 ml RNA提取液。充分研磨后离心(12 000 r/min, 10 min)。弃沉淀,向上清液中加入250 μl三氯甲烷,充分混匀后于室温静置3 min,离心(4 ℃,12 000 r/min,10 min)。将上清液转移到1个新的离心管中,加入0.8倍体积的异丙醇沉淀RNA,用75%乙醇洗涤沉淀,再用 Water Nuclease-Free溶解RNA,最后用Nanodrop 2000检测RNA的浓度、纯度。参照Servicebio®RT First Strand cDNA Synthesis Kit说明书配制逆转录反应体系,设置逆转录程序,合成cDNA。按照2×SYBR Green qPCR Master Mix (None ROX)试剂盒说明书配制qPCR反应液,分装后上机。定量PCR扩增的程序:95 ℃预变性10 min;95 ℃变性15 s,60 ℃退火30 s,40个循环 ;65 ℃→95 ℃,每升温0.5 ℃采集1次荧光信号。qPCR扩增cyp27c1的引物序列:cyp27c1F2,5′-TCGTGGCAGGAATACAGAGA-3′;cyp27c1R2,5′-ACTGCCACATCTTTGGGTTT-3′。qPCR扩增actin的引物序列:actinF,5′-CTGACTGACCGCGTTACTCC-3′;actinR,5′-TTGCACATACCGGAGCCATT-3′。△Ct=cyp27c1的Ct值 -actin的Ct值。求出各样本的平均2-△△Ct后,用样本的平均2-△△Ct/肝样本的2-△△Ct来表示各组织与参照(肝)相比的表达倍数。
1.6 cyp27c1基因的生物信息学分析
cyp27c1基因编码的蛋白质一级结构用BioEdit软件进行分析,用在线网站expasy的protparam程序 (http://web.expasy.org/protparam/)分析蛋白质的相对分子质量和等电点。
用在线软件TargetP-1.1预测蛋白质的亚细胞定位,粘贴CYP27C1的氨基酸序列(fasta格式),选择“Non-plant”,提交序列。用PPM 3.0软件在线预测线粒体膜插入序列(Membrane insertion sequences,MIS),具体步骤:用SWISS-MODEL在线预测插入序列的三级结构→下载pdb文件→在OPM网站选择PPM服务器3.0,添加pdb文件→提交预测。同时用ClustalX2软件进行多重序列的同源性比对,分析鸡CYP27C1与线粒体细胞色素P450的MIS序列差异。
用于比对的基因:猪cyp27b1(登录号:NM_213995.1),小鼠cyp27b1(登录号:NM_010009),人cyp27b1(登录号:NM_000785.3)、cyp27a1(登录号:NM_000784.4)、cyp11b2(登录号:NM_000498)、cyp11a1(登录号:NM_000781.3),大鼠cyp24a1(登录号:NM_201635.3)。
用ClustalX进行多序列比对,分析活性位点的关键氨基酸,要点如下:将需要比对的氨基酸序列放在1个文本文档内,打开程序,点击File→Load Sequnce→选择序列文件(包含多个FASTA格式的序列)→Aignment→Do Complete Alignment →输出.aln格式文件。为了得到效果更好的图片,用DnaMan作图,步骤如下:打开DnaMan并依次点击File→Open special→Multiple Alignment→后缀为“.aln”的文件→Options→Preferences→设置参数。输出图像的步骤:依次点击File→Output→Graphic(EMF)File→保存图像。
搜索SWISS-MODEL序列库发现,大鼠CYP24A1(3k9v.2.A)与鸡CYP27C1的相似度最高,氨基酸序列的相似度达33%,以大鼠CYP24A1为模板进行同源建模,在SWISS-MODEL网站(http://swissmodel.expasy.org/)上预测CYP27C1的三级结构,用Ramachandran Plot评估三级结构的稳定性。
分子对接(docking)方法:用Autodock-tools 4.2对接,受体为上述已建模的CYP27C1(pdb),配体为血红素(pubchemCID:455658)、25-羟基维生素D3(pubchemCID:88810851)。下载dtf文件,通过open babel GUl进行格式转换,得到pdb文件。将CYP27C1与血红素对接,保存pdb文件,然后用此pdb格式的受体与配体25-羟基维生素D3进行对接,对接50次,选取具有最低结合能的构象用作后续分析。分子对接结果用pyMOL软件进行可视化分析。
2 结果与分析
2.1 cyp27c1真核表达载体的构建
以pMD18-cyp27c1载体为模板,在扩增的PCR产物中检测到大小约为1 600 bp的单一条带,详见图1。将切胶回收的DNA片段和空载体分别用NotⅠ、KpnⅠ双酶切,然后将双酶切产物经电泳分离后通过凝胶成像进行检测鉴定。图2结果显示,酶切后的DNA片段条带单一,未出现非特异切割。用连接产物热激转化大肠杆菌E.coliDH5α感受态,通过菌液PCR筛选阳性克隆,共挑选出9个克隆,筛选出4个阳性克隆,详见图3。随意挑选2个阳性克隆质粒进行测序,对测序结果进行比对分析,发现无移码突变,且在3′末端融合了载体的 myc-his 标签,详见图4。
M:DNA marker DL 2000;1~3:cyp27c1的PCR产物。
M:DNA marker Ⅲ;1:cyp27c1的酶切产物;2:pcDNA3.1的酶切产物。
M: DNA marker Ⅲ; 1~9: cyp27c1的PCR产物。

*表示序列一致的氨基酸。
2.2 Western blot检测重组蛋白质在293T细胞中的表达
将重组表达的蛋白质样品通过12% SDS-PAGE分离后,以myc抗体作一抗进行Western blot。结果表明:在重组表达的293T细胞线粒体中检测到相对分子质量约为58 000的特异条带,与 CYP27C1 的大小相符。CYP27C1的理论相对分子质量约为61 200,C末端融合载体表达标签为mys-His(相对分子质量为3 452),总相对分子质量为64 652。但是CYP27C1是线粒体蛋白质,在293T细胞中表达后进行翻译后修饰,切割信号肽,成熟CYP27C1的相对分子质量约为58 000,而对照样品中未检测到相应条带(图5)。
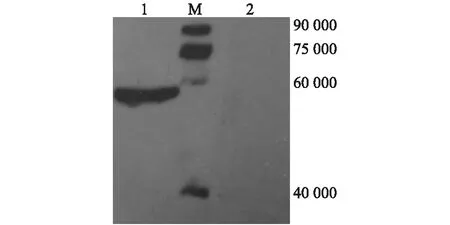
M:蛋白质 marker;1:来自pcDNA-cyp27c1转染 293T细胞的线粒体;2:来自pcDNA转染 293T细胞的线粒体。
2.3 cyp27c1基因的组织表达分析
qPCR试验结果表明,cyp27c1基因对应的mRNA 在鸡的肝、肾、小肠、腿肌、胸肌、胸腺、脾、肾上腺、睾丸或卵巢中均有表达,且存在组织表达差异(图6)。以肝为参照,cyp27c1基因在成年期母鸡腿肌中的相对表达倍数最高,达到2.92倍,在肾、肾上腺中的相对表达倍数分别达到1.66倍、1.97倍,在胸肌、胸腺中的相对表达倍数分别为1.24倍、0.67倍,在卵巢中也有表达(图6A)。
由图6B可以看出,cyp27c1基因在公鸡各组织中的相对表达量趋势类似于母鸡,不同的是,与肝相比,cyp27c1基因在公鸡胸肌、腿肌中的相对表达倍数较高,分别达到6.6倍、5.9倍,推测可能与公鸡肌肉组织较发达相关。此外,与肝相比,cyp27c1基因在鸡生殖器官睾丸中的相对表达倍数也较高,达到3.08倍,而在母鸡卵巢中的相对表达倍数为1.03倍,推测可能与2月龄母鸡发育状态相关。最早报道的1月龄鸡中的羟化酶在肾中表达,后来Shanmugasundaram等[6]报道,1α羟化酶也在肾外组织中表达,这与本试验结果一致。本试验填补了1α羟化酶在生殖器官中表达的信息。
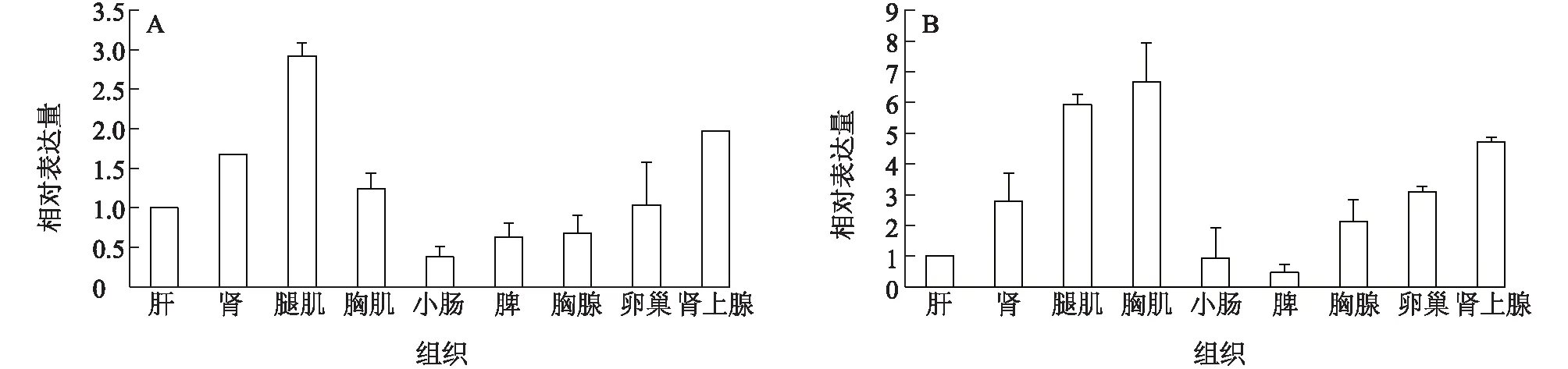
A:母鸡;B:公鸡。
2.4 CYP27C1的生物信息学分析
2.4.1 CYP27C1氨基酸序列及其理化特性分析 用expasy的protparam程序分析基因cyp27c1的编码区,发现其核苷酸序列包括1 611个碱基,终止子为TGA,编码536个氨基酸。CYP27C1蛋白的N端氨基酸是甲硫氨酸,相对分子质量为61 275.57,等电点为8.81;CYP27C1蛋白包括67个强碱性氨基酸(精氨酸和赖氨酸)、61个强酸性氨基酸(天冬氨酸和谷氨酸)、263个疏水性氨基酸(甘氨酸、丙氨酸、缬氨酸、亮氨酸、异亮氨酸、苯丙氨酸、色氨酸、甲硫氨酸、脯氨酸)、133 个极性氨基酸(天冬酰胺、半胱氨酸、谷氨酰胺、丝氨酸、苏氨酸、酪氨酸),分子式为C2 761H4 335N755O787S18。CYP27C1在哺乳动物细胞、酵母细胞、大肠杆菌细胞内的半衰期分别约为30 h、20 h、10 h。
2.4.2 CYP27C1的亚细胞定位预测及MIS序列分析 根据CYP27C1的N末端氨基酸序列,用TargetP-1.1服务器在线预测CYP27C1的亚细胞定位,结果显示,CYP27C1存在线粒体靶向序列(mitochondrial targeting peptide,mTP)的可能性为69.5%,推测CYP27C1可能是线粒体细胞色素P450。多重序列比对和OPM 3.0在线分析结果显示,在CYP27C1氨基末端有线粒体引导序列和1个线粒体内膜插入区(MIS)。MIS1序列是αA′螺旋的LYNL(74~77位点)和FW(81~82位点),嵌入内膜的深度是4.4 Å(图7A)。然而,人、小鼠、猪的1α羟化酶有2个MIS(图7B、图7C)。MIS序列不仅将P450插入线粒体内膜,还提供底物进入活性中心的通道(位于A′-A螺旋和F-G loop之间)。因此,推测鸡1α羟化酶不同于人、小鼠、猪1α羟化酶底物特异性的原因之一是鸡CYP27C1的MIS2区有2个带电荷的氨基酸R273、K278,R、K的疏水参数分别是-4.5、-3.9,是亲水性较强的2个氨基酸,不利于αG′-G螺旋疏水性氨基酸序列插入膜的疏水核心。然而,人、小鼠、猪的1α羟化酶的MIS2区位于αG′和G螺旋之间,由疏水性氨基酸形成,有利于插入到膜的疏水核心(图7C)。

A:鸡CYP27C1与脂质分子层之间的相互作用(MIS1位于αA′螺旋内);B:多序列比对预测的MIS-1;C:多序列比对预测的MIS-2,其中细线标注的氨基酸为与膜结合的关键氨基酸。
2.4.3 同源序列比对 大鼠细胞色素P450 24A1是与维生素D3代谢相关的P450,并且是已经获得晶体结构的线粒体P450。人、小鼠和猪CYP27B1是已经克隆并且功能得到鉴定的1α羟化酶,其中人CYP27A1是代谢维生素D3的关键P450之一,人CYP11A1、CYP11B2是研究得比较早的线粒体细胞色素P450。因此,本研究用上述7个P450蛋白氨基酸序列与鸡CYP27C1进行同源比对,分析CYP27C1的结构域及功能。
线粒体引导序列在CYP27C1转运过程中被切割,成熟的P450 27C1从V62开始,紧接着是1个非常保守的脯氨酸(P),是PGP motif的第1个富含脯氨酸的保守结构域,在比对的这7个P450中均保守。PGP motif是人CYP27A1和CYP11A1及大鼠CYP2C11正确折叠和血红素辅基结合所必需的[10-11]。
细胞色素P450含有血红素辅基,血红素结合所必需的氨基酸是保守的。因此,本研究通过同源比对,参考人线粒体CYP27B1、CYP27A1和大鼠CYP24A1的结构和功能,分析CYP27C1底物识别、结合以及血红素结合相关的关键氨基酸[12-14],推测R135、L126、W162、R166、R480、C482、H437是与血红素结合相关的关键氨基酸,非常保守,在所比对的P450中均保守(图8中的8个序列均相同)。K83、Q93、H90、Q111、V113、S115、A136是与底物识别相关的关键氨基酸,其中H90非常保守,在所比对的P450中均保守(图8中的8个序列均相同),Q93在CYP27家族中保守(图8中的5个序列均相同),A136、V113和S115不同于其他3个1α羟化酶,V113、S115位于β-1b折叠片,处于底物结合腔,与底物识别、底物进入通道相关。A136位于B′-B片段,与底物进入通道相关。已知鸡1α羟化酶(CYP27C1)只能在25-OH D3的C-1α发生羟化,不能作用于VitD3的C-1α使其转化为1α(OH)D3。然而,人、小鼠、猪的1α羟化酶(CYP27B1)既可以催化25-OH D3的C-1α发生羟化,也可以催化D3的C-1α发生羟化,推测可能与鸡1α发生羟化酶底物识别位区的3个氨基酸(V113、S115、A136)有关。
通过多序列比对及预测发现,L343、A344、M258、L521与 25-OH D3的侧链结合相关,人CYP27B1的L316、大鼠CYP24A1的L325与25-OH作用相关[12-13]。I螺旋上与甾醇侧链作用的L-氨基酸在线粒体P450中相当保守(6个序列中有5个相同),其中A136、M138、W141、N412、T261、L409与25-OH D3的A-C-D环结合相关(图8)[12]。K螺旋的E401、R404与meander区的R457通过氢键作用形成三联体,在比对的P450中均保守(8个序列均相同)。

100%相似度用黑色标注,相似度达75%用灰色标注。*:血红素结合;#:ERR三联体氨基酸;&:底物识别相关的氨基酸; $:与25-OH D3的A-C-D环结合相关的氨基酸;0:与25-OH D3侧链相关的氨基酸。
综上,由多序列比对结果可以看出,CYP27C1二级结构以α螺旋、β折叠、无规则卷曲为主,与其他线粒体P450的二级结构相似。参与血红素结合的关键氨基酸依然保守,在所有比对的P450中均保守。ERR三联体与P450氧化还原反应过程中电子传递体(肾上腺)皮质铁氧还蛋白的相互作用有关,ERR三联体在CYP27C1中也是保守的。
2.4.4 同源建模和分子对接 应用基于同源建模的 SWISS-MODEL 程序预测CYP27C1的三级结构,搜索SWISS-MODEL序列库发现,大鼠CYP24A1(3k9v.2.A)与鸡CYP27C1氨基酸序列的相似度最高,氨基酸序列相似度达33%,因此以CYP24A1 为模板进行同源建模。N末端从V62氨基酸开始,C末端终止于R535。CYP27C1与其他线粒体P450有如下共同的三级结构特征:开放式结构,大部分α螺旋位于分子的一侧,多数反向平行的β折叠则位于另一侧。从N末端到C末端,包含的α螺旋依次为A、B、B′、C、D、E、F、G′、G、H、I、J、K、K′、L等 15 个螺旋,4个3/10螺旋(A′、J′、K′′、K′′′),包含的10个β折叠片依次为β-1a、β-1b、β-2a、β-3a、β-3b、β-2b、β-4a、β-5a、β-5b、β-4b,与大鼠的CYP24A1和人的CYP27B1三级结构[11-12]相似。参与形成α螺旋的氨基酸共233个,占总氨基酸数的49.15%,参与形成β-折叠片的氨基酸共28个,占总氨基酸数的5.90%。E、I、J、K 和 L螺旋形成分子的核心, F-G loop包含1个G′-loop,缺少1个F′-loop(图9A)。CYP27C1不同于微粒体细胞色素P450 2R1,与大鼠线粒体细胞色素P450 24A1[12-15]相似。
利用 PROCHECK 程序对CYP27C1的三级结构中氨基酸残基的二面角是否在合理区进行评价,用ψ、φ表示每个氨基酸的二面角, 分别以φ、ψ作为横坐标、纵坐标绘制的二维图形称为拉氏图(图9D)。利用拉氏图对ψ、φ作可视化分析,是评估蛋白质结构模型稳定性最通用的方法[16]。在最佳合理区和额外合理区,构象可以稳定存在;在一般合理区,构象可以存在,但是不稳定;在不合理区,构象则不能存在。一般来说,当最佳合理区和额外合理区内的氨基酸残基数量占比高于90%时,即可认为该模型可以稳定存在,符合立体化学规则[17]。由CYP27C1三级结构的拉氏图可以看出,最佳合理区和额外合理区的氨基酸数量占比达到94.71%(图9D)。
利用已建模的CYP27C1的三级结构(pdb格式)与血红素进行分子对接,然后再将含有血红素的CYP27C1三级结构与底物(25-OH D3)进行分子对接,结果显示:血红素和底物深埋于分子内,血红素、I-helix和底物(25-OH D3)呈三明治状(图9A)。I螺旋贯穿整个分子,血红素附近螺旋内氢键的局部畸变,导致产生1个扭转,是质子转移到氧分子上必需的,在哺乳动物、细菌的P450中均存在I螺旋扭转。I螺旋中还有1个高度保守的Thr348,在所有比对的序列中均保守,推测可能与活性位点的质子转移有关[15]。
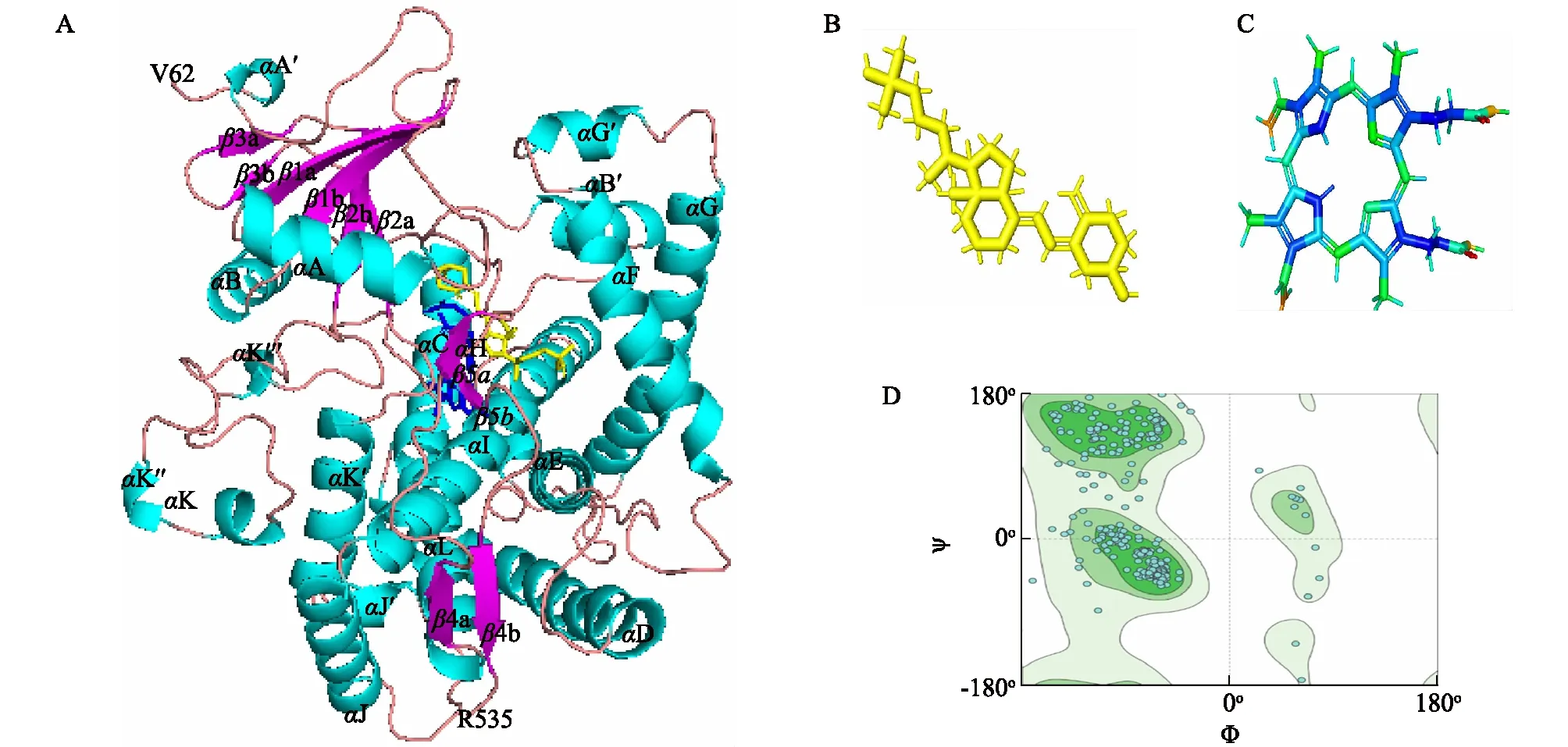
A:CYP27C1的三级结构;B:25-OH D3的3D结构;C:血红素的3D结构;D:CYP27C1三级结构的拉氏图(绿色区域为最合理区,浅绿色区域为额外合理区,灰色区域为一般合理区,白色为不合理区)。
CYP27C1与25-OH D3形成具有较强氢键的氨基酸,包括L343和D347,L343的侧链与25-OH D3的碳-25羟基相互作用(图10A)。通过分子对接发现,与血红素形成较强氢键的氨基酸包括B-B′ loop(R135)、B-C环(L154)、K-L loop(C482)、β3(N412)(图10B),这与大鼠CYP24A1和人CYP27B1的分子对接结果一致[12-13]。上述结果与前面多序列比对的结果(L343与25-OH D3的侧链作用)一致,说明本研究所得建模及分子对接结果可靠。
K-helix与周围二级结构相互作用形成1个ERR三联体,将ERR三联体锚定在血红素区,能够起到稳定血红素结合的作用[16]。K-helix的三联体核心氨基酸E401、R404通过氢键结合到R457(图10C)。R457中前面的22个氨基酸形成1个meander结构区,将ERR三联体包裹在高度协调的氢键网络中,在P450结合(肾上腺)皮质铁氧还蛋白的过程中起到重要作用[18]。上述结果与多序列比对结果一致,说明本研究所建模型的可信度较高。
同源比对的结果显示,A-A′和β1与底物识别和进入通道相关,在这一区域与25-OH D3对接,预测A136、K83、S106和 H107与底物形成强的氢键(图10D)。上述多序列比对结果也表明,A136、K83与底物识别相关。因此,推测A136、K83是与底物识别相关的关键氨基酸。
底物结合腔包括β1、β5、B-C loop环和E、F、G、I、K螺旋,其中B-C loop紧密靠近G、G′螺旋。B螺旋(W141、Y144)、F螺旋(T261)、G螺旋(F283、W287、F291)形成芳香簇(图10E)。R145、E340形成盐桥,芳香簇最主要的作用是为活性中心提供疏水环境,这些结构相当保守,是起到稳定CYP27C1作用的开放式结构。
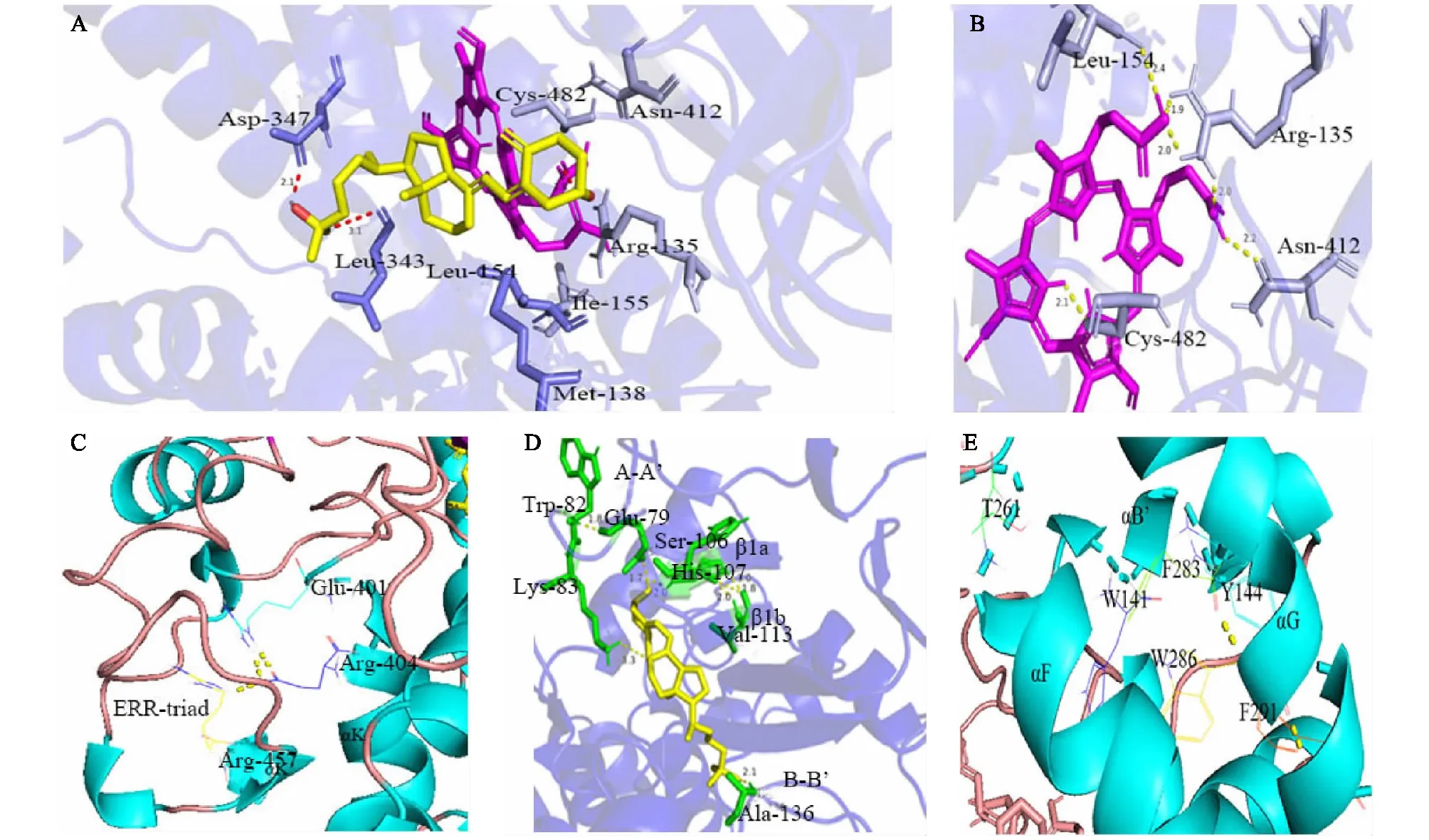
A:结合血红素的CYP27C1与25-OH D3分子对接示意。其中活性中心L343、D347与25-OH D3形成较强的氢键(红色)。B:结合血红素的关键氨基酸(包括L154、C482、N412、R135)示意。C:ERR三联体的氢键。D:底物识别区关键氨基酸(A136、K83、S106、H107)与25-OH D3形成较强氢键(黄色)示意。E:底物结合腔芳香簇氨基酸(T261、W141、F283、Y144、W286、F291)。
3 讨论
依据传统分类法,可将细胞色素P450分为两大类,I类P450包括细菌P450和线粒体P450,Ⅱ类是真核膜结合P450。其中I类包括大多数细菌P450和线粒体P450,这类P450催化体系由依赖于黄素嘌呤二核苷酸(FAD)的铁氧还蛋白还原酶(FDXR)、铁氧还蛋白(FDX)和P450构成。I类P450又可分为Ia、Ib,其中Ia是原核细胞质P450,Ib是结合到线粒体内膜的P450,在代谢类固醇激素和维生素D的过程中起重要作用[19-20]。哺乳动物线粒体基因组仅能编码2%的自身蛋白质,其余蛋白质由细胞核基因编码,前体蛋白质由细胞质游离核糖体合成,随后被转运进入线粒体中,经翻译后加工、释放。线粒体P450进入线粒体通过线粒体信号肽通路,这类信号肽序列富含具有正电荷、两亲的α螺旋结构,能被线粒体外膜转位酶复合物(TOM)受体识别,随后信号肽被转运给线粒体内膜转位酶(TIM),被释放到基质或者内膜中,然后信号肽被线粒体蛋白酶切割[21]。
利用在线软件TargetP-1.1预测CYP27C1的亚细胞定位发现,CYP27C1可能定位于线粒体。OPM 3.0在线预测结果显示,CYP27C1的氨基端有1个插入线粒体内膜序列(MIS),推测CYP27C1在线粒体中表达。将真核表达载体pcDNA-cyp27c1瞬时转染293T细胞并表达48 h,随后提取线粒体组分,以CYP27C1融合表达标签myc抗体作为一抗,在线粒体中检测到单一条带,与预测结果一致。异源表达P450有多种方法,包括真核表达和原核表达。293T细胞是常用的哺乳动物真核表达细胞系,是通过基因工程方法改造的HEK293细胞系,含有SV40大T抗原的复制起始点及启动子区,能稳定转染-表达SV40大T抗原[22]。pcDNA 3.1中含有SV40病毒的起始复制位点,可以在293T细胞系中复制,大大提高了外源基因的表达量。CYP27C1蛋白的理化性质分析结果显示,CYP27C1蛋白在哺乳动物细胞中的半衰期最长,相对于酵母、大肠杆菌,CYP27C1在哺乳动物细胞中较为稳定。因此,构建cyp27c1的真核哺乳动物细胞表达载体pcDNA-cyp27c1,在293T细胞中表达具有较大意义。Western-blotting结果表明,cyp27c1在293T细胞中高表达。
在鸡胚胎期,1α羟化酶在肾mRNA中的相对表达量最高,其次是在腿肌和胸肌中的相对表达量,在扁桃体、胸腺中的相对表达量居中,在肝中的相对表达量最少[6]。本试验结果表明,成年鸡1α羟化酶的组织表达分布与胚胎期不同,成年鸡的1α羟化酶在肌肉组织(腿肌、胸肌)中的相对表达量最高,其次是在肾、肾上腺及生殖器官(睾丸、卵巢)中的相对表达量,在脾和胸腺等免疫器官中也有表达,这与有关报道提到的维生素D3与骨骼肌生长发育、生殖和免疫有关的结论一致[3-4]。由此可见,本试验结果填补了1α羟化酶在生殖器官中表达的信息。
目前,人们对禽CYP基因的识别和表达特征的认识还很有限,主要研究对象是CYP1-3亚家族。CYP1-3亚家族的成员是异源化合物的代谢酶基因,主要在肝脏中表达[23]。目前,关于鸡线粒体细胞色素P450基因克隆表达的研究还未见报道。Gray等[24-26]研究粗提的线粒体羟化25-OH D3发现,鸡1α羟化酶只能在25-OH D3的C-1α位加氧生成1α,25(OH)2D3,不能使维生素D3羟化生成 1α-OH D3,作用底物具有特异性。然而,人、猪、小鼠的1α羟化酶既可以作用于25-OH D3,也可以作用于维生素D3。鸡1α羟化酶具有重要的应用价值,但是目前尚未见克隆和表达鸡1α羟化酶基因的报道。因此,克隆和表达1α羟化酶基因具有重要意义。笔者利用生物信息学方法预测了线粒体膜插入序列,还通过多序列比对、同源建模、分子对接预测了CYP27C1与血红素结合、底物识别和结合的关键氨基酸。
4 结论
本研究通过合成基因cyp27c1编码区,构建真核表达载体pcDNA-cyp27c1,在293T细胞中重组表达CYP27C1-myc-His,通过Western-blot在线粒体中检测到了特异的相对分子质量约为58 000 的目的条带。CYP27C1与其他线粒体细胞色素P450具有相似的开放式三级结构,以α螺旋、β折叠为主。C482、R135与血红素形成较强的氢键;A136、K83则是与25-OH D3识别相关的关键氨基酸;活性中心L343、D347是与25-OH D3结合相关的关键氨基酸。上述研究结果为后续应用定点突变深入研究CYP27C1底物特异性机制与催化机制提供了基础。
