Castor分支型主动脉覆膜支架治疗Stanford B型主动脉夹层的单中心中期疗效评估
2022-11-16魏小龙袁良喜赵志青包俊敏冯家煊刘广钦陆清声
张 昊 张 雷 魏小龙 袁良喜 宋 超 赵志青 包俊敏 冯家煊 刘广钦 陆清声
随着血管外科技术和理念的进步,胸主动脉腔内修复术(thoracic endovascular aortic repair,TEVAR)已成为Stanford B型主动脉夹层的首要治疗手段[1-3]。但是,累及左锁骨下动脉(left subclavian artery,LSA)的夹层病变,由于解剖结构复杂,手术难度相应增高,手术相关并发症明显增多[4]。常规腔内手术中需采用去分支、平行支架、分支支架或主体支架开窗技术保留LSA,以降低术后截瘫的发生率[5],但可发生内漏、锚定区血管损伤等[6-8]。Castor分支型主动脉覆膜支架(简称Castor支架)是全球首款专门用于累及LSA的主动脉夹层腔内治疗的单分支手术器具,由海军军医大学第一附属医院血管外科参与研究设计,其独特的结构能够在前移支架锚定区的同时增加支撑力,避免由平行支架造成的内漏发生[9]。Castor支架已在全球多家医疗中心使用,获得了满意的临床效果。
1 对象与方法
1.1 研究对象 本研究为单中心回顾性分析。选择2018年12月—2020年6月间在海军军医大学第一附属医院(上海长海医院)使用Castor支架行TEVAR的Stanford B型主动脉夹层患者70例,其中男64例、女6例;年龄范围22~85岁,年龄为(60.02±13.03)岁;病变处于急性期27例、亚急性期18例、慢性期25例。纳入标准:B型主动脉夹层近端裂口累及LSA;LSA开口与左侧椎动脉开口间距离>25 mm;裂口未累及左颈总动脉(left carotid artery,LCA)。排除标准:髂动脉或股总动脉狭窄,血管直径<7 mm;左肱动脉狭窄或闭塞;LSA重度狭窄或钙化、血栓形成;马方综合征等严重结缔组织疾病;对碘对比剂或镍钛合金过敏。本研究符合2013年修订的《赫尔辛基宣言》。
1.2 方法 所有患者入院后均于术前完成全主动脉CTA检查,将所有患者Dicom格式的全主动脉CTA影像资料导入ENDO-size软件进行测量。测量主动脉直径,观察并评估病变性质、范围、裂口位置,选择合适尺寸的支架。所有患者均于全身麻醉下行TEVAR,建立左侧肱动脉和一侧股总动脉的血管通路后,先行升主动脉造影,明确病变的部位、性质、范围;再建立左肱动脉与操作侧股总动脉之间的导管通路,导入分支支架导丝。将主体支架沿超硬导丝导入主动脉目标位置,同时将分支支架导丝经连接导管引入LSA,从左肱动脉引出备用。当输送系统到达降主动脉起始部时,前送支架主体结构使其进入主动脉弓部,确定主体支架与分支支架导丝之间无缠绕后,继续操作使近端裸支架前端到达预定锚定区,随后依次释放主体支架和分支支架(图1);根据再次造影情况决定是否增加主动脉远端支架或LSA内分支支架[9]。术后给予患者低分子肝素抗凝治疗,给予糖皮质激素以预防术后发生全身炎症反应综合征;出院前根据术前CYP2C19基因检测结果选择抗血小板药物进行桥接治疗,预防分支支架内血栓形成及支架内狭窄。
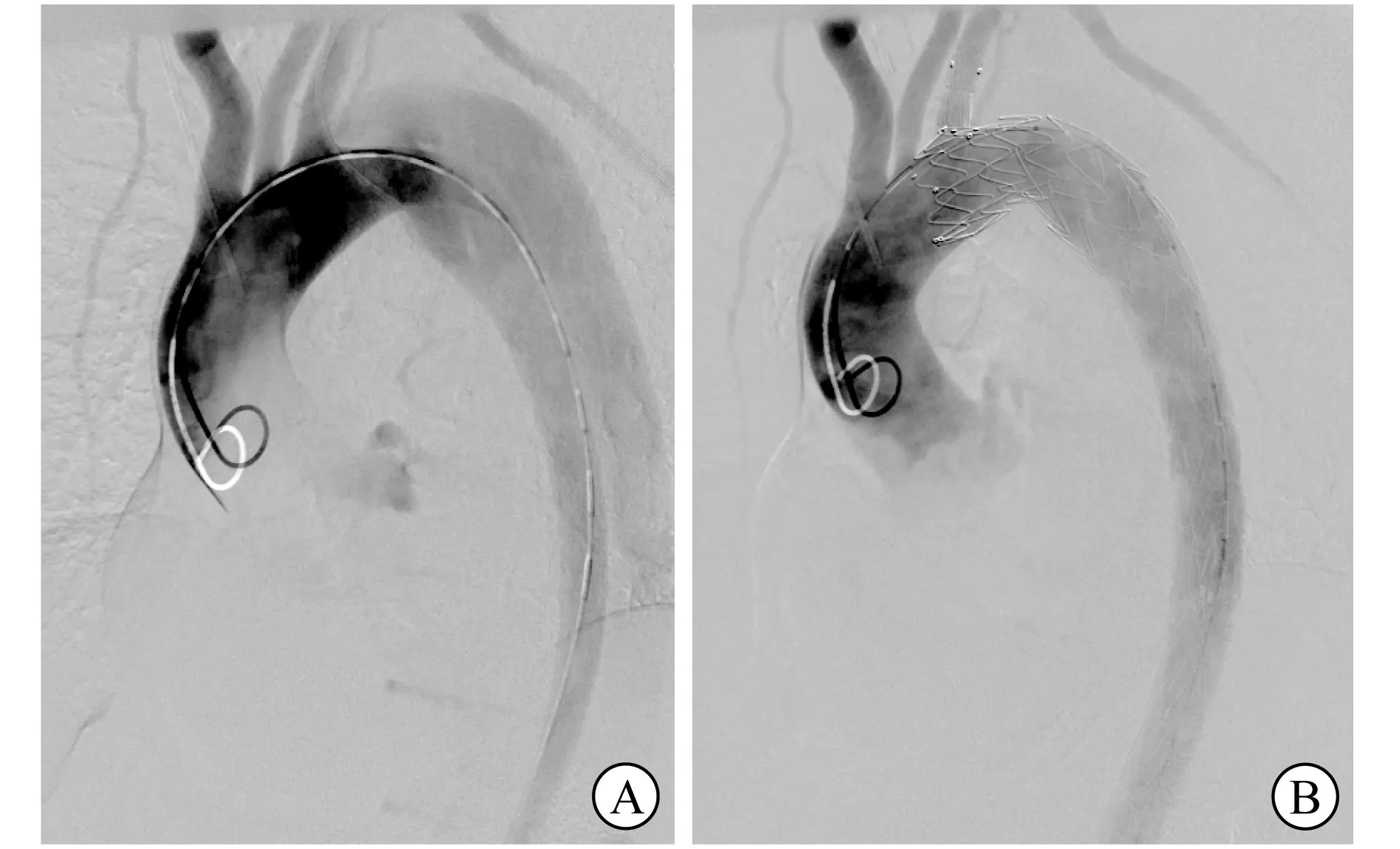
A 主动脉夹层累及LSA B Castor支架隔绝主动脉夹层同时保留LSA图1 Castor支架治疗累及LSA的Stanford B型主动脉夹层的术中造影显示
1.3 术后随访 患者于术后6个月及术后每年住院或门诊随访,行全主动脉CTA检查,并记录其临床症状、体格检查和术后恢复情况等。
1.4 观察指标 主要观察指标为患者全因死亡及夹层逆撕、脑梗死等主动脉夹层相关不良事件。次要观察指标:术前测量主动脉夹层近端锚定区主动脉直径、LSA开口与主动脉夹层近端裂口距离、LSA开口与主动脉夹层近端边缘距离、LSA起始部直径、LCA开口远端与LSA开口近端距离,手术完成情况、手术时间、术中对比剂使用量,住院时间、随访时间和病例数,内漏、支架闭塞等手术及支架相关并发症情况,Castor支架主体近端及远端直径、分支支架直径,主动脉主体支架近端和远端放大率。
2 结 果
2.1 主要观察指标 围手术期3例患者发生主动脉夹层相关不良事件,其中夹层逆撕1例,脑梗死2例。随访期间5例患者死亡,其中1例于术后4 d死于夹层逆撕破裂,1例于术后1个月死于呼吸衰竭,1例于术后6个月死于心力衰竭,2例分别于术后9、14个月死于脑出血。
2.2 次要观察指标 主动脉夹层近端锚定区主动脉直径为(31.63±3.16) mm(直径范围26.0~40.0 mm),LSA开口与主动脉夹层近端裂口距离为(45.79±19.60) mm(距离范围0~12.0 mm),LSA开口与主动脉夹层近端边缘距离为(8.14±14.37) mm(距离范围-2.0~8.0 mm),LSA起始部直径为(11.35±1.45) mm(直径范围8.0~15.2 mm),LCA开口远端与LSA开口近端距离为(8.44±2.44) mm(距离范围5.0~14.0 mm)。
所有患者均顺利完成手术。手术时间为(109.63±44.65) min(时间范围55~260 min),术中对比剂使用量为(200.79±35.11) mL(使用量范围100~310 mL),住院时间为(8.57±3.22) d(时间范围1~21 d),随访时间为(11.64±6.77)个月(时间范围6~38个月),6例患者失访(外地患者,电话随访无人接听)。
随访期间1例于术后3个月因发生Ⅰb型内漏而行2次腔内手术隔绝内漏,1例于术后9个月发生分支支架闭塞。所有患者围手术期及随访期间均未发生截瘫、近端锚定区新发裂口、主体支架移位、闭塞或狭窄等手术及支架相关并发症。
Castor支架主体近端直径为(32.43±3.45) mm(直径范围28~40 mm)、远端直径为(26.46±3.40) mm(直径范围22~34 mm),分支支架直径为(10.92±4.08) mm(直径范围10~12 mm)。主动脉主体支架近端放大率为2.48%(0,3.45%),主动脉主体支架远端放大率为0(-7.14%,4.35%)。
3 讨 论
当Stanford B型主动脉夹层病变累及LSA时,腔内治疗难度极大。由于支架的锚定需要足够的健康血管区,常规的腔内治疗中将支架近端释放在紧靠LSA开口的位置,增加了术中及术后内漏、血管损伤及夹层向近端逆撕的发生风险[4]。在腔内治疗开展的初期,支架往往被迫覆盖LSA,以获得足够的锚定区;但研究[10]证实覆盖LSA导致脊髓急性缺血与截瘫的发生密切相关,且可能引发锁骨下动脉窃血综合征而影响患者的颅内供血[11]。以往的解决方法往往伴随相关风险:去分支技术的创伤较大,术后并发症较多;烟囱支架植入需要使用额外的支架,增加了患者的治疗费用;支架开窗技术无论体外开窗或原位开窗,对术者的技术要求均较高[12-16]。
根据发病时间,主动脉夹层可分为超急性期(<1 d)、急性期(1~14 d)、亚急性期(15~90 d)和慢性期(>90 d)[17]。大部分主动脉夹层患者的病情较重,需急诊行腔内治疗,且患者往往合并血栓或多发斑块等复杂血管条件,术后夹层逆撕的发生风险很高,增大了手术难度。Castor支架的独特设计能够在降低夹层逆撕发生风险的同时保留LSA,且不影响夹层近端裂口的隔绝效果,降低了手术操作难度和手术费用,并能减少内漏的发生和对主动脉壁的损伤。整个支架的输送系统外径被压缩为22 F,外部覆有亲水涂层,能够减少手术操作过程中与血管内壁产生的摩擦力,减少血管损伤的可能;其内部的主体支架和分支支架被分别独立压缩使得分支支架能够单独释放,避免在操作时发生支架缠绕而无法释放。
此外,Castor支架通过分支支架不仅保留了LSA开放,同时增加了主体支架的支撑力,降低了支架移位的发生风险,能够在较小放大率的情况下,满足主动脉夹层的治疗需求,从而减少对近端主动脉的损伤和夹层逆撕的发生。
为了避免Castor支架输送系统在主动脉弓部进行调试而造成血管损伤或斑块脱落导致脑梗死发生,其支架部分可回收至降主动脉的外鞘管内,在较为“安全”的主动脉区域内旋转“解缠绕”,调整至正确的角度后再前移至主动脉弓进行释放。此外,支架外部被软鞘包裹,能够有效地减少其在主动脉弓内的操作对血管内壁造成的损伤和血栓脱落导致脑梗死的发生风险。
由于累及LSA的Stanford B型主动脉夹层本身解剖结构及合并疾病的复杂性,手术难度较高,目前采用的手术方法和术中使用的器具均存在不足[18-19]。Castor支架在由导入动脉进入主动脉目标区域的过程中,由于患者动脉扭曲、输送系统与血管内壁的摩擦及空间翻转,均可能造成主体支架与分支支架导丝缠绕,需在释放前进行旋转调试,增加了操作步骤及脑梗死、血管损伤、手术失败的发生风险。而且,在牵拉分支支架导丝将支架导入动脉的时候,可能会使主动脉弓部大弯侧的血栓栓子或钙化斑块松动、脱落,随支架及血流进入头向供血的弓上分支血管,导致围手术期急性脑梗死发生[20]。
综上所述,Castor支架的结构符合累及LSA的Stanford B型主动脉夹层的手术要求及其解剖特点,操作成功率较高,能够安全、有效地用于累及LSA的Stanford B型主动脉夹层的腔内治疗。由于主动脉夹层本身解剖特点、支架材料及研发时间的局限性,Castor分支型主动脉覆膜支架尚需不断改进,以实现产品的迭代升级。
