miR-410-3p通过介导HMGB1的表达调控NF-κB信号通路调控缺氧缺血性脑损伤
2022-11-16张显英山东省滕州市中心人民医院新生儿科滕州277599
张显英 仇 华 陈 青 (山东省滕州市中心人民医院新生儿科,滕州 277599)
新生儿缺氧缺血性脑损伤(hypoxic-ischemic brain injury,HIBD)是新生儿在围产期窒息而出现的脑部缺氧缺血性损伤[1]。HIBD是导致新生儿急性死亡率升高的主要原因,发达国家每年每1 000名新生儿中约有5名受此影响[2]。此外,新生儿期HIBD相关死亡率高达40%,另有30%的患者可能患有神经后遗症,如智力迟钝和脑瘫,这可能对儿童、其家庭和整个社会构成沉重负担。新生儿HIBD的发病机制复杂,涉及多种不同因素,由自由基生产、离子不平衡、兴奋毒性和炎症反应引起的神经元凋亡和自噬在HIBD的发展中发挥重要作用,其发生机制尚不明确[3-6]。
由于神经炎症反应引起的继发性脑损伤在HIBD中起着重要作用,抑制炎症反应可能保护缺氧缺血脑组织[7-9]。TLR4/核因子kappa-B(NF-κB)信号通路在激活中性淋巴瘤和脑缺血缺氧、一氧化碳脑缺血、脑外伤等引起的脑损伤机制中起着重要作用[10-13]。TLR4可与HMGB1结合,向上调节骨髓分化因子88(MyD88)的表达,然后激活NF-κB信号通路,最终诱发人脐静脉内皮细胞(human umbilical vein endothelial cell,HUVECs)的炎症反应,组织局部缺血和炎症后HMGB1表达水平明显提高,并且诱导了细胞凋亡[14]。microRNA(miRNA)是近年的研究热点,可参与神经元细胞的正常生长发育[15-16]。已有研究表明,miR-410-3p通过靶向HMGB1抑制骨关节炎小鼠软骨细胞凋亡和炎症[17]。
但目前尚无研究报道miR-410-3p在缺氧缺血性脑损伤中的表达,以及miR-410-3p、HMGB1/NFκB在缺氧缺血性脑损伤中的调控机制。因此,本研究采用PC12细胞进行缺氧缺血处理,并通过相关转染处理,以探究miR-410-3p通过介导HMGB1/NFκB通路对缺氧缺血性神经元细胞生物学特性的调控作用。
1 材料与方法
1.1 材料
1.1.1 细胞与试剂 大鼠肾上腺髓质嗜铬瘤分化细胞PC12细胞购自通派(上海)生物科技有限公司;胰蛋白酶-EDTA(Gibco,25200072,美国);Lipofectamin2000试剂盒(Invitrogen,美国);Trizol(货号:16096020,赛默飞世尔科技,美国);TaqMan Micro RNA Assays ReverseTranscription Primer(Thermoscientific公司,美国);SYBR®PremixExTaqTMⅡ试剂盒(行知生物科技有限公司,中国);RIPA裂解液(R0010,Solarbio,中国);BCA试剂盒(赛默飞公司,美国);双荧光素酶报告试剂盒(Promega);PVDF膜(ISEQ00010,Millipore,美 国);一 抗 兔 抗HMGB1(ab18256)、NF-κB p65(ab16502)、GAPDH(ab8245)(Abcam,英国);HRP标记的羊抗兔IgG抗体(北京中山生物技术有限公司,中国);ECL荧光检测试剂盒(货号BB-3501,Ameshame公司,英国);IL-8、IL-6、TNF-α检测试剂盒(69-21138、69-25328、69-40133,武汉默沙克,中国);CCK-8(Sigma,美国);Annexin V-FITC(ab14085,Abcam,美国)。
1.1.2 主要仪器 酶标仪(NYW-96M,北京诺亚威仪器仪表有限公司,中国);Bio-Rad图像分析系统(Bio-Rad公司,美国);ABIPRISM®7300(型号:Prism®7300,上海坤科仪器设备有限公司,中国);流式细胞仪(BD FACSCantoⅡ,北京安麦格贸易有限公司,中国)。
1.2 方法
1.2.1 细胞培养PC12细胞系置于含5%胎牛血清、5%马血清和10 U/L链霉素的DMEM培养箱中,在37℃、5%CO2环境下恒温培养。
1.2.2 缺氧缺血细胞模型构建PC12细胞于含10%胎牛血清与二抗(50µg/ml青霉素、链霉素)的DMEM中培养,5%CO2、37℃的恒温孵育箱中培养,待细胞密度长至85%~90%时进行传代培养。然后,37℃下,0.25%胰蛋白酶-EDTA消化1 min,500 g离心5 min,将沉淀的细胞以1∶3的比例进行传代。第3~6代的汇合细胞用于所有实验。为了构建体外细胞缺氧缺血模型,将PC12细胞在95%N2、5%CO2和37℃环境下的无糖平衡盐溶液中培养2 h。除去培养基并用PBS冲洗3次。
1.2.3 细胞转染 将细胞分为6组:Normal组(正常PC12细胞)、NC组(缺血性处理的PC12细胞,转染阴性对照质粒)、Model组(缺血性处理的PC12细胞)、miR-410-3p mimic组(缺血性处理的PC12细胞,转染miR-410-3p过表达质粒)、HMGB1 vector组(缺血性处理的PC12细胞,转染HMGB1过表达质粒)、miR-410-3p mimic+HMGB1 vector组(缺血性处理的PC12细胞,共染miR-410-3p过表达和HMGB1过表达质粒)。
Normal组细胞不做缺氧缺血处理。其余组细胞均进行缺氧缺血处理。将细胞以3×105个/孔接种于6孔板中,细胞生长密度达到50%~60%时即可使用Lipofectamin2000试剂盒进行转染。5µl目的质粒(miR-410-3p mimic或HMGB1 vector)稀释至250µl Opti-MEM培养基中,另将6µl Lipofectamin2000稀释至250µl Opti-MEM培养基中,轻弹混匀。室温静置5 min后将两液体均匀混合,静置20 min后滴入细胞培养孔中,轻晃培养板混匀之后置于37℃、5%CO2细胞培养箱中继续培养,6 h后更换完全培养基,转染后36 h收集细胞进行实验。
1.2.4 荧光素酶报告系统 经过生物学预测网站(www.targetscan.org)进行miR-410-3p与HMGB1结合位点的分析。通过双荧光素酶报告系统验证miR-410-3p与HMGB1的靶向关系。构建靶基因HMGB1双荧光素酶报告基因载体与miR-410-3p结合位点突变的突变体:PGL3-HMGB1wt和PGL3-HMGB1mut。将Rellina质粒和报告质粒分别与miR-410-3p mimcs和NC mimcs共转染到HEK293T细胞中。在细胞转染24 h后,进行双荧光素酶检测。首先将各组细胞裂解,裂解后以12 000 r/min离心1 min,去沉淀,收集上清液。按照双荧光素酶报告试剂盒说明书测量荧光素酶活性。操作步骤如下:将裂解后的细胞样品吸入EP管中,每10µl样品中萤火虫荧光素酶工作溶液100µl,测得萤火虫荧光素酶之后加入海肾荧光素酶工作溶液100µl,测得海肾荧光素酶结果。相对荧光素酶活性=萤火虫荧光素酶活性/海肾荧光素酶活性。
1.2.5 qRT-PCR实验Trizol试剂盒提取总RNA。TaqMan MicroRNA Assays Reverse Transcription Primer逆转录合成cDNA。SYBR®PremixExTaqTMⅡ试剂盒进行荧光定量PCR检测。依次加入以下组分:25µl SYBR®PremixExTaqTMⅡ(2×),各2µl PCR正反向引物,ROXReferenceDye(50×)1µl,4µl DNA模板,16µl ddH2O。在ABIPRISM®7300系统进行荧光定量PCR,反应条件为:95℃预变性10 min,95℃变性15 s,60℃退火30 s,循环32次后72℃延伸1 min。ΔCt=Ct(目的基因)-Ct(GAPDH),ΔΔCt=ΔCt(实验组)-ΔCt(对照组),miR-19a以U6为内参,用2-ΔΔCt表示各目的基因相对表达量。引物见表1。

表1 qRT-PCR引物序列Tab.1 Primer sequences for qRT-PCR
1.2.6 Western blot使用含PMSF的RIPA裂解液提取总蛋白。BCA试剂盒测定蛋白浓度,去离子水调整浓度。样品与加样缓冲液混合,沸水浴10 min,在各泳道每孔加入30µg蛋白样品,以80 V恒压电泳2 h。将蛋白转移至PVDF膜,电压110 V,转膜2 h。5%脱脂奶粉4℃封闭PVDF膜2 h。弃去封闭液,TBST洗1次,加入一抗兔抗HMGB1(1∶1 000)、NF-κB p65(1∶1 000)、GAPDH(1∶2 000)4℃孵育过夜,TBST洗涤3次,每次10 min。然后孵育HRP标记的羊抗兔IgG抗体(1∶5 000稀释)。TBST漂洗后,置于干净的玻璃平板上。取ECL荧光检测试剂盒中等量的A液和B液,暗室中混匀,将其滴加膜上,放入凝胶成像仪中曝光成像。用Bio-Rad图像分析系统照相,用Image J软件分析,以相应蛋白条带的灰度值/GAPDH蛋白条带的灰度值表示相对蛋白含量。
1.2.7 ELISA参照ELISA检测试剂盒说明书检测细胞因子IL-8、IL-6、TNF-α的水平。
1.2.8 CCK-8检测细胞增殖 各组细胞转染48 h后,取对数生长期的细胞,用含10%胎牛血清的DMEM培养基制备成1×104个/ml的细胞悬液,接种至96孔培养板,根据实验分组,每组各设8孔,每孔100µl,置于37℃、5%CO2细胞培养箱中培养,分别于培养48 h时取出培养板,每孔加入10µl CCK-8继续培养1 h,在酶标仪450 nm处读取各孔吸光度值(OD)值。实验重复3次。
1.2.9 流式检测凋亡 各组细胞接种于96孔板(2.0×103个/孔),PBS溶液洗涤2次后离心将细胞重悬于200µl结合缓冲液中,加入10µl Annexin VFITC和5µl PI轻轻混匀,避光室温反应15 min,加入300µl结合缓冲液,用流式细胞仪以激发波长488 nm检测细胞凋亡情况。实验重复3次。
1.3 统计学分析 所有数据均采用SPSS21.0统计学软件进行处理,计量资料采用±s表示,两组间比较采用t检验,多组间的比较采用单因素方差分析。P<0.05表示差异具有统计学意义。
2 结果
2.1 双荧光素酶报告检测结果 通过生信网站分析发现miR-410-3p与HMGB1存在结合位点(图1A)。双荧光素酶报告检测发现,miR-410-3p与突变的HMGB1的3'-UTR共转染后无明显差异,而miR-410-3p与野生型的HMGB1的3'-UTR共转染后荧光素酶活性明显降低(图1B),结果表明,HMGB1是miR-410-3p的下游靶基因。
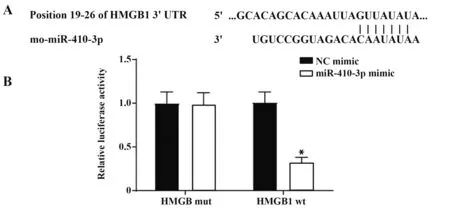
图1 生信预测与双荧光素酶报告检测结果Fig.1 Results of biosynthesis prediction and dual luciferase report
2.2 各组PC12细胞中miR-410-3p表达情况qRT-PCR检测各组细胞miR-410-3p表达情况,结果显示,与Normal组对比,其余各组细胞miR-410-3p表达量均显著降低(均P<0.05)。与Model组对比,miR-410-3p mimic组miR-410-3p表达量显著升高(P<0.05)。与miR-410-3p mimic组相比,miR-410-3p mimic+HMGB1 vector组miR-410-3p表达 量显 著降低(P<0.05)。Model组、NC组、HMGB1 vector组和miR-410-3p mimic+HMGB1 vector组miR-410-3p表达量差异无统计学意义(P>0.05)。见图2。
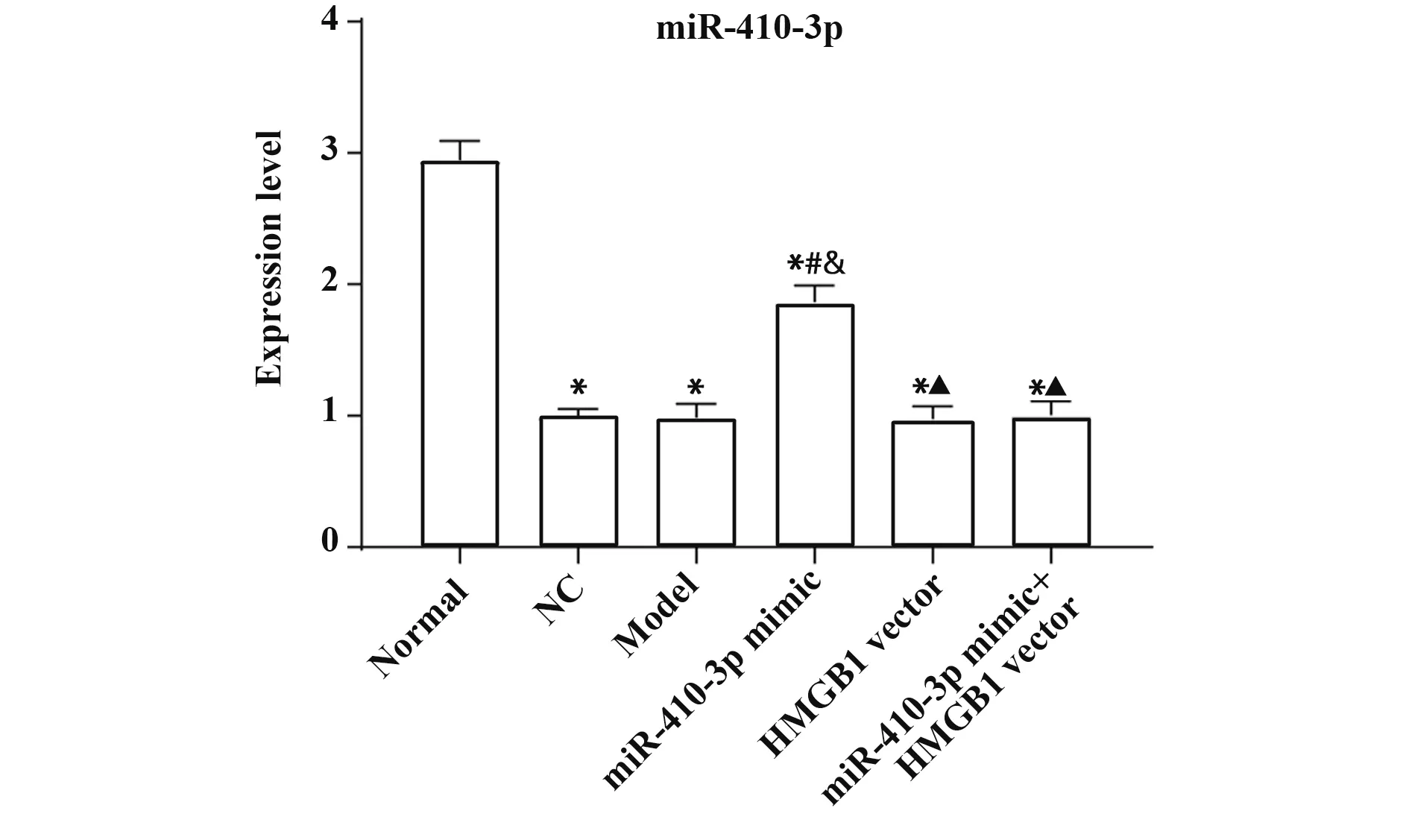
图2 qRT-PCR检测各组细胞中miR-410-3p表达情况Fig.2 qRT-PCR detection of miR-410-3p expression in each group of cells
2.3 各组PC12细胞中HMGB1 mRNA和蛋白表达情况qRT-PCR和Western blot检测各组细胞中HMGB1 mRNA和蛋白表达情况,结果显示,与Normal组对比,其余各组细胞HMGB1 mRNA和蛋白表达量均显著升高(均P<0.05)。与Model组对比,miR-410-3p mimic组HMGB1 mRNA和蛋白 水 平明显降低,HMGB1 vector组HMGB1 mRNA和蛋白水平明显升高(均P<0.05)。与miR-410-3p mimic组相比,miR-410-3p mimic+HMGB1 vector组HMGB1 mRNA和蛋白水平明显升高(P<0.05)。Model组、NC组和miR-410-3p mimic+HMGB1 vector组HMGB1 mRNA和蛋白水平差异无统计学意义(P>0.05)。见图3。

图3 qRT-PCR和Western blot检测各组细胞中HMGB1 mRNA和蛋白表达情况Fig.3 qRT-PCR and Western blot detection of HMGB1 mRNA and protein expression in each group of cells
2.4 各组PC12细胞增殖情况检测结果CCK-8检测各组细胞增殖情况,结果显示,与Normal组对比,其余各组细胞OD值均显著降低(均P<0.05)。与Model组对比,miR-410-3p mimic组OD值显著升高,HMGB1 vector组OD值显著降低(均P<0.05)。与miR-410-3p mimic组 相 比,miR-410-3p mimic+HMGB1 vector组OD值显著降低(P<0.05)。Model组、NC组和miR-410-3p mimic+HMGB1 vector组OD值差异无统计学意义(P>0.05)。结果表明,过表达miR-410-3p会促进缺血性PC12细胞增殖,过表达HMGB1会抑制缺血性PC12细胞增殖,且过表达HMGB1可抵消miR-410-3p过表达对细胞增殖的促进作用。见图4。
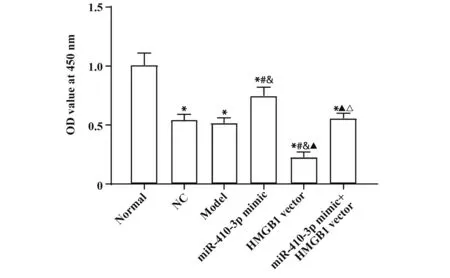
图4 各组细胞OD值统计图Fig.4 Statistics of OD values of cells in each group
2.5 各组PC12细胞凋亡情况检测结果 流式细胞术检测各组细胞凋亡情况,结果显示,与Normal组对比,其余各组细胞凋亡比例均显著升高(均P<0.05)。与Model组对比,miR-410-3p mimic组凋亡比例显著降低,HMGB1 vector组凋亡比例显著升高(均P<0.05)。与miR-410-3p mimic组相比,miR-410-3p mimic+HMGB1 vector组 凋亡比例显著升高(P<0.05)。Model组、NC组 和miR-410-3p mimic+HMGB1 vector组细胞凋亡比例差异无统计学意义(P>0.05)。见图5。
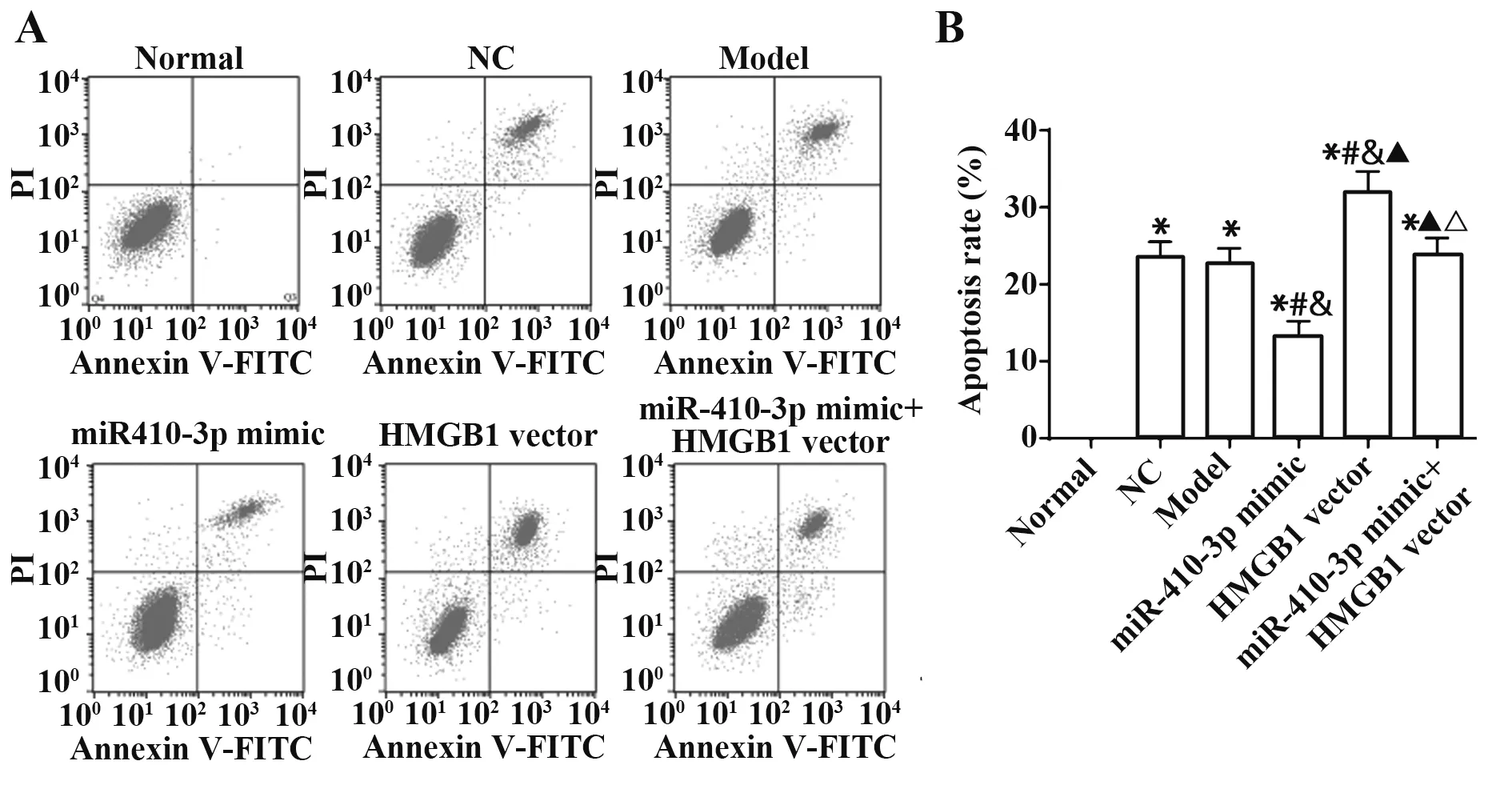
图5 流式细胞术检测各组细胞凋亡情况Fig.5 Flow cytometry to detect cell apoptosis in each group
2.6 各组PC12细胞炎症因子检测结果 检测各组细胞氧化应激损伤相关指标检测结果显示,与Normal组相对比,其余各组PC12细胞中IL-8、IL-6、TNF-α水平均明显较高(均P<0.05)。与Model组对比,miR-410-3p mimic组IL-8、IL-6、TNF-α水平均明显降低,HMGB1 vector组IL-8、IL-6、TNF-α水平均明显较高(均P<0.05)。与miR-410-3p mimic组相比,miR-410-3p mimic+HMGB1 vector组IL-8、IL-6、TNFα水平均明显升高(P<0.05)。Model组、NC组和miR-410-3p mimic+HMGB1 vector组细胞各指标含量差异均无统计学意义(均P>0.05)。见图6。
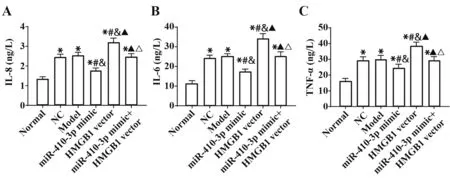
图6 各组PC12细胞炎症因子检测结果Fig.6 Test results of inflammatory factors in PC12 cells of each group
2.7 各组PC12细胞NF-κB p65蛋白表达检测结果Western blot检测各组PC12细胞中NF-κB p65蛋白表达情况,结果显示,与Normal组相对比,其余各组PC12细胞中NF-κB p65的表达量均明显升高(均P<0.05)。与Model组对比,miR-410-3p mimic组NF-κB p65的表达量明显降低,HMGB1 vector组NF-κB p65表达量明显升高(均P<0.05)。与miR-410-3p mimic组 相 比,miR-410-3p mimic+HMGB1 vector组NF-κB p65的表达量明显升高(P<0.05)。NC组、Model组和miR-410-3p mimic+HMGB1 vector组细胞NF-κB p65的表达量差异均无统计学意义(均P>0.05)。见图7。
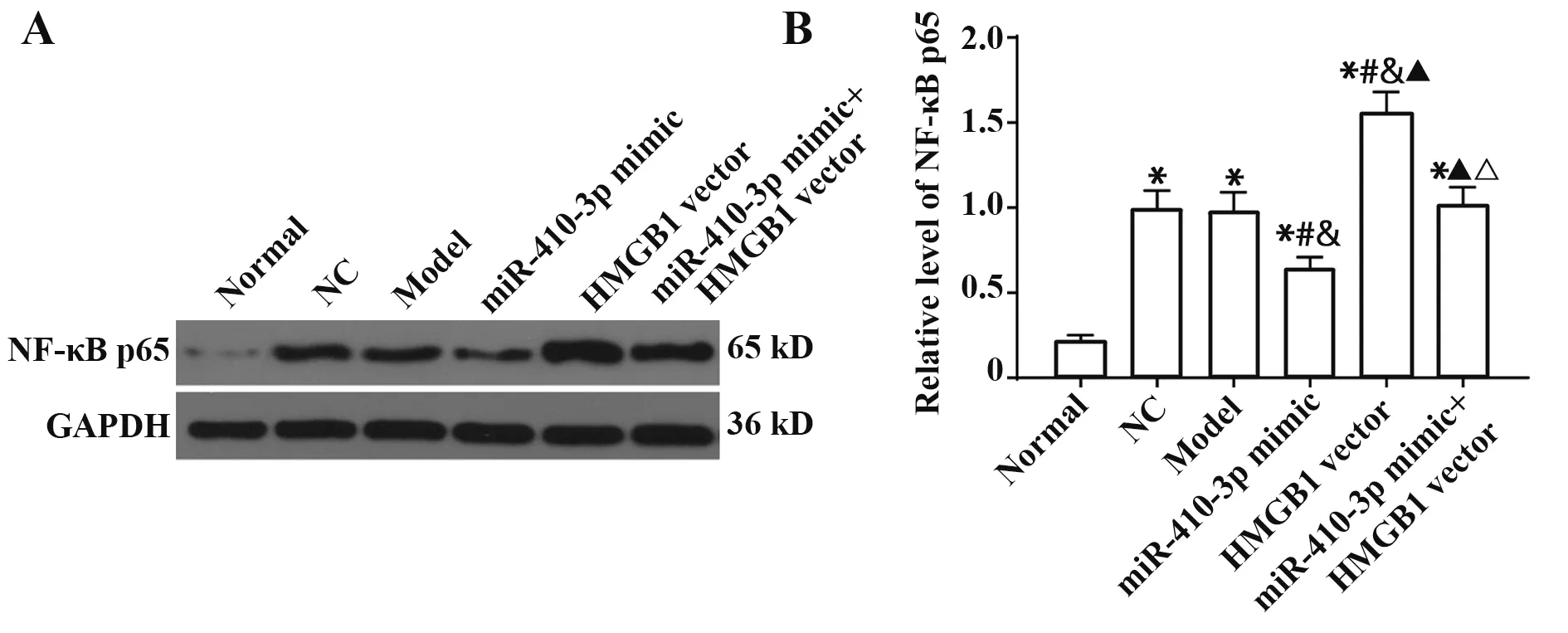
图7 Western blot检测各组细胞NF-κB p65蛋白表达水平Fig.7 Western blot detection of NF-κB p65 protein expression level in each group
3 讨论
HIBD是一种可诱发炎症性脑损伤的疾病,这也是婴儿和儿童死亡和长期神经损伤的主要原因之一。HIBD引起的缺氧性脑病是儿童严重的脑部疾病,但尚无有效治疗措施。经证实,HIBD的病理机制与氧化应激、炎症和神经细胞凋亡等因素有关[18-24]。然而现有研究对于脑缺血的分子调控机制没有较好的解释,因此探究脑缺血的具体分子机制对脑缺血患者有效治疗具有积极临床意义。
目前已有研究表明,NF-κB信号通路的激活会促进IL-6、TNF-α和其他促炎细胞因子的表达,进而影响机体炎症反应[25-26]。由于严重的炎症反应可导致严重的组织损伤。在脑缺血的大鼠模型中,HMGB1与NF-κB p65的表达量均明显增加,且HMGB1表达与NF-κB p65通路激活对脑脊髓炎有调控作用[27]。本研究中,HMGB1过表达会抑制细胞增殖,促进细胞凋亡,同时造成NF-κB p65蛋白表达上调,同时炎症因子IL-8、IL-6、TNF-α水平均明显较高,本实验结果与之前的文献报道一致[25-27]。
通过文献了解到miR-410-3p可通过调控下游靶基因影响多项生命活动。同时,miR-410-3p参与了炎症、血管生成和肿瘤发生等多个过程[28-30],其影响与HMGB1/NF-κB通路对脑缺血的调控相似,并且有文献表明HMGB1是miR-410-3p的下游靶基因,并可通过介导NF-κB通路,从而调控脑缺血性神经细胞的增殖、凋亡和炎症损伤[17]。首先,本课题组通过生信网站查到了miR-410-3p与HMGB1之间存在结合位点,为了进一步确认miR-410-3p与HMGB1之间的靶向关系,通过双荧光素酶报告实验进行验证,确认miR-410-3p可负向调控HMGB1的表达。然后通过在缺血性PC12细胞中转染miR-410-3p mimic序 列、HMGB1 vector载体和共转染miR-410-3p mimic与HMGB1 vector载体。检测各组细胞增殖、凋亡和炎症因子水平。结果表明,过表达miR-410-3p可促进缺血性神经元增殖,抑制其细胞凋亡,并降低炎症因子IL-8、IL-6、TNF-α水平。且同时转染miR-410-3p mimic与HMGB1 vector载体会抵消过表达miR-410-3p对缺血性神经元细胞的影响。
本研究再次验证了miR-410-3p与HMGB1的靶向关系,并证实在缺血性神经元细胞中miR-410-3p可通过负向调控HMGB1的表达,从而抑制NF-κB p65通路的活化,从而调控缺血性神经元细胞的增殖、凋亡和炎症损伤。然而到目前为止,尚未能明确HMGB1/NF-κB通路对调控缺血性神经元细胞的增殖、凋亡和损伤的具体分子网络,还需进一步设计实验进行深入研究。
