古海洋氧化还原条件分析方法与研究进展
2022-11-16樊秋爽夏国清李高杰伊海生
樊秋爽,夏国清,李高杰,伊海生
1.成都理工大学油气藏地质及开发工程国家重点实验室,成都 610059
2.成都理工大学沉积地质研究院,成都 610059
3.绵阳师范学院资源环境工程学院,四川绵阳 621000
0 引言
古海洋氧化还原条件研究一直是古环境分析的一个重要研究内容,这不仅是因为海洋生态系统演化和生物群落演替与海水的氧化还原性质密切相关[1-2],还因为海洋的氧化还原状态常常是形成优质烃源岩、沉积型碳酸锰矿产等国家战略性紧缺资源富集成矿的主控因素[3-4]。因此开展古海洋氧化还原条件的研究,对于查明古海洋生物的演化环境、分析盆地沉积型矿床的时空分布具有重要意义。
然而,在地史演化过程中海水的氧化还原状态是明显波动的,既存在形成“大洋缺氧事件(Oceanic Anoxic Events,OAEs)”的极端缺氧期,又存在形成“大洋红层(Oceanic Red Beds,ORBs)”的高度富氧期[5],这些不同时期海水的氧化还原状态深刻地影响了早期地球生命演化以及众多元素的地球化学循环过程。在现代海洋中,人们通常根据水体溶解氧含量和硫化氢浓度来判断底层水体的氧化还原状态,并将其划分为氧化(oxic)、次氧化(suboxic)、缺氧(anoxic)和硫化(euxinic)四大类[6],但在进行古海洋氧化还原性质研究时,需要寻找各种替代指标来间接指示。经过多年探寻和研究,目前已有很多指标被用来反演古海洋氧化还原条件,包括岩石学指标,古生物学指标,矿物学标志以及地球化学指标等[7-9]。但各项指标均存在其自身影响因素,在应用这些指标时容易出现多指标的不协调,甚至出现不同指标结论间的矛盾。例如:总硫(TS)与总有机碳(TOC)的关系通常被用作判别烃源岩形成的古海洋氧化还原条件,以TS/TOC 比值0.4 为界限将海洋划为氧化(<0.4)和缺氧环境(>0.4)[10],但Mansouret al.[9]利用该方法研究埃及特提斯洋Abu Gharadig 盆地晚白垩世海相地层氧化还原条件时发现,TS 与TOC 两者之间的相关性较差,TS/TOC比值0.4并不能作为氧化和还原环境划分的界限,原因是在贫铁的岩石中较低含量的Fe限制了沉积物中铁硫化物的形成[11]。由此可见,在开展古海洋氧化还原条件研究过程中,单项指标分析存在一定的局限性,要想准确、有效地还原古海洋氧化还原条件需要进行多指标综合分析。为了对古氧化还原条件进行系统性的研究,在前人的研究基础上综述了国内外学者近年来的重要进展,重点介绍了氧化还原研究中的岩石学、古生物学、氧化还原敏感元素、烃源岩地球化学、稀土元素体系、同位素体系和黄铁矿体系指标,并着重探讨了各项指标的优势和局限性(表1),为进一步揭示古海洋研究中氧化还原条件的恢复提供借鉴。
1 岩石学指标
岩相是沉积环境最忠实记录者,岩石颜色和类型是氧化还原环境分析最直接的证据,也是野外判断沉积环境的基础性指标。一般来说,在氧化条件下沉积物有机质含量极低,后生黏土矿物以蒙皂石为主,铁等变价元素多以氧化价态形式存在,形成赤铁矿、褐铁矿等亲氧矿物,沉积岩石类型一般包括灰岩、泥灰岩、泥质岩和硅质岩,也有少量的硅质和钙质结核,而在还原条件下沉积物中有机质能够得以保存,铁等变价元素多以还原价态形式存在,形成绿泥石、铁白云石、菱铁矿、黄铁矿和白铁矿等矿物,沉积岩石类型一般以有机质黏土、黑色页岩和有机岩等为主[12]。
颜色是岩石最醒目、最易区分的标志,也是鉴定岩石和开展环境分析的重要依据之一,能够用于初步评估岩石形成的沉积环境[5,13]。沉积岩的颜色按成因可分为三类,即继承色、自生色和次生色[14],前两者表示母岩中的矿物颜色,后者则可以指示岩石形成过程中的氧化还原环境。一般情况下,大多数岩石呈现暗灰色和黑色是由于富含有机质,且颜色越深有机质含量越高,而有机质富集的一个重要条件就是处于还原状态,因此富含有机质的深色岩石极有可能代表了当时的海洋处于还原状态。相反,岩石呈现红、棕、黄色,通常是由于岩石中含有铁的氧化物或氢氧化物,可能经历过氧化的沉积环境。通过以上方法虽然在一定程度上可以初步判断沉积环境,但由于岩石中色素的含量极其微少,如百分之几甚至千分之几的有机质就可以使石灰岩呈深色,因此以上定性分析方法是粗略的。近年来,有学者尝试通过可见光照射岩石表面所获得的漫反射光谱特征来定量分析氧化还原条件[15],该方法采用CIE L*a*b*颜色空间原理,其中L*代表光亮度,范围为0(黑暗)~100(明亮),a*代表红—绿参数,b*代表黄—蓝参数。将反射光谱中波长为530 mm 和520 mm 的红—绿参数与黄—蓝参数值相减,所得到的参数值在0到1 之间波动,当参数值越靠近1 表示氧化性越强,沉积物为红色或者白色,而当参数值越靠近0则表示还原性越强,沉积物可呈现出黑色或者灰色。但以上方法主要用于土壤、黄土和古土壤颜色的研究,用于分析其他沉积物可能会存在一定的局限性(表1),而且影响沉积物颜色的因素众多,如碳酸盐含量、湿度等[16],因此还需将岩石色度指标与岩石类型、有机质含量指标综合运用。

表1 不同指标所指示的沉积环境及其优缺点Table 1 Sedimentary environment indicated by different indices and their advantages and disadvantages

续表
2 古生物学指标
古生物的生态特征在古生物学和古海洋环境分析中发挥着重要作用,是识别古环境氧化还原条件的重要指标之一,常见的指标包括生物组合与丰度、遗迹化石特征、生物标志化合物、有孔虫氧指数和介形虫壳体微量元素与生态特征(表1)。
2.1 生物组合与丰度
不同沉积环境下的生物群落组成和丰度有所差异,这种差异可以用来指示水体的氧化还原条件。不同生物类群对水体氧气的需求有所不同,例如:具硬壳的生物类群丰度从富氧带到贫氧带呈递减趋势,而不具硬壳的软体生物类群(如蠕虫)则在不同类型的含氧带均有分布[17]。为了更好地反映生物对于水体含氧量的响应,Rhoadset al.[18]提出了生物水体氧含量模式(RMB模式),指出:1)生物的分异度随着水体含氧量的降低而减少,在贫氧带与缺氧带的界线几乎降至为零;2)生物的个体大小随着水体含氧量的降低而减小;3)水体含氧量的减少引起生物结构的变化,贫氧带中底栖生物占优势,而浮游生物类群较少,个体较大的捕食者数量明显减少;4)具硬壳的生物类群在贫氧环境中难以分泌壳体,因此导致其消失;5)当水体含氧量的减小时,生物扰动强度明显减弱,沉积纹层更发育。换句话说,即在氧气充足的环境中,生物分异度高且个体较大,浮游生物数量占优势而底栖生物较少,壳体生物大量发育,生物扰动性强;而在缺氧环境中,生物分异度低且个体较小,底栖生物数量占优势,壳体生物数量极少,生物扰动性弱。此外,海洋中一些特定生物的分布也可以指示其所处水体环境的氧化还原状态,例如:多毛环节动物、蛔虫等一些小型软体动物具有较高的表面积与体积比,通常分布在水体氧含量较低的环境,因此这种生物群的大量出现可以指示所处水体环境为缺氧状态[18];海绵动物通过捕食海水中的浮游有机质,加速了水体中有机质的消耗和埋藏,导致水体中氧气的消耗减少,并且它的正常生命活动也需大量的氧气来维持,因此海绵动物的大量出现指示所处水体环境中氧气含量较高[19]。
需要指出的是,该方法主要是依据生物群落组成和丰度大致判断古海洋氧化还原变化趋势,且不同地质时期的生物组合与丰度具有显著差异[20-21],因此这种方法对于精确限定古代某一时间段的氧化还原状态及不同时段的氧化还原状态对比应用性不强。
2.2 遗迹化石特征
遗迹化石是生物进行生命活动时在沉积底层上遗留的遗迹,经充填、埋藏和成岩作用而形成的,直接反映了生物与沉积底层间的关系,以及造迹生物的行为习性特征和生命活动期间所处的生态环境,其中底层沉积物所处的古氧化还原条件的差异性变化与遗迹化石的组成、产状与分布直接相关,因此遗迹化石的特征可作为判识古氧化还原条件和沉积环境特征的重要标识[13,22]。一般认为,在缺氧的水体中,遗迹化石的分异度低且生物扰动性弱,沉积底层构造保存较好;在富氧的水体中,生物多样性高且扰动性强,沉积物纹层构造难以保存。除此之外,一些特定的遗迹化石组构也可以被用来指示水体氧化还原状态,例如:Chondrites是食沉积物生物形成的觅食迹,一般存在于氧含量濒临于零的界限附近[23-24];Planolites是生物在沉积物中进食而留下的觅食迹,通常在沉积物—水界面以下活动;Zoophycos是形态复杂的遗迹化石,存在众多造迹模式(食沉积物模式、食碎屑物模式等),一般常见于氧化还原界面附近[13];Thalassinoides是甲壳动物的居住迹,常见于潮间带滨岸半咸水环境。因此,Chondrites-Planolites组合指示缺氧的沉积环境,Planolites-Zoophycos组合表示缺氧的沉积环境,Planolites-Thalassinoides组合则表示相对氧化的沉积环境[25]。需要指出的是,遗迹化石虽然在一定程度上能够指示海洋的氧化还原状态,但因其时空分布复杂而只能作为一个定性指标[26],且遗迹化石的分异度和分布特征也会受到沉积环境和地史事件的影响(如大灭绝事件等)[20],且该方法要求的专业性较强,对于遗迹化石鉴定薄弱的非专业群体来说实用性不高,但该方法对于那些实体化石较为匮乏或完全缺失的地区来说具有其独特优势[27]。
2.3 生物标志化合物
生物标志化合物是沉积物中来自生物体、由C、H 和其他元素组成的复杂有机物质。它在沉积和埋藏的过程中具有较强的稳定性,因此可作为识别氧化还原环境的指标[28]。目前可以应用于氧化还原条件分析的生物标志化合物主要有藿烷、伽马蜡烷、姥鲛烷与植烷比值和胡萝卜烷含量[29-30]。
藿烷是地质中常见的一类生物标志物,研究发现其化合物中的Ts/(Ts+Tm)除了可以作为有机质成熟度指标外,还可以用两者相对含量来指示氧化还原环境。一般认为Tm 含量优势显著指示为还原环境,而Ts 含量优势显著指示为氧化环境[31]。伽马蜡烷是由微生物细菌通过还原作用分解形成的一类生物标志化合物,因此高含量的伽马蜡烷被用作指示强还原环境[31]。姥鲛烷(Pr)和植烷(Ph)都是由植醇分解形成的,在氧化条件下优先形成姥鲛烷而还原条件下优先形成植烷,一般认为Pr/Ph>1.0 指示的是次氧化环境,Pr/Ph<1.0 指示的是还原环境[32]。胡萝卜烷含量同样也可以反映沉积环境的变化,在有氧的环境下非常容易被分解,因此高胡萝卜烷值可以指示还原环境[33]。需要指出的是,实验中发现原始母岩在不同的热演化阶段所释放生物标志化合物的强度有所差异,且在不同的岩性中(泥岩和灰岩)生物标志化合物的组成变化有所不同,表明生物标志化合物还受热成熟度和岩石类型的影响[34],在运用该方法时还应当与地球化学指标相结合,从而更加精确地识别古沉积环境。
2.4 有孔虫氧指数
现代海洋学研究表明,底栖有孔虫属种、丰度以及分异度也能很好地指示古海洋氧化还原条件[35-36],但在缺氧环境下这些指标的运用容易受到限制。Kaiho[37]通过对底栖有孔虫的研究,发现底栖有孔虫氧指数(BFOI)与海洋底层水体含氧量存在着良好的线性对应关系,因此提出可以利用底栖有孔虫氧指数来有效判别水体的氧化还原状态(表2),其原理主要是利用喜氧、次喜氧以及贫氧底栖有孔虫数量权重来综合反映水体环境,计算公式如下:
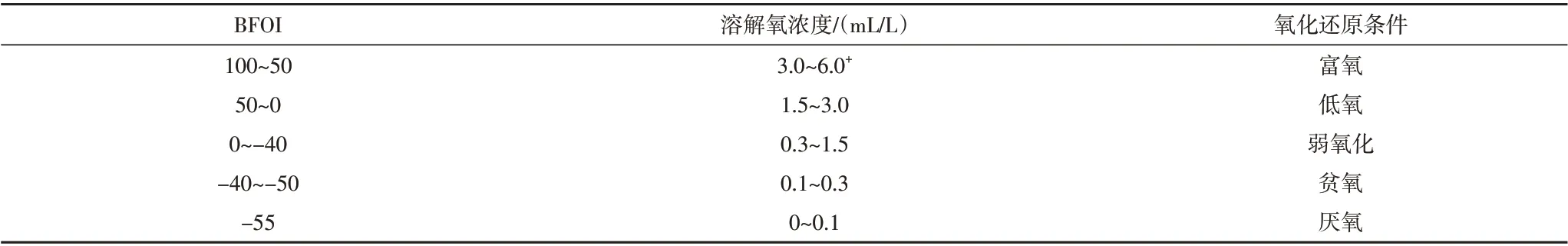
表2 底栖有孔虫氧指数(BFOI)与氧化还原环境之间的对应关系(据文献[37]修改)Table 2 The relationship between benthic foraminifera oxygen index (BFOI) and redox environment(modified from reference [37])
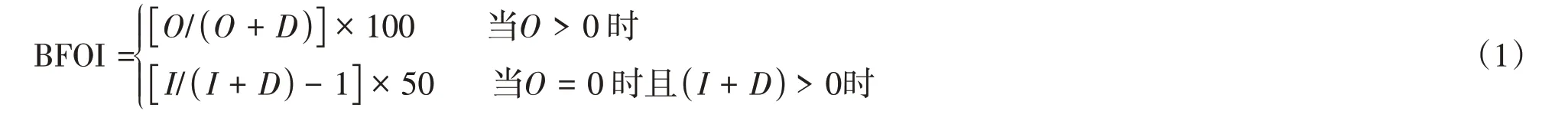
式中:BFOI代表底栖有孔虫氧指数;O代表喜氧种的个体种数,一般为壳壁较厚、个体较大的外生种(壳径大于等于350 µm);D代表贫氧种的个体种数,一般为壳壁较薄、个体较小的内生种(壳径小于200µm);I代表次喜氧种的个体种数,包括个体较小的外生种和大多数的内生种(壳径为200~350µm)。但前人研究表明,海洋初始生产力的变化能够直接影响底层水的溶解氧含量[35],因此在运用以上指标时还要注意海洋初始生产力对它的影响。
2.5 介形虫壳体微量元素与生态特征
除了上述指标外,介形虫壳体微量元素与生态特征也可以用来综合指示古沉积环境的变化[38]。相比其他生物,介形虫具有较强的适宜环境能力[39],它在壳体生长过程中与水体物质交换时间短,壳体中元素比值能够较好地反映当时的水体环境,采用较多的是U/Ca 和Mn/Ca 比值。因为在氧化环境下,介形虫壳体能充分吸收水体中溶解的U 离子,导致其壳体中U含量相对较高;而在缺氧环境下,水体中的可溶性U6+离子被还原成U4+,并且以不溶于水的铀矿(UO2)形式保存在沉积物中,抑制了介形虫在形成壳体时对于U 的吸收,致使壳体中U 含量相对较低[40],因此常用U/Ca 高值指示水体为氧化环境,U/Ca 低值指示水体为缺氧环境。与U 有所不同,Mn 在氧化环境下以不溶于水的铁锰氧化物颗粒形式存在,而在缺氧环境下以离子的形式溶解于水体中并被介壳吸收,因此介壳Mn/Ca高值指示缺氧环境[41-42]。
除此之外,介形虫壳体化石的生态特征也可以指示古沉积环境的变化。自然界中很多因素会影响介形虫的生存,如水温、盐度、水体pH值、营养输入、捕食状态等,而水体盐度和pH值是影响其生长的主要控制因子[43]。当水体盐度不足以形成方解石沉淀时,水体中介形虫的种类和丰度都很低;当水体盐度不断升高,且已达到方解石沉淀点时,水体中介形虫的种类和丰度不断增加;当超过方解石沉淀点时,介形虫的种类减少而丰度趋于增高,因此介形虫壳体化石的生态特征也能很好地反映古水体特征,将其作为对于壳体微量元素特征指标的补充,可以更加全面地指示古沉积环境。例如,陈伟等[38]在对柴达木盆地介壳微量元素和生态特征的研究中,深入探讨了沉积环境氧化还原条件的演化阶段,为古环境的恢复提供了十分重要的借鉴意义。但需要指出的是,利用介形虫壳体元素比值在开展氧化还原条件研究时还需要评估成岩作用的影响。
3 元素地球化学体系
随着地球化学技术的不断发展与完善,国内外学者对氧化还原敏感元素指标进行了综合报道[9,44],由于Mo、U、V、Ni、Co 等敏感元素在水中的溶解度明显受到水体氧化环境条件的控制,因此该方法也是开展古海洋氧化还原条件研究的最常见的手段,鉴于烃源岩的特殊性及古环境研究的重要性,特将其单独介绍。
3.1 烃源岩地球化学指标
烃源岩作为油气资源生成最重要的物质基础,也是开展油气评价工作的基础。对于烃源岩形成而言,初级生产力和水体的氧化还原条件是影响有机质富集的两个关键因素[45]。初级生产力是有机质富集的第一要素,它直接从源头控制有机质的输入量,而海洋的氧化还原条件则控制了有机质在沉降与埋藏过程中的氧化分解,是有机质形成的重要保存条件。因此,开展古海洋氧化还原条件的研究,对于查明海相优质烃源岩时空分布、恢复地史时期古环境演化具有重要意义[3,46-47]。下面着重介绍几种常用的烃源岩氧化还原条件研究方法。
3.1.1 TS/TOC
由于海洋中不同元素的沉积循环机制有所差异,且多与有机碳含量呈现相关性,因此可以用元素与有机碳的比值来反映海洋的氧化还原条件,如沉积物中总硫(TS)与总有机碳(TOC)比值[9-10,48]。海洋中硫循环经历了复杂的化学反应过程:首先细菌利用沉积物中的有机碳作为还原剂还原水体中溶解的硫酸盐,并产生H2S,然后在成岩的过程中与水体中的铁离子结合生成铁的硫化物(FeS),最终以黄铁矿(FeS2)的形式保存在沉积物中[10](图1a),因此沉积物中硫的含量主要受海水硫酸盐浓度、铁离子浓度和TOC 含量的控制[48]。正常海洋氧化环境中黄铁矿的生成取决于TOC 的供应[49],TS 与TOC 之间具有良好的线性关系且TS/TOC 比值小于0.4;缺氧环境中大部分新富集的有机质还未埋藏就和硫酸盐反应,导致保存在沉积物中的TOC含量很少且有利于黄铁矿的生成,沉积物中TS/TOC 比值大于0.4(图1b)[10,50-52]。但仍需强调这个指标同样存在局限性(表1),因为贫铁的岩石中较低含量的Fe限制沉积物中铁硫化物的形成[11]。

图1 海洋中S 循环过程及TS 与TOC 的关系图(据文献[10]修改)(a)海洋中S循环过程图解;(b)沉积物中TOC与TS之间的关系图(星形表示BERNER实验的数据点,虚线内包含了其他学者附加的数据点[51-52])Fig.1 S-Cycle and the relationship between total sulfur (TS) and total organic carbon (TOC) in the ocean(modified from reference [10])(a)graphical analysis of S-Cycle in the ocean;(b)the relationship between TOC and TS in sediments is shown in the diagram(the star represents the data points from the Berner experiment,and the dotted line contains the additional data points of other scholars [51-52])
3.1.2 TOC/P
开展烃源岩氧化还原条件分析的另一个重要指标是TOC/P。自然界中磷是重要的营养元素,在海水中以溶解和颗粒两种形态存在。溶解形式包括无机P 和大分子胶体P,颗粒P 包括浮游植物有机P 以及生物磷灰石、自生磷矿物沉积和被颗粒吸附的P[53-54]。
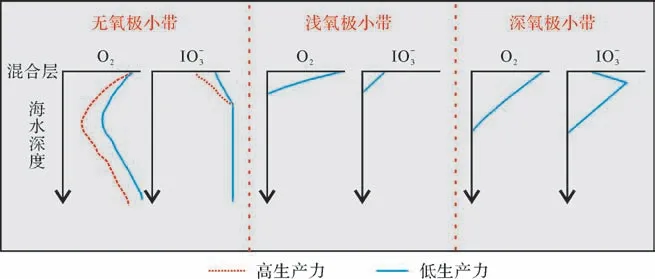
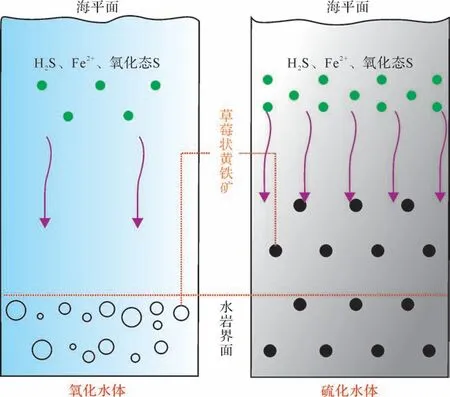
不同于TOC,P 保留在沉积物的过程强烈依赖于底层水氧气浓度,氧化环境比缺氧环境更加促进P 的滞留[55-57](图2a,b)。氧化环境下,有机P 通过铁锰氧化物及铁的氢氧化物的吸附作用、络合作用,以及聚磷酸盐生物捕获过程得以保留[6,54,58],孔隙水中自生P 的浓度达到饱和而被保存在沉积物中[56];并且沉积物中的TOC 更易被细菌分解,此时沉积物中的TOC 含量很低,进而导致两者的比值偏低。缺氧环境下,Fe 以溶解离子的形式存在,释放到沉积物孔隙水中的P 很可能扩散重新回到上覆水体中[55],且该环境下的有机碳会相对富集,进而导致TOC/P比值升高。一般认为TOC/P<50指示的是氧化环境,50 图2 P 在沉积物中相对含量的变化和循环模式图(据文献[56-57]修改)(a)氧化环境下沉积物中P的相对含量随埋藏时间的变化;(b)缺氧环境下沉积物中P的相对含量随埋藏时间的变化;(c)沉积物中P的循环模式图Fig.2 The relative content of phosphorus (P) in sediments and its cyclic pattern (modified from references [56-57])(a)the relative content of P in sediments under oxidizing environment changes with burial time;(b)the relative content of P in sediments under anoxic environment changes with burial time;(c)cyclic pattern of P in sediments 3.1.3 有机碳埋藏分数 有机碳埋藏分数Forg反映的是总碳埋藏通量中的有机碳分量,其变化与氧化还原条件密切相关。Forg的计算公式为:Forg=(δ13Ccarb-δ’w)/(δ13Ccarb-δ13Corg),式中(δ13Ccarb-δ13Corg)表示碳酸盐和有机质之间碳同位素的相对分馏,δ’w 为外生碳循环(如风化作用和火山作用)进入到大洋中的碳同位素组成,一般取值为总沉积碳的平均碳同位素值-5‰[59]。研究表明,Forg与总有机碳含量(TOC)具有很好的对应关系;高Forg值对应了地层中的高TOC含量,指示缺氧条件;而低的Forg值则代表了氧化环境[60]。但TOC含量不仅与有机碳埋藏分数Forg有关,并与原始生产力有关,表明氧化还原条件与原始生产力对烃源岩有机质的贡献都很重要[60],因此在运用有机碳埋藏分数进行分析时,还要考虑原始生产力的影响(表1)。 氧化还原敏感元素是指元素在水中的溶解度明显受水体氧化环境条件的控制,主要包括Mo、U、V、Ni、Co 等元素,在氧化还原条件变化的过程中,这些元素的赋存状态会发生改变[61]。即氧化环境下被氧化成高价态离子溶解在海水中,缺氧环境下被还原成低价态离子,从水体中分离并保存在沉积物中,因此借助它们进行氧化还原条件研究是重要的地球化学手段。但在开展古海洋氧化还原条件研究之前,首先需要对元素地球化学指标的有效性进行评估,因为沉积岩元素主要来源于四个方面,包括陆源输入、海水沉积、生物沉积和热液来源[62-63]。一般认为只有海水沉积和生物沉积的元素含量才可以指示氧化还原条件[6,64],因此在判别氧化还原条件前需要排除陆源输入和热液的影响。其中热液活动会显著影响沉积物中的元素含量和局部氧化还原环境,且具有非常明显的Eu异常,可以据此来判断热液的影响程度[63]。另一方面,陆源输入元素也会对氧化还原分析产生较大影响[6,44,64]。一般要排除陆源元素影响,计算自生元素的值可以用以下公式表示,即X自生=X样品-Al样品×(X/Al)平均页岩[63]。式中:X自生为去除陆源输入的自生元素的含量值,X样品和Al样品分别代表样品中测试的微量元素和Al 的值,(X/Al)平均页岩表示平均页岩中微量元素和Al 的比值。另外,还可以通过Al 和Ti标准化后的富集系数(XEF)来表明沉积物中元素富集还是亏损,即XEF=(X/Al)样品/(X/Al)平均页岩[64]。式中:XEF表示指标元素富集系数,(X/Al)样品表示样品中指标元素与Al 的比值,(X/Al)平均页岩表示平均页岩中指标元素与Al 的比值,XEF>1 表示元素富集,反之则表示亏损。以上方法在使用时也存在一定的局限性,对于那些所处边缘海洋环境的沉积物,其中一部分的Al并不赋存于陆源成分中而不能作为识别标志。 3.2.1 Cu/Zn与V体系 Cu和Zn在沉积过程中因介质氧逸度的差异而形成不同的沉积分带。具体来讲,当介质的氧逸度降低时,保存在沉积物中的Cu会向Zn过渡,导致Cu/Zn的值减小,因此可利用沉积物中的Cu/Zn值来指示沉积环境含氧量的变化。即当Cu/Zn值大于0.63时指示氧化环境,Cu/Zn 值介于0.63~0.5 时指示弱氧化环境,Cu/Zn值介于0.5~0.38时指示过渡环境,Cu/Zn值介于0.38~0.21时指示弱还原环境,Cu/Zn值小于0.21指示强还原环境[65]。需要指出的是,在不受大规模火山作用和变质作用的影响下(表1),此时沉积物中的Cu/Zn值保持相对稳定,才可以被用来反映古沉积环境。 Mo、U、V、Ni、Co、Th等V体系也是开展氧化还原条件分析的一项重要指标[66]。一般这些元素溶于氧化水体,而在硫化水体中发生富集,造成这种现象的主要原因是它们对于氧化还原环境的敏感程度不同。氧化环境中Mo与U都以离子的形式溶解于水体中,且它们在沉积物中的富集受到限制。次氧化环境中U比Mo更容易发生富集,此时水体中还没有生成H2S,在铁的氧化还原作用下,U被优先还原富集在沉积岩中,导致沉积物中U的富集量大于Mo(UEF>MoEF)。硫化环境中Mo在硫化氢的作用下被还原成钼酸盐,之后易被吸附在腐殖质和Fe、Mn氧化物上而富集在沉积物中,而U 被还原形成易溶性离子,导致沉积物U的富集量小于Mo(UEF 图3 UEF、MoEF 在不同环境下的变化及沉积机制(据文献[67]修改)(a)UEF、MoEF在不同环境下的变化;(b)U、Mo在不同氧化环境下的沉积机制(UEF、MoEF分别表示U和Mo的富集系数)Fig.3 The changes and depositional mechanisms of UEF and MoEF in different environments (modified from reference [67])(a)changes of UEF and MoEF in different environments;(b)the deposition mechanism of U and Mo under different oxidation environments (UEF and MoEF indicate the enrichment factors of U and Mo) 此外,V/Cr、Ni/Co、V/(V+Ni)和U/Th 的比值也常用来反映水体的氧化还原条件[9,68-69]。Cr 在氧化条件下以铬酸盐的形式溶于水体,缺氧条件下易形成水合离子,进而被Fe、Mn的氢氧化物带入沉积物中,但是Cr的还原条件出现在硝化界面的上部而V的还原条件出现在其下部[70]。Co 与Ni 都是亲硫元素,在氧化条件下都溶于水,但Co 在缺氧的条件下能形成不溶的CoS 保存在沉积物中,而Ni 在强还原条件下才形成不溶的NiS[6]。与U 有所不同,Th 在海水中化学性质稳定,一般富集在黏土颗粒上。以上元素在还原环境中均可以发生一定程度的富集,但又因各自地球化学性质的不同导致它们在沉积物中的富集量存在差异,因此它们的比值可以被用来指示水体的氧化还原状态[28],具体对应关系见表3。 表3 氧化还原敏感元素地球化学指标(据文献[68]修改)Table 3 Geochemical indices of redox sensitive elements (modified from reference [68]) 3.2.2 I/(Ca+Mg)比值 碘(I)在自然界中存在多种价态,同样是氧化还原敏感元素之一。氧化态的IO-3和还原态的I-在海水中都可稳定存在,由于IO-3/I-与O2/H2O 两者的还原势能接近,因此I/(Ca+Mg)值可以用来反映海洋氧含量,用于表明古海洋表层水体的氧含量的变动[71]。这是由于IO-3可能以类质同相的方式替代了碳酸盐矿物中的CO2-3,但I-无法进入碳酸盐岩晶格。随着海洋中氧含量的下降,IO-3被逐渐还原成I-,导致氧化条件下碳酸盐沉积物中I 的含量增高,I/(Ca+Mg)值较高,而还原条件下碳酸盐沉积物中I 的含量会减小,I/(Ca+Mg)值相对较低[71]。但由于受生产力和水体氧极小带(OMZ)因素的影响[72-73](图4),在不发育OMZ的环境中,IO-3浓度从高生产力的混合水体向下逐渐升高后保持稳定,而O2浓度由于存在动植物的呼吸作用而减小;在较浅OMZ 的环境中,IO-3作为氧化剂被快速消耗;在较深OMZ 的环境中,IO-3浓度向下先升高后下降。由此表明,I/(Ca+Mg)比值与水体溶解氧之间还未形成完全定量、线性的关系[74]。 图4 海水中IO-3与O2 的关系图(据文献[73]修改)Fig.4 Relationship between IO-3 and O2 in seawater(modified from reference [73]) 在前人的工作基础上,后来有学者提出可以通过确定I/(Ca+Mg)的临界值来定量指示水体中的氧含量[73-77](图5),即当表层水体中IO-3浓度小于这一临界值时指示下层水体中的IO-3被完全还原,02.5(对应IO-3浓度大于0.25µmol/L)指示水体为氧化环境(O2浓度大于20µmol/L)。但研究指出成岩作用和碳酸盐矿物重结晶作用都会引起I/(Ca+Mg)比值的变化(表1),例如:Hardistyet al.[77]通过对新近纪样品的研究,发现白云岩化作用会导致被测样品中I/(Ca+Mg)比值减小,且该方法主要用于碳酸盐岩地层研究,在其他岩性中能否应用值得进一步探索。 图5 海洋中I/(Ca+Mg)比值与O2 浓度的关系图(据文献[74,77]修改)图中虚线表示OMZ 的分界面,左侧表示存在OMZ 的环境,右侧表示现代开放海洋环境;五边形表示前人的已经研究的数据投点(据文献[74,77]);直线表示I(/Ca+Mg)比值与O2浓度之间的相关关系拟合线Fig.5 The relationship between I/(Ca+Mg) and O2 concentration in the ocean (modified from reference [74,77])the dotted line in the figure represents the interface of OMZ (oxygen-minimum zone) , the environment with OMZ on the left and the modern open marine environment on the right; the colored pentagons represent the data points that have been studied by predecessors (modified from references [74,77]); the straight line represents the fitting line of the correlation between I/(Ca+Mg)ratio and O2 concentration 稀土元素(REE,Rare Earth Element)在风化、搬运的过程中具有较强的稳定性,其分布特征可以反映沉积时期的古水体氧化还原条件,是重要的地球化学指标[78-79]。现阶段采用的比较广泛的稀土元素分析方法包括Ce异常和Y/Ho比值。 Ce 是稀土元素中的变价元素,存在+3 价和+4价,Ce3+能够以类质同像或吸附、络合的方式从海水中进入沉积物,在不同的氧化还原条件下会产生Ce异常,因此可以作为古海洋氧化还原条件的示踪剂[80]。在氧化条件下,Ce3+被氧化成Ce4+形成不溶的Ce 的氢氧化物并沉积于海水中,造成Ce 与La、Pr 的分离,进而产生Ce 的亏损。在缺氧的条件下,海水中的Ce多以+3价存在,与其他的稀土元素之间没有显著差异,进而表现为Ce 丰度的正常或轻微富集(图6)。Elderfieldet al.[81]提出了Ce 异常(Ceanom)来判断古海水的氧化还原环境,即当Ceanom>0指示缺氧环境,当Ceanom<0 指示氧化环境。其计算公式为:Ceanom= log[2CeSN/(LaSN+ PrSN)],式中:Ceanom为样品异常测定值,CeSN、LaSN、PrSN分别表示对Ce、La、Pr 的标准化处理,均选用上地壳标准化值。但是也有学者提出,在Pr分析精度较差的情况下可以利用Ce临近元素Nd予以替代[82]。目前多数学者将此方法用于碳酸盐岩的沉积环境研究。但需要指出的是,前人通过实验发现富含金属元素的沉积岩中出现显著的La 异常[83],REE 也可能在后生成岩作用的过程中重新分配,此外,不同实验方法(如不同浓度的酸溶解样品)都会对上式Ceanom值产生影响(表1)[28],因此在使用时需要评估这些影响因素。 图6 浅水富氧环境与深水缺氧环境下稀土元素的富集度(据文献[81]修改)Fig.6 Enrichment of rare earth elements (REEs) in shallow water and deep water (modified from reference [81]) Y 与Ho 具有类似的化学性质,但它们形成的碳酸盐络合物稳定性有所不同[84],因此研究中常用Y/Ho比值来区分不同的水体(海相与非海相)和氧化还原环境[85]。在正常海水环境中,Ho 被Fe、Mn 氧化物所吸附,优先沉积下来,导致现代海洋中的Y/Ho比值高于上地壳。在缺氧的环境中,水体中的Fe、Mn结核含量较低,Y、Ho的分馏较小,此时Ho难以与Fe、Mn 结核结合进入沉积物,导致沉积物Y/Ho 比值相对较小,因此较小的Y/Ho 比值可以指示缺氧状态[86]。但以上方法是基于对新元古代拉伸纪至古生代泥盆纪海相碳酸盐岩的研究,并不一定适用于非海相碳酸盐岩(表1),因此在使用时要注意其使用范围,还需要综合其他指标来进行研究分析。 不同的氧化还原水体环境会产生不同的同位素分馏效应,下面将着重介绍当前研究中运用相对广泛的Mo、U、S、N和Cr同位素的分馏原理以及它们所指示的氧化还原环境。 图7 Mo 同位素分馏与氧化还原环境(据文献[91]修改)Fig.7 Mo isotope fractionation and redox environment(modified from reference [91]) 图8 U 同位素分馏与氧化还原环境(据文献[99]修改)Fig.8 U isotope fractionation and redox environment(modified from reference [99]) N 在自然界中能够以多种形态存在(N2、NO-3、N、N),其在海水中的循环主要包括固氮作用、氨的同化作用、硝化作用和反硝化作用[109-110]。不同氧化还原水体中发生的N 循环模式有所不同,表现出来的N 同位素分馏系数也存在差异,因此能够用来反映古海洋氧化还原状态[111]。如图9所示,缺氧环境中以固氮作用为主,且该过程同位素分馏系数相对较小(0.994~1.008),导致沉积物中的δ15N 值较低。随着水体含氧量的升高,贫氧环境中以反硝化作用为主,该过程中的氮同位素分馏系数较大(1.000~1.040),导致残余未反应硝酸盐富集δ15N,进一步被其他生物利用后保存在沉积物中。随着氧气浓度的进一步增大,氧化环境中反硝化作用得以抑制,以发生硝化作用为主,该阶段N 同位素分馏系数相对较小(1.000~1.020),导致沉积物中δ15N值较低[112-113]。 图9 沉积物中氮同位素值与氧含量之间的关系(据文献[110]修改)Fig.9 Relationship between nitrogen isotope values and oxygen content in sediments (modified from reference [110]) 上述方法用于评估海洋中局部N循环与氧化还原的状态随时间的变化,在运用中仍存在着一些问题。一方面,N 循环取决于局部区域的水体环境,而用来反映大区域的水体氧化还原条件具有一定的限制,此时各局部区域所得出的δ15N 之间不具可比性,因此以上指标只适用于定性分析某一区域内水体的氧化还原状态随时间的变化。另一方面,沉积物在成岩过程中发生的脱氨反应、流体活动过程中发生的物质交换[110,114],这些都会引起沉积物中N同位素的改变(表1),从而导致以上指标的判别结果出现错误。 在不同的氧化还原条件下,黄铁矿的形成机理和矿化程度(DOP)具有较大差异,且矿物的粒径大小、分布范围和晶形形态特征,在很大程度上取决于当时水体的氧化还原环境[121-122]。因此,可利用黄铁矿的矿化程度、粒径大小和分布规律来指示水体的氧化还原环境,并且该方法已成为恢复古海洋氧化还原环境的有效手段之一[123]。 沉积物中的铁主要分为高活性铁(FeHR)和硅酸盐矿物中的铁,两者之和表示为总铁(FeT)[124-125]。高活性铁组分包含:铁的硫化物(FePy)、碳酸盐矿物相关的铁(FeCarb)、铁的氢氧化物矿物(FeOx)和磁铁矿(FeMag)。由于沉积在缺氧水体下的沉积物中活性铁的含量要远高于氧化水体,因此可利用FeHR/FeT 的比值有效识别古氧化还原条件。当FeHR/FeT≤0.38 指示水体为氧化环境,FeHR/FeT>0.38则指示为缺氧环境[126]。 在此基础上,通过引入黄铁矿化程度(Degree of Pyritization,DOP)的指标,它是铁的硫化物与高活性铁的比值[127],即DOP=FePy/FeHR,也可以很好地指示古海洋氧化还原环境[128]。一般认为DOP<0.8指示水体为缺氧含铁环境,DOP≥0.8 指示水体为硫化环境[126]。然而,由于沉积岩在埋藏的过程中受到热蚀变的作用的影响,可能会将FeHR转换为硅酸盐矿物非活性铁,导致指标参数的降低,因此需要综合运用铁组分与黄铁矿化程度指标进行分析。即FeHR/FeT≤0.22 指示水体为氧化环境,0.22 图10 FeHR/FeT 与DOP 的关系及其指示的氧化还原环境(据文献[130]修改)Fig.10 The relationship between FeHR/FeT and DOP and its indicated redox environment (modified from reference [130]) 草莓状黄铁矿在不同的水体环境下的形成机理和粒径存在差异[131]。当水体处于氧化条件时,在沉积物表面之下存在还原性的硫酸盐细菌可以将氧组分消耗殆尽,形成局部的硫化环境并生成草莓状黄铁矿,但整个过程中,水体中H2S、Fe2+和部分氧化态硫持续缓慢供应,草莓状黄铁矿生长速率缓慢,导致所形成的黄铁矿粒径普遍较大且大小不一。在硫化环境下,草莓状黄铁矿形成于氧化还原界面以下,水体中的H2S、Fe2+和部分氧化态硫溶解较高且供应充足,草莓状黄铁矿生长速率较高并快速沉降,此时黄铁矿的生长缺乏单质硫或部分氧化态硫的供给,导致所形成的粒径相对较小且大小均一[131-132](图11)。据此,Bondet al.[133]给出了不同氧化还原条件下对应的草莓状黄铁矿粒径的划分方案,如表4所示。 表4 黄铁矿粒径特征与氧化还原环境的关系(据文献[133]修改)Table 4 Relationship between pyrite particle size characteristics and redox environment(modified from reference [133]) 图11 氧化水体和硫化水体中草莓状黄铁矿形成机理示意图(据文献[131]修改)图中箭头表示H2S、Fe2+和氧化态硫的供应,箭头数量表示它们的供应速度Fig.11 Schematic diagram of formation mechanism of strawberry pyrite in oxidized water and sulfide water(modified from reference [131])the arrows in the figure indicate the supply of H2S,Fe2+,and oxidized sulfur,and the number of arrows indicates their supply rate 此外,Wilkinet al.[121]提出利用草莓状黄铁矿粒径标准偏差与平均值二元图来指示沉积环境的氧化还原状态。该方法通过统计草莓状黄铁矿的粒径,计算其标准偏差与平均值,并绘制粒径标准偏差与平均值二元图[121,134](图12)。此方法在识别古沉积环境中得到了广泛的应用,例如:张璇等[134]在对湖北秭归吴家坪组—长兴组界线沉积环境的研究中,通过综合应用草莓状黄铁矿粒径统计与二元图方法,指出该研究层位沉积时期为氧化—次氧化环境,并间歇性发育硫化环境。但需要注意的是,草莓状黄铁矿发育还受裂隙、后期风化侵蚀作用和二次生长的影响(表1),导致其粒径统计可能存在误差[135-136],因此要综合其他方面指标(如元素地球化学指标、同位素指标等)来恢复古沉积环境。 图12 草莓状黄铁矿粒径标准偏差与平均值二元图(据文献[121],数据源自文献[134])Fig.12 Binary diagram of standard deviation and mean value of strawberry pyrite particle size (according to reference [121],data from reference [134]) 氧化还原环境除与草莓状黄铁矿粒径大小有关外,还影响其微晶形态[137],一般比较典型的形态包括:正方体、立方体、四面体、八面体、五角十二面体和球体形态[132,138]。Wanget al.[139]通过研究发现,水体的过饱和度将直接影响草莓状黄铁矿的微晶形态,当水体过饱和度增加时,草莓状黄铁矿微晶形态由立方体逐渐向八面体变化,最后再向球形变化。缺氧环境中,在水体饱和度不高且没有生成硫化氢的条件下,草莓状黄铁矿微晶形态主要以立方体为主,而在硫化环境中随着水体饱和度的增加,草莓状黄铁矿主要以球状为主。研究发现不同温度、硫化氢和氧含量条件下所形成的黄铁矿形态结构也存在明显差异,包括草莓状黄铁矿、假草莓状黄铁矿、充填型草莓状黄铁矿和自形晶黄铁矿[140]。其中假草莓状黄铁矿和充填型草莓状黄铁矿是草莓状黄铁矿向自形晶黄铁矿转变的中间形态[141],而自形晶黄铁矿的形成是由于水体中的Fe2+、H2S不断地缓慢供应,溶液此时相对于黄铁矿饱和,可直接析出自形晶黄铁矿[142]。因此大量的自形晶黄铁矿的形成可以指示水体环境为氧化条件。 前人在对古海洋沉积环境的研究中,探讨了古海洋氧化还原条件分析的多项判别指标,为后来学者进一步揭示古海洋氧化还原状态奠定了坚实的基础。虽然各项指标在不同地质背景下的运用均存在一定的优势性,但随着它们的广泛应用,学者们也提出了可能存在的问题。例如,某些情况下TS/TOC=0.4不能作为划分氧化环境和还原环境的界限,一些学者认为可能是沉积物中较低含量的铁限制了铁硫化物的形成。由此可见,仅仅运用单项指标分析古海洋氧化还原环境仍存在一定的局限性。笔者在前人工作的基础上,对这些判别指标进行了系统的整理,包括岩石学指标(岩石的颜色、类型)、古生物学指标(生物组合和丰度、遗迹化石特征、生物标志化合物、有孔虫氧指数、介形虫壳体微量元素与生态特征)、元素地球化学指标(烃源岩地球化学指标、微量元素及比值)、稀土元素体系(Ce 异常、Y/Ho 比值)、同位素体系(Mo、U、S、N、Cr 同位素)和黄铁矿体系(黄铁矿化程度、粒径大小及微晶形态),并指出了各项指标在实际运用中的判别标准及优缺点。在进行古海洋氧化还原环境条件研究时,通过综合多项指标的分析方法,相互对比印证,可以有效避免单项指标分析的局限性问题,从而得到更加准确、可靠的结论。 致谢 感谢中山大学吴驰华副教授、成都理工大学伊帆老师、陈云博士、田康志博士、石宇翔博士、吴劲宣硕士对本文提出的建议。评审专家及编辑部老师对本文提出了宝贵修改意见,在此表示衷心的感谢!
3.2 敏感元素及比值



4 稀土元素体系
4.1 Ce异常

4.2 Y/Ho比值
5 同位素体系
5.1 Mo同位素


5.2 U同位素


5.3 S同位素

5.4 N同位素

5.5 Cr同位素

6 黄铁矿体系
6.1 铁组分与黄铁矿化程度

6.2 草莓状黄铁矿粒径


6.3 草莓状黄铁矿形态
7 结语
