基于索磷布韦的药物治疗3 型慢性丙型肝炎患者疗效和安全性观察:一项单中心真实世界回顾性分析
2022-11-15徐艳雯王鑫姜华梁晨晨刘立李生浩高建鹏
徐艳雯,王鑫,姜华,梁晨晨,刘立,李生浩,高建鹏
(1)大理大学公共卫生学院,云南 大理 671013;2)哈尔滨医科大学附属第四医院消化内科,黑龙江 哈尔滨 150001;3)昆明医科大学附属延安医院消化内科,云南 昆明 650051;4)昆明市第三人民医院肝病科,云南 昆明 650041)
丙型肝炎病毒(hepatitis C virus,HCV)感染是全球性的健康问题[1]。慢性丙型肝炎(chronic hepatitis C,CHC)会导致肝硬化、肝脏失代偿和肝细胞癌[2]。直接抗病毒药物(direct-acting antiviral agent,DAA)的上市使不同基因型CHC 的SVR 率大幅提高[3-4]。但是根据现有的研究发现,基因3型,特别是3b 亚型,与肝病快速进展和DAAs 疗效不佳有关[5-6]。
在我国,西南地区的3 型CHC 患者比例较高,特别是云南省高达58.5%[7-9]。中国目前DAA 治疗3 型CHC 患者(特别是儿童及青少年、合并慢性肝衰竭患者)真实世界报道较少[10-12]。因此本研究回顾性分析了SOF/VEL 联合或不联合RBV 方案治疗中国云南地区3 型CHC 患者的真实世界研究(real world study,RWS)结果,现报道如下。
1 资料与方法
1.1 研究对象
共收集219 例2018 年1 月~2021 年3 月就诊于昆明市第三人民医院肝病科的3 型 CHC 患者的病例资料。儿童及青少年组3例,CHC 组118例,CHC-CLC 组87例,慢性肝衰竭组11 例。男性130例,女性89例,性别比1.5∶1;患者年龄在4 岁至74 岁。本研究方案由昆明市第三人民医院伦理委员会审批通过(审批号:2021120607)。
1.1.1 纳入标准符合中国《丙型肝炎防治指南(2019 年更新版)》的标准[8]:(1)HCV 抗体阳性超过6 个月且HCV RNA 定量检测>15 IU/mL;(2)基因3 型;(3)同意使用DAA 抗病毒治疗且无DAA药物禁忌症者;(4)吸毒同意戒毒者;(5)慢性丙型肝炎(chronic hepatitis C,CHC)、代偿期丙型肝炎肝硬化(compensated hepatitis C-induced liver cirrhosis,CHC-CLC)、慢性肝衰竭(chronic liver failure,CLF)患者。
1.1.2 排除标准(1)合并乙型肝炎病毒(hepatitis B virus,HBV)、人类免疫缺陷病毒(human immunodeficiency virus,HIV)者;(2)实体器官移植患者;(3)合并自身免疫性肝病者;(4)恶性肿瘤者;(5)肾小球滤过率GFR<30 mL/min 者;(6)妊娠或哺乳者;(7)治疗过程中存在不可避免的药物相互作用(drug-drug interactions,DDI)患者。
1.2 病例分组
年龄<18 岁的3 型慢性丙型肝炎患者纳入儿童及青少年组。参考中华医学会制定的《肝硬化诊治指南》[13]和《肝衰竭诊治指南(2018 年版)》[14]对患者进行分组:(1)经影像学检查或肝组织活检诊断为肝硬化,或经瞬时肝弹性成像≥14.6 kpa的3 型慢性丙型肝炎患者纳入CHC-CLC 组;(2)在肝硬化基础上,缓慢出现肝功能进行性减退和失代偿并排除其他原因的3 型慢性丙型肝炎患者纳入慢性肝衰竭组;(3)不符合(1)和(2)且年龄≥18 岁的3 型慢性丙型肝炎患者纳入CHC 组。
1.3 HCV RNA 定量检测及基因分型
HCV RNA 定量检测采用实时荧光PCR 法(试剂盒购于武汉博德永康生物制品有限公司,检测下限为15 IU/mL)。HCV 基因分型检测采用反向点杂交法(试剂盒购于达安基因公司)完成。
1.4 治疗方案
儿童及青少年3 型丙型肝炎患者治疗方案见表1。CHC 组患者给予SOF/VEL 400 mg/100 mg口服,1 次/d,治疗12 周;CHC-CLC 组患者给予SOF/VEL+RBV 方案:SOF/VEL 400 mg/100 mg口服,1 次/d,治疗12周,对于体重<75 kg者,给予RBV 1 000 mg 1 次/d,体重≥75 kg 者 1 200 mg 1 次/d,治疗12 周;合并慢性肝衰竭患者(慢性肝衰竭组)给予SOF/VEL+RBV 方案:SOF/VEL 400 mg/100 mg 口服,1 次/d,对于体重<75 kg者,给予RBV 1 000 mg 1 次/d,体重≥75 kg 者 1 200 mg 1 次/d,治疗12 或24 周。

表1 3 例CHC 儿童及青少年的临床特征Tab.1 Clinical characteristics of children and adolescents with genotype 3 CHC
1.5 疗效及安全性评估
主要疗效指标包括快速病毒学应答(rapid virological response,RVR)、治疗结束时病毒学应答率(end of treatment,EOT)、SVR12(治疗结束后12 周HCV RNA 低于检测下限)。次要疗效指标包括治疗前、停药时、治疗结束12 周总胆红素、转氨酶、肝硬度测定值、血小板、国际标准化比值。记录治疗和随访过程中不良事件(adverse event,AE)发生情况。
1.6 统计学处理
应用SPSS 26.0 软件分析数据,正态分布的计量资料用表示,患者治疗前后比较采用t检验;偏态分布的资料用M(P25,P75)表示。计数资料用例数和百分比表示,并采用χ2检验进行比较。P<0.05 为差异有统计学意义。
2 结果
2.1 患者基线特征
3 例年龄<18 岁的患者中,母亲为慢性丙型肝炎1例,其余传播途径不详。3 例患者均为初治患者,无肝硬化,ALT 均异常,白蛋白处于正常水平(表1)。
216 例慢性丙型肝炎成人患者中,HCV 基因亚型3a 型169例,3b 亚型47 例。211 例患者的性别、肝功能、白细胞计数、血红蛋白、血小板计数、HCV RNA 定量、肝硬度测定值、APRI 和治疗史等基线特征情况见表2。
表2 基因3 型慢性丙型肝炎患者的基线特征[()/M(P25,P75)]Tab.2 Baseline characteristics of patients with chronic hepatitis C genotype 3[()/M(P25,P75)]
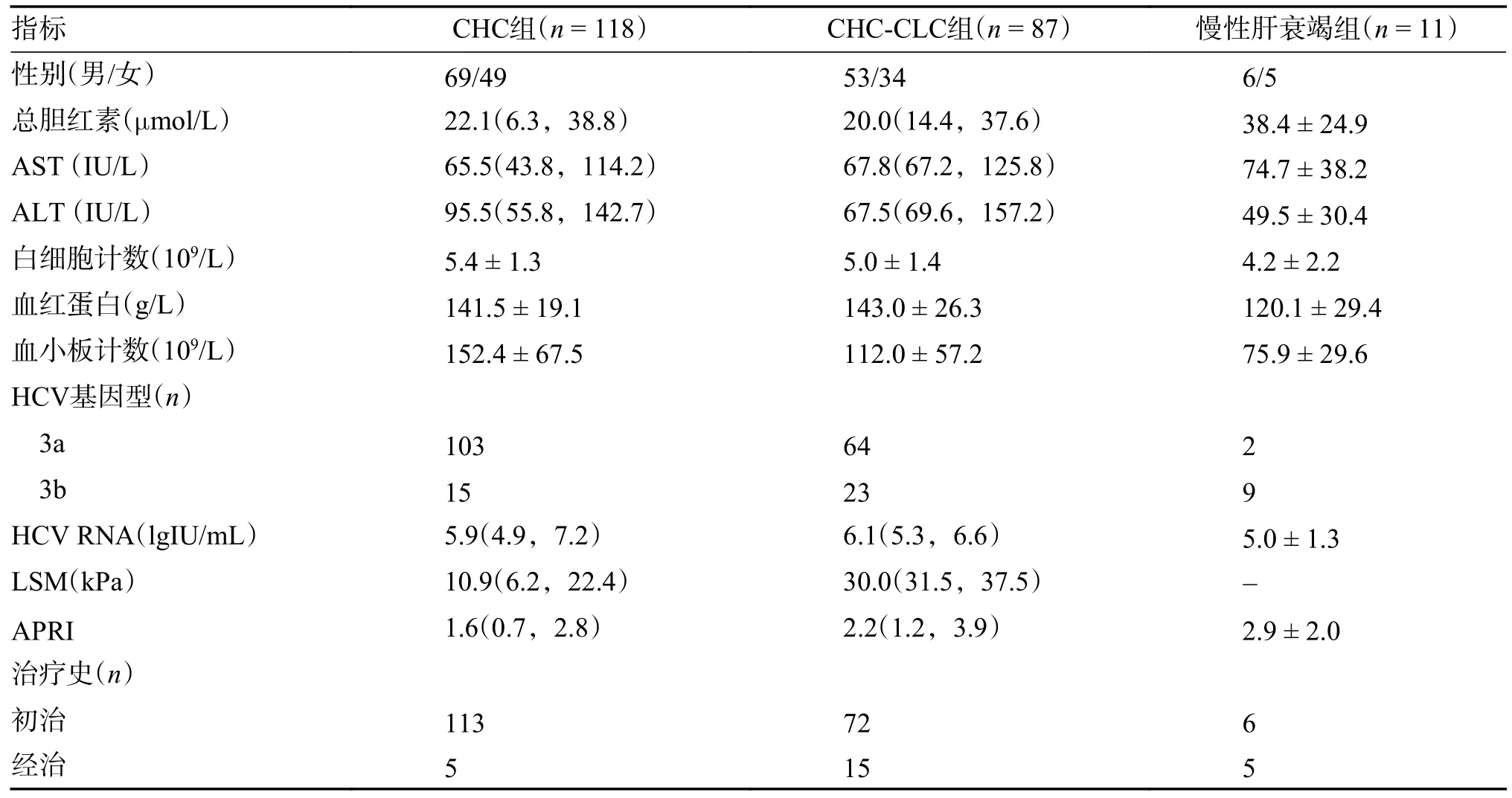
表2 基因3 型慢性丙型肝炎患者的基线特征[()/M(P25,P75)]Tab.2 Baseline characteristics of patients with chronic hepatitis C genotype 3[()/M(P25,P75)]
注:AST:门冬氨酸氨基转移酶;ALT:丙氨酸氨基转移酶;LSM:肝硬度测定值;APRI:天冬氨酸转氨酶与血小板比率指数;RBV:利巴韦林。
2.2 疗效
3 例年龄<18 岁的慢性丙型肝炎患者均获得EOT 和SVR12。CHC 组和CHC-CLC 组205 例成人慢性丙型肝炎患者中,86.3%(177/205)治疗4周时HCV RNA 阴转,205 例(100.0%)均获得EOT,199 例(97.1%)获得SVR12(图1)。其中CHC 组118例(100.0%)患者均获得RVR 和EOT,CHC-CLC组59 例(67.8%)获得RVR,87 例(100.0%)获得ROT。CHC 组中3a 型和3b 型患者SVR12 为99.0%(102/103)和86.7%(13/15),CHC-CLC 组3a 型和3b 型患者SVR12 为98.4%(62/64)和91.3%(22/23)。慢性肝衰竭组EOT 率和SVR12 率分别为90.9%(10/11)和72.7%(8/11)。本研究中共9 例(4.1%)未获得SVR12,均为结束治疗后复发。
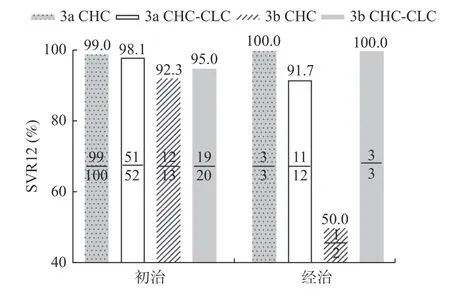
图1 3 型慢性丙型肝炎患者的持续病毒学应答分析Fig.1 Analysis of sustained virological response in patients with chronic hepatitis C genotype 3
2.3 抗病毒治疗对患者肝功能、肝硬度的影响
儿童及青少年组患者在治疗结束后12 周总胆红素、ALT、AST 均恢复正常。与基线相比,CHC组患者总胆红素(t=21.73,P<0.05)、ALT(t=261.5,P<0.05),AST(t=179.0,P<0.05)在治疗结束后12 周明显降低,CHC-CLC 组总胆红素(t=9.260,P<0.05)、ALT(t=60.13,P<0.05)、AST(t=55.25,P<0.05),在治疗结束后12 周明显降低(图2)。CHC 组和CHC-CLC 组患者治疗结束后12周肝硬度值较基线显著降低(t=95.93,P<0.05)。与基线相比,慢性肝衰竭组患者停药12 周总胆红素(z=-2.845,P=0.004)、ALT(t=3.358,P=0.007)、AST(t=3.893,P=0.003)明显降低(图3)。

图2 CHC 组和CHC-CLC 组患者治疗前后肝功能、肝硬度平均值动态变化Fig.2 Dynamic changes in the mean values of liver function and liver stiffness before and after treatment in patients in the CHC and CHC-CLC groups
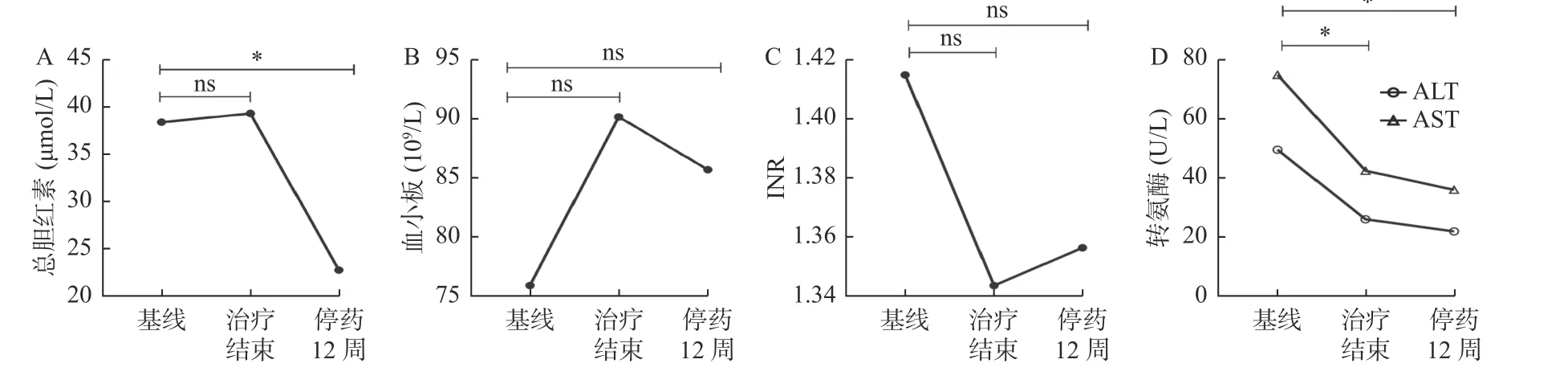
图3 慢性肝衰竭组患者治疗前后肝功能动态变化Fig.3 Dynamic changes of liver function before and after treatment in patients with chronic liver failure group
2.4 药物安全性与耐受性
219 例患者均完成SOF/VEL±RBV 治疗,60例(27.4%)患者报告轻度AE,主要为贫血、乏力和头痛,偶见恶心、失眠和腹泻,大部分为一过性,休息后上述症状可逐渐消失。无患者因AE提前终止治疗或死亡(表3)。

表3 SOF/VEL±RBV 不良反应[n(%)]Tab.3 SOF/VEL ± RBV adverse reactions [n(%)]
3 讨论
基因3 型HCV(17.9%)是仅次于基因1 型(49.1%)的全球第二大HCV 基因型,主要分布在亚洲、撒哈拉以南的非洲、拉丁美洲和东欧等的低收入地区[15-16]。在我国,基因3 型HCV(12%)流行率仅次于G1b 和G2a型,较常见的亚型是G3a型(5%)和G3b 型(7%)[10]。此外,流行病学研究还发现我国3 型CHC 患者的分布自西南到东北呈下降趋势[7]。
随着 DAAs 在全球范围内的迅速推广,干扰素时代较难治的PR(Peg-IFN 联合RBV)不适合不耐受、肝硬化等人群在DAAs 治疗下也可获得较好的疗效。本研究显示SOF/VEL±RBV治疗无肝硬化或合并代偿期肝硬化的3 型丙型肝炎患者可获得较高应答率,但治疗合并慢性肝衰竭的3 型丙型肝炎患者应答率较低。患者使用该方案后不良反应较轻,安全性可接受,且抗病毒治疗可改善患者肝功能和肝纤维化。
Wirth等[17]研究中给予12~17 岁的3 型CHC患 者24 周SOF+RBV,SVR12 为98%。Jonas[18]在2019 年的美国肝病年会上报告SOF/VEL 治疗基因3 型6~11 岁、12~17 岁的CHC 患者,SVR12分别为90.91%、100%。目前在中国少有DAA 治疗儿童及青少年CHC 的报道。本文纳入3 例年龄<18 岁的3 型CHC 患者,给予SOF/VEL±RBV12周EOT 和SVR12 为100%,与上述研究结果相似。此外,一项中国西北地区的RWS 显示,3 型患者(n=22)接受12 周SOF/VEL±RBV 方案后均获得SVR12[19]。本研究中CHC 组中3a 型和3b 型患者SVR12 为99.0%(102/103)和86.7%(13/15),CHCCLC 组3a 型和3b 型患者SVR12 为98.4%(62/64)和91.3%(22/23)。3a 型患者的SVR12 与既往研究相符,而3b 型CHC-CLC 患者的SVR12 高于既往研究,证明SOF/VEL±RBV 的方案对于云南省无肝硬化或合并代偿期肝硬化的3 型CHC 患者疗效肯定。Thurairajah等[20]研究中17 例失代偿性肝硬化患者使用SOF/VEL±RBV12 周后SVR12为88%。本研究中慢性肝衰竭组11 例患者均为失代偿性肝硬化合并慢性肝衰竭,该组SVR12为72.7%(8/11),3 例未获得SVR12 的慢性肝衰竭患者均为获得EOT 后复阳。
此研究中HCV 基因型分布、肝硬化比例与云南地区流行病学调查数据不同[19-23]。考虑该差异与3b 型患者的肝病进展较快有关。本研究纳入的3b 型患者排除了恶性肿瘤患者,因此本研究中的3b 型患者占比较少。
在基线生化学指标异常的患者中,基于SOF的DAA 治疗可使患者的肝功能改善。本研究亦对所有患者的基线生化学指标与停药后12 周生化学指标进行分析,发现两者差异具有统计学意义。另外,停药12 周后患者的肝脏弹性值较基线时明显下降。DAA 方案能改善患者的肝功能和肝纤维化。
在笔者的研究中,总体AE 发生率为27.4%。未出现因AE 中断治疗的情况。贫血为最常见的AE,尤其在使用RBV 联合治疗的CHC-CLC 组患者中[10.2%(12/118)比26.4%(23/87),P<0.05]。因此,患者治疗过程中需密切监测血常规。
综上所述,SOF/VEL±RBV 治疗云南地区3型CHC 患者可获得较高的SVR12,抗病毒治疗安全性良好,获得SVR12 的患者肝功能和肝硬度能明显改善。但3b 型患者的SVR12 率低于3a 型患者,尤其在经治和肝硬化患者中。DAAs 方案对于3 型CHC 患者临床结局的影响还需进一步的长期随访观察。
本研究为RWS,存在一些局限性。首先,纳入的样本来自于单中心,儿童及青少年亚组的样本量较少。其次,本研究缺乏基线NS5A RAS 数据,无法分析其对SOF/VEL±RBV 治疗方案的疗效影响。此外,本研究未纳入合并HBV、HIV、肝癌患者。因此,还需扩大样本量及增加队列分组,以准确了解SOF/VEL±RBV 治疗基因3 型丙型肝炎患者的疗效及安全性。
