调节性T细胞在阵发性睡眠性血红蛋白尿症异常克隆中的免疫机制研究
2022-11-15林莺张荣东陈琦陈仁利
林莺 张荣东 陈琦 陈仁利
宁德师范学院附属宁德市医院血液科,宁德 352100
阵发性睡眠性血红蛋白尿症(paroxysmal nocturnal hemoglobinuria,PNH)是一种获得性造血干细胞基因突变的克隆性疾病,现认为其发病主要为PIG-A基因突变[1],但单纯的PIG-A基因突变并不能解释其异常克隆为何能扩增并占据优势。文献报道,免疫因素和PNH 的发病及治疗效果有关,PNH 存在T 细胞免疫功能的亢进,该异常使造血干细胞易受到免疫系统攻击,而PNH 克隆能逃避该免疫攻击而获得生存优势[2-4]。调节性T 细胞是CD4+T 细胞,在体内能抑制免疫反应,有关调节性T 细胞在PNH 发病中的作用尚不清楚,且文献报道鲜见,故为探讨调节性T细胞在PNH 异常克隆中可能的免疫机制,本研究测定了PNH 患者T 细胞抑制性调节的变化,以此探讨PNH 患者体内异常克隆是否有调节性T细胞的参与以及PNH 克隆扩增优势的可能免疫因素。
资料与方法
1、一般资料
2018 年1 月至2022 年1 月在宁德师范学院附属宁德市医院住院或门诊就诊的31例PNH 患者为病例组,其中发作性PNH 患者15 例、再生障碍性贫血-阵发性睡眠性血红蛋白尿(aplastic anemia-paroxysmal nocturnal hemoglobinuria,AA-PNH)患者 16 例。31 例患者中男 21 例、女 10 例,年龄20~69 岁、中位年龄 37 岁;其中发作性 PNH 组男 10 例、女5 例,年龄 23~69 岁、中位年龄 35 岁,PNH 克隆值 20%~66%、中位PNH 克隆值48%,血常规示白细胞计数1.33~6.56 ×109/L、中位白细胞计数 2.68 ×109/L,血红蛋白56~99 g/L、中位血红蛋白73 g/L,血小板计数12~48×109/L、中位血小板计数 21 ×109/L;AA-PNH 组男 11 例、女 5 例,年龄20~68 岁、中位年龄39 岁,PNH 克隆值19%~59%、中位PNH 克隆值42%,血常规示白细胞计数1.01~5.76 ×109/L、白细胞计数2.75×109/L,血红蛋白57~105 g/L、中位血红蛋白72 g/L,血小板计数13~51 ×109/L、中位血小板计数23 ×109/L。两组在性别、年龄、PNH 克隆大小及血象情况基线匹配,差异均无统计学意义(均P>0.05)。25 例正常健康体检者为对照组,其中男14 例、女11 例,年龄19~56 岁、中位年龄38 岁,病例组与对照组在性别、年龄等一般资料方面比较,差异均无统计学意义(均P>0.05)。纳入标准:既往确诊或新诊断的PNH 患者,包括AA-PNH 患者,PNH 克隆阳性,同时无自身免疫性疾病病史、近期无感染史,诊断符合国内统一标准[5]。排除标准:PNH 克隆阴性或者同时存在自身免疫性疾病或近期有严重感染者。
本研究通过宁德师范学院附属宁德市医院伦理委员会批准(审查编号:20191009),同时受试者均知情同意并签署知情同意书。
2、主要试剂和仪器
鼠 抗 人 CD4-FITC (No. 345621) 、 CD25-PE(No. 558605)、转 化 生 长 因 子 - β(TGF- β)1-R PE(IQP-117R)等及各单抗同型对照均为美国Becton Dickinson 公司产品;淋巴细胞分离液(LTS1092PK)、Trizol RNA Reagent(No.28111-03A)、人TGF-β1(No.D622)和白细胞介素-10(IL-10)酶联免疫吸附试验(ELISA)(No.D710)试剂盒等均购于美国Invitrogen 公司;FACS Calibur 流式细胞仪为美国Becton Dickinson 公司产品;PCR 仪器为日本Takara公司产品。
3、实验步骤
3.1、流式细胞仪检测T细胞及Th细胞的亚群、调节性T细胞数量 采用细胞表面分子标记方法,CD4+CD25+调节性T 细胞数量测定采用单克隆抗体双标法,CD3+CD4+TGF-β+(Th3)细胞数量测定采用单克隆抗体三标法,细胞的绝对数应用二步法,将测得的细胞百分比乘以外周血单个核细胞绝对数即为该细胞的总数量。
3.2、叉头框蛋白P3(FOXP3)及TGF-β 的mRNA 表达检测 静脉血分离得到单个核细胞,提取总RNA,进行RNA纯度测定,紫外分光光度计测OD260/280的比值,吸光度OD260/280>1.8,然后进行 RNA 逆转录,获得 cDNA,行 PCR 扩增检测,引物由上海吉凯基因化学技术有限公司设计合成,按比例配置反应体系,计算机分析获得样本及内参的Ct 值后行数据处理。
3.3、TGF-β 及IL-10浓度检测 收集各组样本血浆,按照TGF-β1 及IL-10 ELISA 试剂盒说明书进行操作,算出浓度。
4、统计学分析
数据分析采用SPSS 22.0 统计软件,符合正态分布的计量资料以均数±标准差()表示,多组间比较用F检验,两两比较采用Bonferroni 方法校正;非正态分布的计量资料以M(P25,P75)表示,多组间比较用H检验;计数资料以例(%)表示,组间比较采用χ2检验。以P<0.05 为差异有统计学意义。
结 果
1、各组T细胞及Th细胞的亚群变化
AA-PNH 组CD4+/CD3+细胞和CD4+/CD8+比例低于对照组,CD8+/CD3+细胞高于对照组,差异均有统计学意义(均P<0.05);而发作性 PNH 组与对照组的 CD4+/CD3+细胞、CD4+/CD8+比例及CD8+/CD3+细胞的比较,差异均无统计学意义(均P>0.05)。 AA-PNH 组 与 发 作 性 PNH 组 的 Th1/CD3+CD4+细胞均高于对照组,差异有统计学意义(P<0.05);各组的Th2/CD3+CD4+细胞比较,差异均无统计学意义(均P>0.05)。见表1。
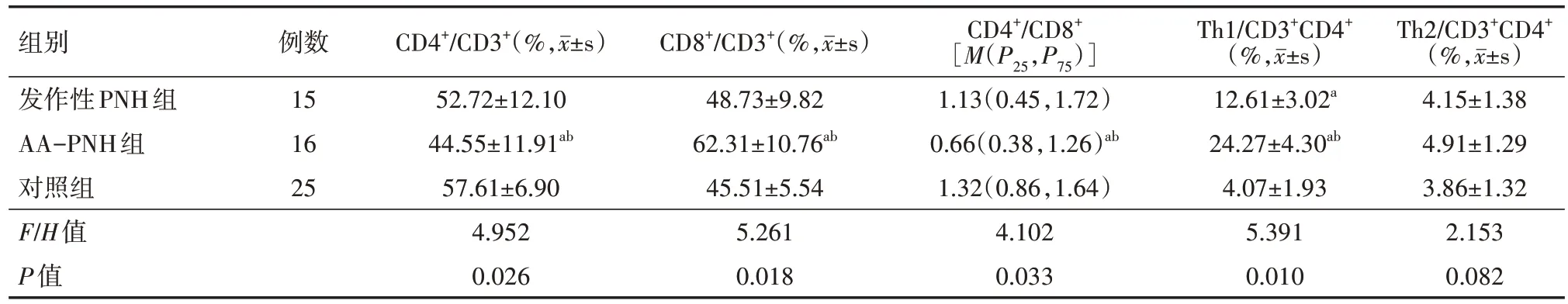
表1 PNH患者各亚组与对照组T细胞及Th细胞的亚群变化比较
2、各组调节性T细胞和Th3细胞变化
AA-PNH 组 及 发 作 性 PNH 组 CD4+CD25+T 细 胞 和Th3细胞的数量均高于对照组,差异均有统计学意义(均P<0.05),见表2。
表2 PNH患者各亚组与对照组外周血中CD4+CD25+T细胞和Th3细胞的数量和比例()

表2 PNH患者各亚组与对照组外周血中CD4+CD25+T细胞和Th3细胞的数量和比例()
注:对照组为健康体检者,PNH为阵发性睡眠性血红蛋白尿症,AA-PNH 为再生障碍性贫血-阵发性睡眠性血红蛋白尿;a指占CD4+T淋巴细胞的比例,b指占外周血淋巴细胞的比例;与对照组相比,cP<0.05;与AA-PNH组相比,dP<0.05
比例(%)b 9.89±1.23cd 4.85±1.02c 2.18±0.53 4.762 0.030组别发作性PNH组AA-PNH组对照组F值P值例数15 16 25 CD4+CD25+T细胞数量(×106/L)97.11±17.10cd 67.82±15.67c 43.86±9.52 7.016 0.003比例(%)a 28.03±3.21cd 13.35±2.72c 8.52±1.57 5.107 0.021 Th3细胞数量(×106/L)82.27±15.15cd 57.15±10.58c 42.35±9.33 6.354 0.005
3、各组FOXP3及TGF-β的mRNA表达
发作性 PNH 组和 AA-PNH 组的 FOXP3 及 TGF-β 的mRNA 阳性表达率均高于对照组,差异均有统计学意义(均P<0.01),见表3。
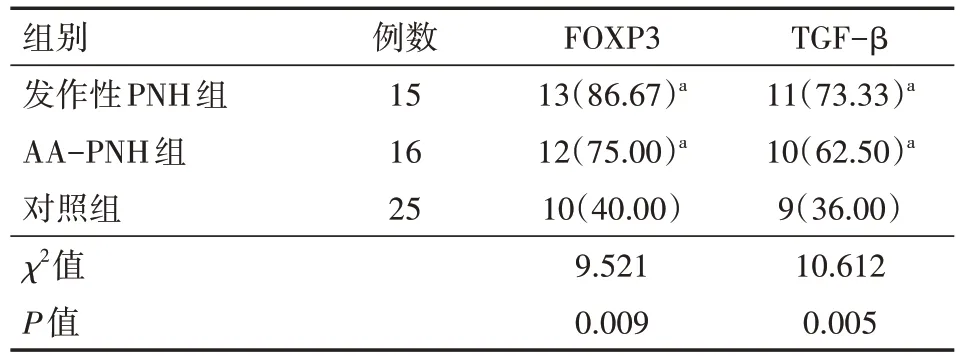
表3 PNH患者各亚组与对照组FOXP3及TGF-β的mRNA阳性表达情况[例(%)]
4、各组TGF-β及IL-10浓度
AA-PNH 组、发作性 PNH 组 TGF-β 及 IL-10 浓度均高于对照组,差异均有统计学意义(均P<0.05),见表4。
表4 PNH 患者各亚组与对照组 TGF-β 及 IL-10 的浓度情况()
注:对照组为健康体检者,PNH 为阵发性睡眠性血红蛋白尿症,AA-PNH 为再生障碍性贫血-阵发性睡眠性血红蛋白尿;TGF-β 为转化生长因子-β,IL-10 为白细胞介素-10;与对照组相比,aP<0.05;与AA-PNH组相比,bP<0.05
IL-10(pg/ml)7.86±1.17ab 5.57±1.13a 1.33±0.49 5.865 0.008组别发作性PNH组AA-PNH组对照组F值P值例数15 16 25 TGF-β(μg/L)49.76±2.03ab 37.29±1.78a 17.01±3.27 5.365 0.012
讨 论
PNH 主要特征为造血细胞表面缺乏糖基磷脂酰肌醇连接蛋白而引发补体介导的血管内溶血[6]。至今关于PNH 克隆如何获得增殖优势没有很好的解释。文献报道,骨髓中可能存在选择压力有助于发生基因突变的造血干细胞增殖,PNH 和再生障碍性贫血的相关性表明这种选择压力是免疫介导的[7-8]。研究发现,免疫因素和PNH 的发病及治疗反应有关[9]。PNH 患者行同基因骨髓移植时,使用免疫抑制药物的预处理可提高长期缓解率[10]。本研究在探讨PNH患者体内T细胞亚群变化时,发现PNH 患者CD4+/CD3+细胞和CD4+/CD8+比例低于对照组,而CD8+/CD3+细胞高于对照组,CD4+/CD8+比例倒置;同时AA-PNH 组与发作性PNH 组的Th1/CD3+CD4+细胞均高于对照组,这与既往国内外相关报道是一致的,也进一步证实了PNH 存在T 细胞免疫功能的异常,其可能造成骨髓造血功能衰竭。
对于是否存在T细胞免疫的负调控在PNH 的增强引起PNH 克隆的扩增,目前报道鲜见。体外实验结果表明,CD4+CD25+T 细胞的抑制效应可能通过膜结合分子间的接触而起作用,还可能通过抑制性因子如IL-10 和TGF-β 等发挥作用[11]。Th3细胞是诱导产生TGF-β并表达FOXP3细胞,能诱导调节T 细胞,抑制Th1 细胞增殖及细胞因子释放[12]。研究表明,FOXP3 是调节性T 细胞较为特异性标志,调节性T 细胞的抑制功能也同FOXP3 的表达有密切关系[13-14]。Wolf 等[15]研究表明,FOXP3 表达量影响卵巢癌患者的总生存及无进展生存,其高表达可逃避免疫监视。本研究检测到AA-PNH 组及发作性PNH 组CD4+CD25+调节性T细胞和CD3+CD4+TGF-β+(Th3)细胞的数量以及FOXP3表达的阳性率均高于对照组,其中以发作性PNH 组改变最为明显。表明调节性T 细胞的增多影响了PNH 克隆,继而影响PNH 造血微环境,使抑制性细胞因子如TGF-β 和IL-10 等水平升高,在受到异常抗原刺激时,扩增的调节性T细胞抑制效应T细胞,使PNH克隆可能逃避免疫监视而不被有效清除。
目前一般认为,PNH 克隆组成与白血病及其他肿瘤有相似的生物学特征,Hirai 等[16]认为,若阻断或抑制调节性T细胞功能可能治疗异常克隆性疾病。TGF-β 可以诱导FOXP3 的表达从而维持调节性T 细胞的抑制活性[17-18]。研究表明,TGF-β 的量和是否出现促炎症细胞因子决定了FOXP3 表达,同时决定了CD4+T 细胞是否成为调节性T 细胞的命运[19-20]。本研究结果显示,AA-PNH 组、发作性PNH组的 FOXP3 及 TGF-β 的 mRNA 表达阳性率和 TGF-β 及IL-10 的浓度均高于对照组,这表明PNH 患者体内FOXP3、TGF-β 及 IL-10 均呈高表达,即 CD4+T 细胞的免疫负调控在PNH 患者中增强,这有可能使PNH 克隆得以逃避免疫监视。提示在PNH 的发病过程中,免疫系统的异常使PNH 克隆增殖。
总之,本研究结果提示,PNH 患者调节性T 细胞数量增多,功能亢进,同时分泌 FOXP3、TGF-β 及 IL-10 细胞因子增多,提示调节性T 细胞的免疫抑制作用增强,可能在PNH异常克隆中起了逃避免疫监视的作用,但还需要加大病例数进一步验证结果。
利益冲突所有作者均声明不存在利益冲突
