白术多糖通过Toll样受体4/p38丝裂原活化蛋白激酶信号通路缓解脂多糖诱导的雏鹅法氏囊损伤
2022-11-15张冰琪李冰心杨保和袁明凤李婉雁许丹宁田允波陈文斌
张冰琪 李冰心 杨保和 袁明凤 李婉雁 曹 楠,4 许丹宁 田允波 陈文斌*
(1.仲恺农业工程学院动物科技学院,广州 510225;2.广东省水禽健康养殖重点实验室,广州 510225;3.云南快大多畜牧科技有限公司,玉溪 653100;4.湖南农业大学动物科技学院,长沙 410128)
法氏囊作为鸟类特有的中枢免疫器官,是一种与泄殖腔相连的盲憩室形式的肠道相关淋巴组织[1-2]。法氏囊腔通过一条狭窄的法氏囊管与泄殖腔相连,内部含有约10 000个淋巴囊泡[3]。法氏囊囊泡由皮质和髓质构成,囊泡内的微环境为B细胞的多样性及其分化、发育和成熟提供了独特的微环境[4-5]。因此,幼雏法氏囊在中枢和外周免疫系统中发挥主要作用[6]。如何提高幼雏免疫力一直是养殖业的研究重点之一。所以,探究雏鹅法氏囊的免疫调节机制具有非常重要的作用。
Toll样受体4(Toll like receptor 4,TLR4)作为一种典型的模型识别受体,广泛分布在树突状细胞、上皮细胞、血管内皮细胞及单核细胞等中,通过识别外源病原体而发挥重要作用[7-8]。例如在B淋巴细胞中,TLR4通过酪氨酸激酶对B细胞受体的信号转导参与免疫活动;在巨噬细胞中,TLR4识别病原体后,激活下游信号通路核因子-κB(NF-κB),介导免疫反应[9-10]。
脂多糖(lipopolysaccharides,LPS)是革兰氏阴性菌细胞外壁的主要成分,被机体免疫系统识别而发挥作用[11-12]。LPS的刺激能够促使禽类机体炎症的发生,造成机体免疫器官损伤,降低机体免疫水平[13-15]。LPS可以通过TLR4信号通路诱导促炎细胞因子肿瘤坏死因子-α(TNF-α)和白细胞介素-1β(IL-1β)的释放,刺激自由基表达,进而诱导机体损伤[16-17]。因此,LPS常被用于构建研究动物免疫应激模型。白术多糖(polysaccharide ofAtractylodesmacrocephalaKoidz,PAMK)作为传统中药“白术”的重要提取物,具有促进免疫器官的生长发育、维持机体细胞免疫、体液免疫以及黏膜免疫功能的相对稳定等功能[18-21]。本课题组之前的研究发现,PAMK可以通过TLR4-骨髓分化因子88(MyD88)-NF-κB信号通路缓解LPS诱导的小鼠肝炎,刺激小鼠脾脏中细胞因子分泌,从而提高机体免疫力[22-23]。同时,PAMK可以有效改善LPS诱导的雏鹅肠道菌群紊乱[24]。另外,前期试验发现PAMK还可以通过激活T淋巴细胞,维持体液和细胞免疫平衡,进而缓解环磷酰胺诱导的雏鹅免疫抑制[25-26]。除此之外,PAMK在热应激调节过程中也发挥重要作用。前期研究发现PAMK可以通过提高鸡脾脏中超氧化物歧化酶(SOD)和谷胱甘肽过氧化物酶(GPx)活性,降低丙二醛(MDA)含量,进而缓解热应激诱导的鸡脾脏损伤[27]。因此,本试验通过建立LPS诱导的雏鹅法氏囊损伤模型,以探究PAMK在LPS诱导雏鹅法氏囊损伤过程中对法氏囊内免疫细胞因子含量、TLR4信号通路相关基因表达及氧化应激相关指标的调节作用。
1 材料与方法
1.1 主要仪器
微孔板分光光度计(Epoch,BioTek Instruments,美国);全自动酶标仪(ELX800,博腾仪器公司,美国);分光光度计(UV-3100,MAPADA公司,中国);实时荧光定量PCR仪(7500,Life Technologies,美国);多功能梯度PCR仪(2720,Life Technologies,美国);全自动化学发光成像系统(上海天能科技有限公司,中国)。
1.2 主要药品和试剂
95% PAMK(西安某生物制剂厂,中国);注射用LPS(Sigma,美国);氧化应激指标测试盒(南京建成生物工程研究所,中国);预混型定量用反转录试剂盒(TaKaRa,中国);BCA蛋白浓度测定试剂盒(白鲨,中国);TLR4抗体(爱博泰克,中国);p38丝裂原活化蛋白激酶(p38 MAPK)抗体(Proteintech,美国);重组c-Jun氨基末端激酶(JNK)抗体(Abcam,英国);引物由上海生工生物工程有限公司合成。
1.3 试验设计及处理
选取1日龄雏鹅200只(雌雄各占1/2),随机分为4组,分别为对照组、LPS组、PAMK组及PAMK+LPS组,各组饲粮中PAMK含量分别为0、0、400和400 mg/kg。每组5个重复,每个重复10只。预试期3 d,正试期25 d。
在养殖期间保证马冈鹅自由饮水和进食,各组间饲养管理无差异性。LPS组和PAMK+LPS组雏鹅分别于24、26和28日龄腹腔注射浓度为2 mg/kg LPS,对照组和PAMK组分别注射等量生理盐水,28日龄注射1 h后,每组随机选取15只雏鹅采集法氏囊样品。小鹅基础饲粮组成及营养水平见表1,中鹅基础饲粮组成及营养水平见表2。
1.4 样品采集
在试验第25天,用药处理1 h后进行采样。每组随机选取3只雏鹅,采集法氏囊组织样品,保存于10%中性缓冲福尔马林中备用;每个重复随机选取2只雏鹅,采集法氏囊组织样品进行称重,组织样保存于-80 ℃备用。
1.5 法氏囊重量测定
在试验第25天,取新鲜雏鹅的法氏囊器官,用生理盐水冲洗2~3次,然后用滤纸擦干表面,进行称重。
1.6 法氏囊组织学观察
法氏囊于10%中性缓冲福尔马林中固定48 h后,石蜡包埋,切割成5 μm切片,苏木精-伊红(HE)染色。光学显微镜镜检,采用CaseViewer软件采集图像,分别于200×和400×放大倍数下观察法氏囊组织结构。
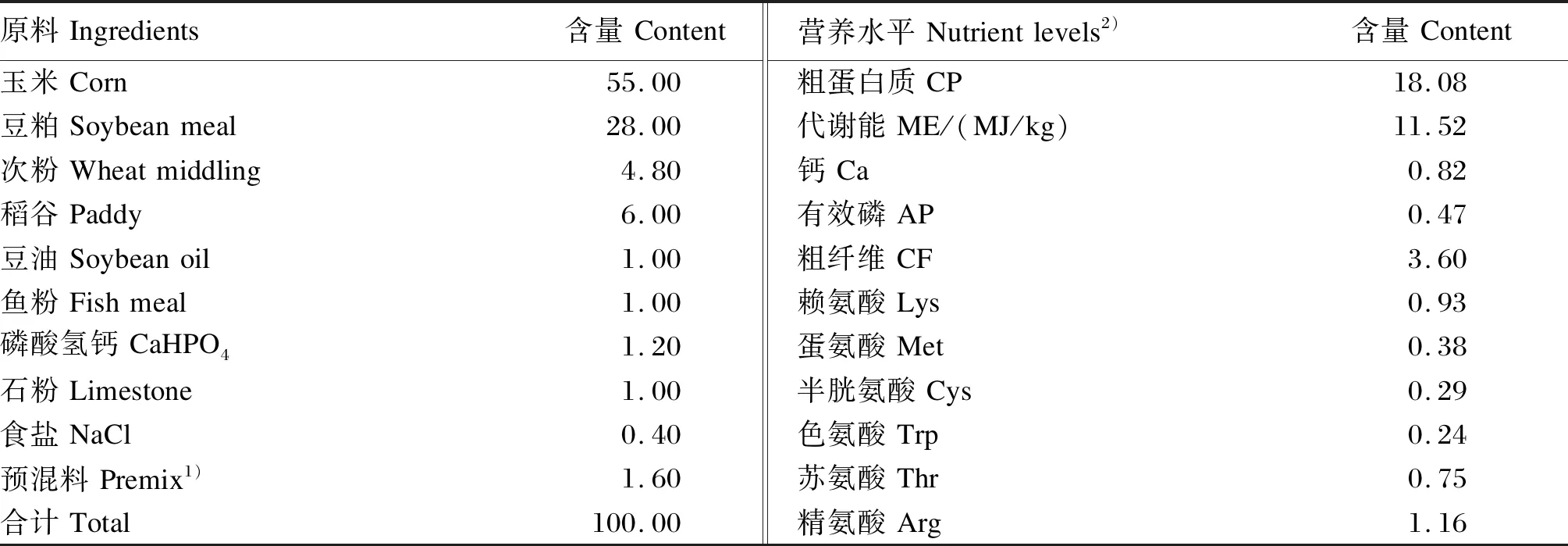
表1 小鹅基础饲粮组成及营养水平(风干基础)Table 1 Composition and nutrient levels of the basal diet for goslings (air-dry basis) %

表2 中鹅基础饲粮组成及营养水平(风干基础)Table 2 Composition and nutrient levels of the basal diet for medium geese (air-dry basis) %
1.7 实时荧光定量PCR检测
运用Trizol试剂提取各组雏鹅法氏囊中的总RNA。分光光度计检测总RNA质量,然后运用TaKaRa反转录试剂盒将各样品总RNA反转录成cDNA。采用SYBR Green Master Mix PCR试剂盒进行实时荧光定量PCR检测,反应体系为20 μL:SYBR Green Master Mix 10 μL、RNase Free dH2O 7 μL、上下游引物各1 μL、cDNA 1 μL。反应程序:95 ℃预变性5 min,1个循环;95 ℃变性30 s,60 ℃退火30 s,72 ℃延伸30 s,40个循环;72 ℃延伸10 min,1个循环。内参基因为β-肌动蛋白(β-actin),所用引物序列见表3。每个样本分别同时做目的基因和内参基因,均做3个重复以消除加样误差,记录各基因扩增所需的Ct值,采用2-ΔΔCt法计算目的基因相对表达量。

表3 实时荧光定量PCR引物序列Table 3 Primer sequences for RT-qPCR
1.8 Western blot检测
采用组织快速裂解缓冲液提取各组雏鹅法氏囊组织中的总蛋白,随后运用BCA蛋白浓度测定试剂盒检测各组样品蛋白浓度。十二烷基硫酸钠聚丙烯酰胺凝胶电泳(SDS-PAGE)分离蛋白,随后将样品转移到聚偏二氟乙烯(PVDF)膜上,5%的脱脂奶粉中封闭2 h后,分别4 ℃孵育TLR4(1∶2 000)、p38 MAPK(1∶2 000)、JNK(1∶1 000)一抗过夜,二抗孵育1 h后,使用全自动化学发光成像系统进行蛋白表达量检测,并通过Image J软件进行量化分析。
1.9 氧化应激指标检测
每0.1 g法氏囊组织加0.9 mL磷酸盐缓冲液(PBS),破碎仪破碎后,2 000×g离心5 min后取上清待用。使用试剂盒(南京建成生物工程研究所)检测组织上清中超氧化物歧化酶(SOD)活性和总抗氧化能力(T-AOC)。
1.10 数据分析
数据采用SPSS 26.0软件进行单因素方差分析,随后用Tukey法进行多重比较。数据以平均值和均值标准误表示。GraphPad Prism 5.0被用来将数据可视化。P<0.05代表统计分析差异具有显著性。
2 结 果
2.1 PAMK可以缓解LPS诱导的雏鹅法氏囊损伤
形态学观察显示,与LPS组相比,PAMK+LPS组的法氏囊器官大小明显上升(图1-A);称量结果显示,LPS组的法氏囊重量显著低于对照组(P<0.05),添加PAMK后,法氏囊重量明显上调,但与LPS组相比没有显著差异(P>0.05)(图1-B)。
组织学观察结果显示,LPS组法氏囊囊泡排列紊乱,囊内出现大量空泡。另外,与对照组和PAMK组相比,LPS组囊泡的皮质面积与髓质面积比显著降低(P<0.05)。同时,与LPS组相比,PAMK+LPS组的法氏囊形态学变化明显,主要体现在囊泡内细胞整齐、囊泡内空泡数量明显降低及囊泡的皮质面积与髓质面积比升高(图1-C,图1-D)。
2.2 PAMK可以缓解LPS诱导雏鹅法氏囊中细胞因子mRNA表达上调
LPS组细胞因子的mRNA相对表达量均不同程度高于对照组,其中IL-6、IL-1β和TNF-αmRNA相对表达量均显著高于对照组(P<0.05)。PAMK+LPS组IL-10、IL-6、IL-1β和TNF-α的mRNA相对表达量均显著低于LPS组(P<0.05)。PAMK组IL-6、IL-10和TNF-αmRNA相对表达量显著低于对照组(P<0.05)(图2)。
2.3 PAMK可以缓解LPS诱导的雏鹅法氏囊中TLR4信号通路激活
实时荧光定量PCR检测结果显示,LPS组法氏囊TLR4信号通路中TLR4、TRAF6、IKKε、IκBα和JNK的mRNA相对表达量均显著高对照组(P<0.05)。PAMK+LPS组中TLR4、MyD88、p38MAPK和IκBα的mRNA相对表达量均显著低于LPS组(P<0.05)(图3)。
Western blot检测结果显示,LPS组TLR4和JNK的蛋白表达量显著高于对照组(P<0.05),p38 MAPK的蛋白表达量也一定程度上调,但是差异不显著(P>0.05)。同时,与LPS组相比,添加PAMK能显著降低法氏囊内TLR4和p38 MAPK的蛋白表达量(P<0.05)(图4)。
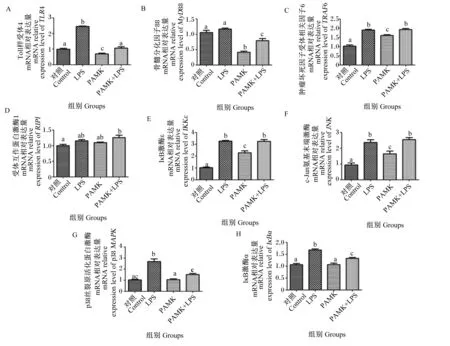
图3 PAMK对LPS诱导的雏鹅法氏囊TLR4信号通路及其相关基因mRNA相对表达量的影响Fig.3 Effects of PAMK on mRNA relative expression levels of TLR4 signaling pathway and related genes of bursa of Fabricius in goslings induced by LPS
2.4 PAMK对LPS诱导的法氏囊氧化应激指标的影响
检测结果显示,与对照组和PAMK组相比,LPS组法氏囊T-AOC和SOD活性均显著降低(P<0.05)(图5)。PAMK可以显著缓解LPS诱导的SOD活性降低(P<0.05);同时,与对照组相比,PAMK组SOD活性也显著升高(P<0.05)。
3 讨 论
研究发现,多种多糖都可不同程度提高免疫器官指数,增强其免疫能力,一般认为,免疫器官重量增加意味着机体免疫机能提高[28-31]。本研究发现,PAMK可以有效缓解LPS诱导雏鹅法氏囊重量降低。此外,本试验发现,LPS可以导致雏鹅法氏囊小结结构疏松,排列紊乱,出现大量细胞空泡,髓质区面积相对增大,皮质区面积相对减小。这将诱导B细胞输出减少,法氏囊免疫功能降低[32]。值得注意的是,PAMK可以有效缓解LPS诱导的法氏囊组织结构损伤。这说明PAMK有助于维持雏鹅的免疫能力。

图4 PAMK对LPS诱导的雏鹅法氏囊TLR4信号通路及其相关基因的蛋白表达量的影响Fig.4 Effects of PAMK on protein expression of TLR4 signaling pathway and related genes ofbursa of Fabricius in goslings induced by LPS
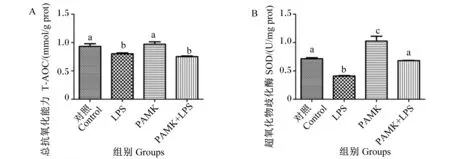
图5 PAMK对LPS诱导的雏鹅法氏囊氧化应激指标的影响Fig.5 Effects of PAMK on oxidative stress indexes of bursa of Fabricius in goslings induced by LPS
TLR4是在免疫细胞表面上的重要自然免疫受体之一,在炎症发生以及免疫系统激活中发挥重要作用[33-34]。LPS作为TLR4的特异性刺激剂,可通过激活TLR4信号通路调节促炎细胞因子的表达。本试验结果显示,LPS组雏鹅法氏囊中TLR4及其通路相关基因的表达均高于对照组;PAMK可以有效缓解LPS诱导的TLR4 mRNA相对表达量上调,进而调节下游基因p38MAPK的mRNA相对表达量。同时,本试验发现,PAMK可以显著缓解LPS诱导IL-1β、IL-6和TNF-α的mRNA相对表达量的上升。众所周知,IL-1β是一种有效的促炎细胞因子,IL-1β的释放代表着炎性反应的发生[35-36]。IL-6作为一种典型的维持体内平衡的细胞因子,在机体被感染或发生损伤时会大量释放参与免疫调控[37-38]。同时,作为免疫反应的关键调节因子之一,TNF-α在炎症以及其他疾病的刺激下也能通过介导细胞存活和细胞死亡的途径影响免疫系统的发育和正常功能[39-40]。上述结果表明,PAMK可能通过TLR4信号通路缓解LPS诱导雏鹅法氏囊的炎性细胞因子mRNA相对表达量上升。
值得注意的是,LPS介导的炎症发生会诱导促炎细胞因子表达量上升,产生过量的自由基以引发氧化应激,从而诱导机体产生损伤[41-43]。前期研究发现,PAMK可以调节雏鹅肝脏组织中MDA含量、SOD和谷胱甘肽过氧化物酶活性等抗氧化指标的变化[44]。但是,关于PAMK对雏鹅法氏囊氧化应激的研究尚未见报道。本试验法氏囊氧化应激指标检测结果显示,LPS显著抑制了法氏囊中SOD的活性。同时,与LPS组相比,PAMK单独或与LPS共同作用都能显著提高法氏囊中SOD活性。SOD作为生物体抗氧化水平的重要指标之一,可以通过多种机制清除自由基以达到抗氧化目的[45-46]。这表明PAMK对LPS诱导的雏鹅法氏囊氧化应激也有一定的缓解作用。
4 结 论
综上所述,PAMK是通过TLR4/p38 MAPK信号通路调节IL-1β、IL-6和TNF-α的表达,以减轻LPS诱导的雏鹅法氏囊损伤,维持法氏囊组织结构的完整性,从而提高雏鹅法氏囊的免疫应答能力。
