大豆活性肽对体外过氧化氢诱导的奶牛乳腺上皮细胞氧化应激和炎症损伤的缓解作用
2022-11-15张一涵蒋林树
陈 逸 张一涵 张 静 屠 焰 王 慧* 蒋林树*
(1.北京农学院动物科学技术学院,奶牛营养学北京市重点实验室,北京 102206;2.中国农业科学院饲料研究所,北京 100081)
动物从健康状态发展到疾病状态是一个由量变到质变的动态过程,在生产过程中,受到饲粮、管理、环境等因素的影响,容易导致动物体内自由基稳态失衡,引起机体氧化应激,受其主导的氧化应激-免疫应激-炎症反应三方联动效应会导致动物转变为亚健康态[1],使奶牛机体对疾病的易感性增加,干预不当则易患乳腺炎等炎症[2]。炎症过程常又会伴随氧化应激的发生,通过氧化加剧炎症反应,而炎症介质又反过来加重氧化应激,形成恶性联动循环[1],进一步影响机体免疫功能,引起机体损伤,严重影响机体健康和泌乳性能[3]。
奶牛健康是奶业持续稳定发展中的重要环节。生产中,乳腺上皮细胞是有害物质侵入乳腺时的第1道防线,受到泌乳期间高强度的代谢需求的影响,机体氧化状态增强,奶牛乳腺上皮细胞通透性增加,便于大分子和病原体的通过,引起炎症反应和疾病,最终导致奶牛免疫功能下降,引发乳房炎[3-4],给养殖业造成了巨大的经济损失。为缓解氧化应激对奶牛乳腺健康的影响,研究缓解奶牛乳腺上皮细胞氧化损伤的方法成为亟待解决的问题之一。
大豆是世界上最重要的豆类作物,来源广泛,其富含的大豆蛋白是优质植物性蛋白的主要来源之一[5]。大豆蛋白酶解得到的大豆活性肽(SBP)具有调节免疫、抗氧化、抗炎等作用[6-7],其作用效果已在猪[8]、鸡[9]及鱼类[10]的生产养殖实践中得以证实,但SBP在反刍动物上的研究尚不充分。因此,本研究在建立奶牛乳腺上皮细胞氧化应激模型的基础上,采用SBP对细胞进行预处理,探究SBP对过氧化氢(H2O2)诱导的细胞氧化应激和炎症损伤的保护作用,为SBP作为天然性抗氧化物质在奶牛养殖中的应用提供理论依据。
1 材料与方法
1.1 试验材料
奶牛乳腺上皮细胞MAC-T由东北农业大学动物生物化学与分子生物学实验室馈赠。SBP由本实验室按照Agyei等[11]提出的方法制备并保存,SBP含量≥90%。30% H2O2购自天津市光复科技发展有限公司。DMEM培养基、F12培养基、胎牛血清(FBS)、0.25%胰蛋白酶-乙二胺四乙酸(EDTA)及青-链霉素溶液均购自Gibco公司,磷酸盐缓冲溶液(PBS)购自北京索莱宝生物科技有限公司。CCK-8细胞增殖-细胞毒性检测试剂盒购自上海东仁化学科技有限公司。丙二醛(MDA)、总超氧化物歧化酶(T-SOD)、谷胱甘肽过氧化物酶(GSH-Px)、过氧化氢酶(CAT)、总抗氧化能力(T-AOC)试剂盒购于南京建成生物工程研究所。SteadyPure通用型RNA提取试剂盒购自湖南艾科瑞生物科技公司。cDNA反转录试剂盒及TB GreenTMPremix Ex Taq Ⅱ购自日本TaKaRa公司。活性氧(ROS)检测试剂盒、细胞裂解液购自碧云天生物技术有限公司。基因引物由北京擎科生物科技有限公司合成,纯度方式为聚丙烯酰胺凝胶电泳(PAGE)。
1.2 细胞培养基及溶液的配制
细胞基础培养基配制:将DMEM培养基和F12培养基以1∶1的比例混合均匀,4 ℃备用。
细胞DMEM/F12完全培养基配制:将DMEM培养基、F12培养基、FBS、青-链霉素溶液以89∶189∶120∶12的比例混合均匀,4 ℃备用。
不同浓度H2O2溶液的配制:30% H2O2浓度约为9 mol/L。将30% H2O2与高压灭菌超纯水以1∶18比例混合,即得到浓度为1 mol/L的H2O2储备液。随后将1 mol/L的H2O2储备液用细胞基础培养基稀释为0、300、600、900、1 200 μmol/L,作为不同浓度的H2O2诱导培养基使用。
SBP溶液的配制:将SBP以高压灭菌超纯水溶解成10 mg/mL SBP母液,0.22 μm滤膜过滤。10 mg/mL SBP母液用细胞基础培养基稀释至0、0.15、0.30、0.60、1.20、2.40和4.8 mg/mL,作为工作溶液使用,现用现配。
1.3 试验方法
1.3.1 细胞复苏与传代
将MAC-T细胞从液氮罐中取出,迅速置于提前预热的37 ℃水浴锅中,轻摇使其在1 min内解冻,转移至加有6 mL DMEM/F12完全培养基的离心管中,3 000 r/min离心4 min后,弃上清。细胞沉淀以1 mL完全培养基重悬后转移至含有8 mL DMEM/F12完全培养基的10 cm培养皿中,混匀。培养皿置于37 ℃、5% CO2恒温培养箱中复苏培养,24 h时换液,当细胞生长至汇合度≥80%时,弃去皿中培养基,以4 ℃预冷的PBS清洗细胞2次,加入0.25%胰蛋白酶-EDTA 2 mL,37 ℃孵育2~3 min以消化细胞。孵育结束后在倒置显微镜下观察细胞,待大部分细胞完全消化后加入4 mL DMEM/F12完全培养基终止消化,轻轻吹打细胞,并转移至15 mL离心管中,3 000 r/min离心4 min,弃上清。细胞沉淀以适量DMEM/F12完全培养基重悬混匀后进行细胞计数。根据细胞浓度转移至新的培养皿中,进行细胞传代。
1.3.2 MAC-T细胞氧化应激模型的建立
MAC-T细胞氧化应激模型的建立参照金鹿等[12]的方法进行。取传代至3~5代、生长到对数生长期的细胞,以1×104个/孔的密度接种于96孔板中,37 ℃、5% CO2恒温培养箱中培养至汇合度≥80%,弃去完全培养基,于基础培养基中饥饿培养12~16 h。饥饿培养后的细胞以PBS清洗2次,加入不同浓度[0(对照)、300、600、900、1 200 μmol/L]的H2O2诱导培养基,分别处理12和24 h,收集细胞培养液。以CCK-8法检测细胞存活率,ROS检测试剂盒检测ROS水平,MDA、T-SOD、GSH-Px、CAT、T-AOC试剂盒检测相应抗氧化指标。每组设置6个重复孔,重复测定3次。
1.3.3 SBP适宜作用浓度和作用时间筛选
将培养至对数生长期的MAC-T细胞以1×104个/孔的密度接种于96孔板中,待细胞汇合度≥80%时,弃去完全培养基,以PBS清洗细胞2次,加入以细胞基础培养基稀释至SBP浓度为0(对照)、0.15、0.30、0.60、1.20、2.40和4.80 mg/mL,分别处理6和12 h。CCK-8法检测细胞存活率,计算后确定SBP适宜作用浓度和作用时间。每组设置6个重复孔,重复测定3次。
1.3.4 SBP预处理对细胞氧化应激损伤的保护作用试验分组
将培养至对数生长期的MAC-T细胞分为3组:对照组、H2O2模型组、SBP处理组。其中对照组用细胞基础培养基培养6 h后,换新鲜的细胞基础培养基继续培养12 h;H2O2模型组先用细胞基础培养基培养6 h,再用含有600 μmol/L H2O2的诱导培养基处理12 h;SBP处理组是先用含0.15、0.30、0.60 mg/mL SBP的细胞基础培养基预处理细胞6 h后,再用含有600 μmol/L H2O2的诱导培养基处理12 h。每组设置6个重复孔,重复测定3次。
1.3.5 CCK-8法检测细胞存活率
将细胞从CO2恒温培养箱中取出后,弃细胞处理液,用PBS冲洗2次,加入100 μL检测液(90 μL细胞基础培养基+10 μL CCK-8),37 ℃、5% CO2恒温培养箱中孵育4 h,酶标仪测定450 nm处的吸光度(OD450)。设定对照组细胞存活率为100%,并按照公式计算各试验组细胞存活率。
细胞存活率(%)=(各试验组平均OD值/对照组平均OD值)×100。
1.3.6 细胞内ROS水平测定
细胞内ROS水平采用ROS检测试剂盒测定。按照试剂盒说明书,在细胞中加入10 μmol/L 2′,7′-二氯二氢荧光素二乙酸酯(DCFH-DA)稀释液,37 ℃恒温培养箱中孵育20 min后,用细胞基础培养基清洗细胞并将其重新悬浮在PBS中,用流式细胞仪对细胞中荧光强度进行检测,用以反映ROS水平。
1.3.7 细胞内抗氧化指标测定
取生长至对数生长期的细胞,用0.25%胰蛋白酶-EDTA消化细胞后,迅速用细胞完全培养基终止消化,2 000 r/min离心5 min,用血球计数板对细胞悬液进行计数,调整细胞密度为2.5×106个/mL,将调整好密度的细胞以1 mL/孔接种于6孔板中,37 ℃、5% CO2恒温培养箱中培养,待细胞汇合度≥80%时,弃去细胞完全培养基,PBS清洗2次后,对细胞按照各组不同处理条件进行处理。进行不同处理后的细胞培养液弃去,以预冷PBS冲洗细胞2次后,再加入1 mL预冷PBS收集用细胞刮刮取的细胞,将收集的细胞吸入1.5 mL离心管中,以1 000 r/min离心10 min,弃掉PBS,加入含终浓度为1 mmol/L PMSF的裂解液0.2 mL,轻柔吹打使细胞充分裂解,14 000 r/min离心5 min,取上清液依据试剂盒说明书对细胞内GSH-Px、CAT、T-SOD活性及T-AOC和MDA含量进行测定。
1.3.8 细胞内炎症相关基因表达检测
收集6孔板中的细胞,按照总RNA提取试剂盒说明书提取RNA,并用cDNA反转录试剂盒合成cDNA。以甘油醛-3-磷酸脱氢酶(GAPDH)为内参基因,采用荧光定量PCR法检测炎症相关基因诱导型一氧化氮合酶(iNOS)、环氧化酶-2(COX-2)、单核细胞趋化蛋白-1(MCP-1)、白细胞介素-1β(IL-1β)、肿瘤坏死因子-α(TNF-α)、白细胞介素-6(IL-6)及白细胞介素-8(IL-8)的mRNA相对表达水平。
荧光定量PCR采用2步法,反应条件为:95 ℃延伸5 s,60 ℃退火30 s,40个循环。基因的引物序列见表1,由北京擎科生物科技有限公司合成。
1.4 统计分析
试验数据经Excel 2013初步整理后,采用SPSS 20.0软件进行单因素方差分析(one-way ANOVA),各组间用Duncan氏法进行多重比较,试验结果用平均值±标准误(mean±SE)表示,P<0.05表示差异显著,P<0.01表示差异极显著。
2 结果与分析
2.1 H2O2诱导的MAC-T细胞氧化应激模型的建立
2.1.1 H2O2对MAC-T细胞存活率的影响
不同浓度(300、600、900、1 200 μmol/L)的H2O2在体外作用于MAC-T细胞12和24 h后,对细胞存活率的影响结果如图1所示。结果显示,与对照组相比,300 μmol/L H2O2刺激细胞12 h对细胞存活率无显著影响(P>0.05),刺激24 h后细胞存活率仍在对照组的96%以上;600、900、1 200 μmol/L H2O2分别刺激MAC-T细胞12和24h后均极显著降低了细胞存活率(P<0.01),600、900、1 200 μmol/L H2O2刺激细胞12 h后其细胞存活率分别为对照组的80.0%、78.3%、74.9%,刺激细胞24 h后其细胞存活率分别为对照组的60.9%、54.9%和45.9%。由以上结果可知,H2O2对MAC-T细胞存活率呈剂量和时间依赖性抑制。

表1 基因的引物序列Table 1 Primer sequences of genes
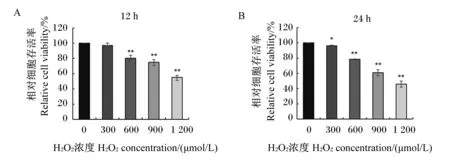
数据柱标注“*”表示与对照组(0 μmol/L H2O2)相比差异显著(P<0.05),数据柱标注“**”表示与对照组相比差异极显著(P<0.01)。图2至图4同。Compared with the control group (0 μmol/L H2O2), data columns with “*” represented significant difference (P<0.05), and with “**” represented extremely significant difference (P<0.01). The same as Fig.2 to Fig.4.图1 H2O2对MAC-T细胞存活率的影响Fig.1 Effects of H2O2 on viability of MAC-T cells
2.1.2 H2O2对MAC-T细胞内ROS水平的影响
高浓度H2O2对细胞存活率的抑制作用表明细胞处于氧化应激状态下时会在一定程度上诱发细胞损伤,因此,本研究对体外条件下不同浓度H2O2处理下细胞内ROS水平进行了检测,结果如图2所示。结果显示,与对照组相比,不同浓度(300、600、900、1 200 μmol/L)的H2O2分别刺激细胞12和24 h均极显著提高了细胞内ROS水平(P<0.01),且600 μmol/L H2O2组细胞内ROS水平约为对照组的3倍。结合H2O2对细胞存活率的影响,以600 μmol/L H2O2作为建立细胞氧化应激模型的作用浓度。

图2 H2O2对MAC-T细胞内ROS水平的影响Fig.2 Effects of H2O2 on ROS level in MAC-T cells
2.1.3 H2O2对MAC-T细胞内抗氧化指标的影响
以600 μmol/L H2O2对MAC-T细胞分别体外处理12和24 h,细胞内抗氧化指标的变化结果如图3所示。结果显示,与对照组相比,600 μmol/L H2O2刺激细胞12和24 h均可极显著降低细胞内GSH-Px、CAT、T-SOD活性(P<0.01),极显著提高细胞内MDA含量(P<0.01),且刺激12 h比刺激24 h作用效果明显;但T-AOC只在600 μmol/L H2O2刺激细胞12 h时极显著降低(P<0.01),而在H2O2刺激细胞24 h时无显著变化(P>0.05)。综合以上结果,后续选择600 μmol/L H2O2刺激MAC-T细胞12 h作为细胞体外条件下产生氧化应激的条件。
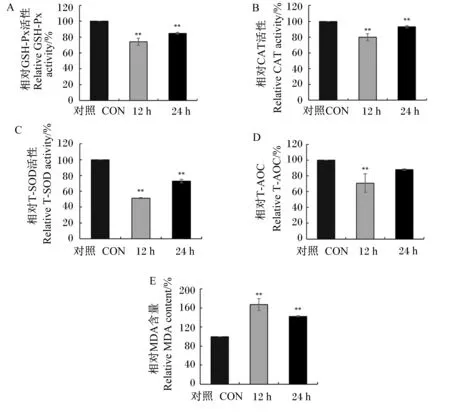
图3 H2O2对MAC-T细胞内抗氧化指标的影响Fig.3 Effects of H2O2 on antioxidant indexes in MAC-T cells
2.2 SBP对MAC-T细胞存活率的影响
为确定SBP在体外作用于MAC-T细胞的安全剂量和适宜作用时间,以不同浓度SBP分别作用MAC-T细胞6和12 h,CCK-8试剂盒检测SBP对MAC-T细胞存活率的影响,结果如图4所示。结果显示,与对照组相比,以浓度为0.15和0.30 mg/mL的SBP处理6 h可极显著提高细胞存活率(P<0.01);而当处理12 h时,0.15 mg/mL的SBP对细胞存活率无显著影响(P>0.05),0.30 mg/mL的SBP虽对细胞存活率有显著影响(P<0.05),但仍为对照组的96.0%。将SBP浓度升高至0.60 mg/mL处理细胞6 h时,对细胞存活率无显著影响(P>0.05),但处理12 h时,细胞存活率下降为对照组的92.1%,极显著降低了细胞存活率(P<0.01)。以浓度为1.20、2.40和4.80 mg/mL的SBP处理6 h,虽与对照组相比细胞存活率极显著降低(P<0.01),但仍为对照组的90%以上,而当以同浓度的SBP处理12 h时,细胞存活率仅分别为对照组的77.0%、60.1%和48.0%,极显著降低了细胞存活率(P<0.01)。综合以上结果,后续试验选择以浓度为0.15、0.30和0.60 mg/mL的SBP在体外对MAC-T细胞处理6 h进行预保护。
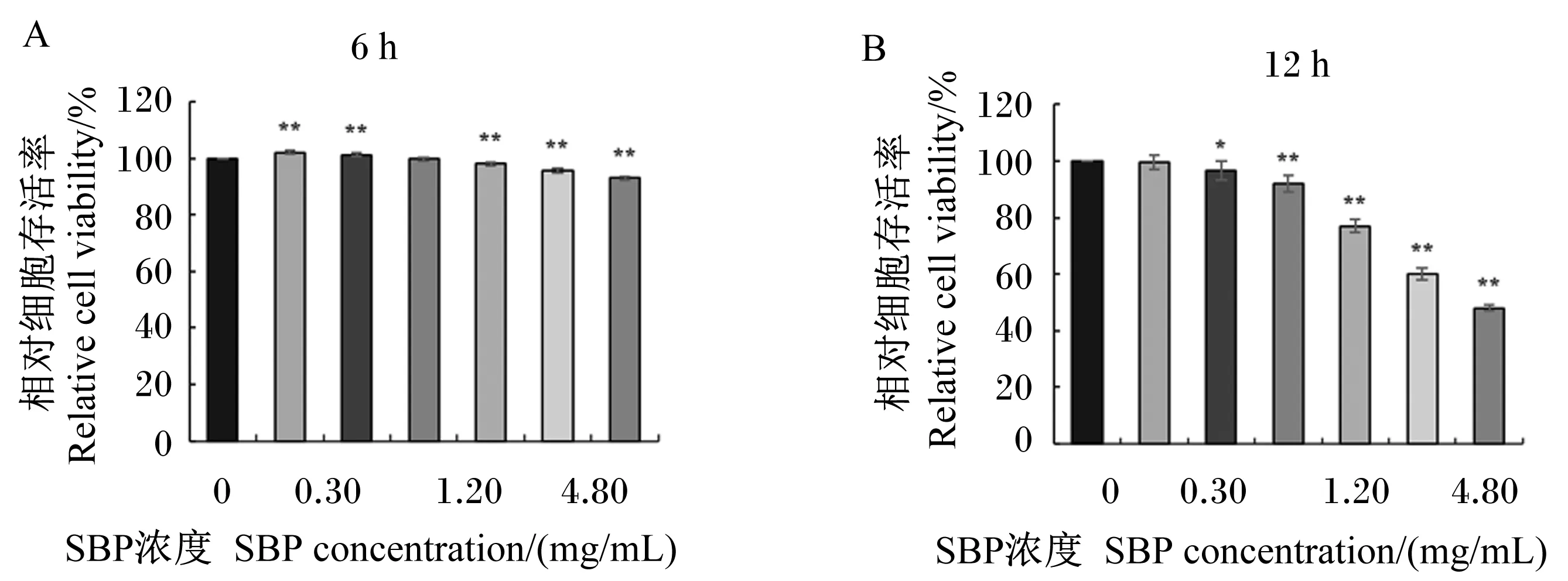
图4 SBP对MAC-T细胞存活率的影响Fig.4 Effects of SBP on viability of MAC-T cells
2.3 SBP对H2O2诱导的MAC-T细胞氧化损伤的缓解作用
2.3.1 SBP对H2O2诱导的MAC-T细胞内ROS水平的影响
不同浓度SBP在体外对H2O2诱导的MAC-T细胞内ROS水平的影响如图5所示。结果显示,与H2O2模型组相比,0.15、0.30和0.60 mg/mL SBP对细胞预处理后均极显著降低了细胞内ROS水平(P<0.01),且SBP对H2O2诱导的细胞氧化损伤的缓解作用呈剂量依赖性。以上结果表明,SBP在体外对H2O2诱导的细胞氧化损伤具有保护作用,可一定程度上逆转H2O2诱导的细胞氧化损伤。
2.3.2 SBP对H2O2诱导的MAC-T细胞内抗氧化指标的影响
不同浓度SBP在体外对H2O2诱导的MAC-T细胞内抗氧化指标的影响如图6所示。结果显示,与H2O2模型组相比,0.15、0.30和0.60 mg/mL SBP对细胞预处理后极显著提高了氧化损伤细胞内GSH-Px、CAT、T-SOD活性(P<0.01),显著或极显著提高了T-AOC(P<0.05或P<0.01),极显著降低了MDA含量(P<0.01)。以上结果表明,SBP在体外可提高细胞抗氧化酶活性,缓解H2O2诱导的MAC-T细胞氧化应激。
2.3.3 SBP对H2O2诱导的MAC-T细胞内炎症相关基因表达的影响
为验证细胞处于氧化应激状态下时是否会同时诱导细胞炎症的发生,本研究对细胞炎症介质和炎症因子的mRNA相对表达水平进行了检测,如图7所示。结果显示,与对照组相比,H2O2模型组细胞内炎症介质(COX-2、iNOS、MCP-1)和促炎因子(TNF-α、IL-6、IL-8和IL-1β)mRNA的相对表达水平均极显著提高(P<0.01)。与H2O2模型组相比,0.15、0.30和0.60 mg/mL SBP对细胞预处理后均极显著降低了细胞内炎症介质(COX-2、iNOS、MCP-1)和促炎因子(TNF-α、IL-6、IL-8、IL-1β)mRNA的相对表达水平(P<0.01)。以上结果表明,在体外,H2O2诱导的MAC-T细胞氧化应激可通过提高炎症介质和炎症因子的表达水平,引发炎症反应;而SBP预处理则可通过降低炎症介质和炎症因子的表达水平,缓解由氧化应激诱发的细胞炎症损伤。
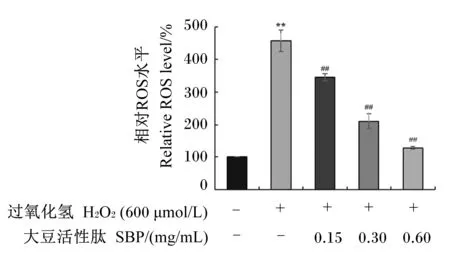
数据柱标注“*”表示与对照组(0 μmol/L H2O2+0 mg/mL SBP)相比差异显著(P<0.05),数据柱标注“**”表示与对照组相比差异极显著(P<0.01)。数据柱标注“#”表示与H2O2模型组(600 μmol/L H2O2+0 mg/mL SBP)相比差异显著(P<0.05),数据柱标注“##”表示与H2O2模型组相比差异极显著(P<0.01)。图6和图7同。Compared with the control group (0 μmol/L H2O2+0 mg/mL SBP), data columns with “*” represented significant difference (P<0.05), and with “**” represented extremely significant difference (P<0.01). Compared with the H2O2 model group (600 μmol/L H2O2+0 mg/mL SBP), data columns with “#” represented significant difference (P<0.05), and with “##” represented extremely significant difference (P<0.01). The same as Fig.6 and Fig.7.图5 SBP对H2O2诱导的MAC-T细胞内ROS水平的影响Fig.5 Effects of SBP on ROS level in MAC-T cells induced by H2O2
3 讨 论
正常生理情况下,动物机体内自由基的产生、清除、利用等活动能在严格地调控下维持动态平衡,一旦平衡被打破,就会导致氧化应激,影响到基因的转录、细胞信号的传导、器官的功能以及细胞的增殖、分化、凋亡和坏死等许多生理和病理过程,导致疾病的发生和发展[1,13]。研究发现,体内内源的抗氧化酶SOD、CAT、GSH-Px等组成的酶类抗氧化系统是机体内的初级抗氧化防御系统,可将氧自由基代谢为水,减少H2O2、脂质和磷脂氢过氧化物侵害,抵抗ROS积累产生的有害影响[14-15]。MDA是脂质过氧化物代谢产物,其含量反映机体内脂质过氧化程度,间接反映细胞的损伤程度,T-AOC则可反映清除自由基的能力,该类酶抗氧化剂对于炎症性疾病期间防御氧化性细胞损伤至关重要[16]。
H2O2作为一种重要的ROS,极易透过细胞膜与细胞内铁离子通过芬顿(Fenton)反应形成高活性的自由基,导致一系列反应,因其易于获得且性质相对稳定,已成为研究细胞氧化损伤的重要工具[12,17],本研究中也利用H2O2成功构建了MAC-T细胞氧化应激模型。
SBP具有较强的抗氧化活性[10,18]。Yi等[19]研究表明,SBP可抑制H2O2诱导的HepG2细胞ROS的生成及谷胱甘肽(GSH)含量的减少,并能提高细胞内抗氧化酶的活性。曾松荣等[18]研究显示,大豆肽可显著提高小鼠血清溶菌酶活性和抗菌活力,显著提高CAT活性,降低MDA含量。本研究中,0.15、0.30和0.60 mg/mL SBP极显著降低了MAC-T细胞内ROS水平,极显著提高了GSH-Px、CAT、T-SOD活性和T-AOC,极显著降低了MDA含量,说明适宜浓度的SBP能有效缓解H2O2对细胞的氧化损伤,提高奶牛乳腺上皮细胞的抗氧化能力,与前人文献报道结果一致。
乳腺上皮细胞除了具有泌乳功能以外,也能表达多种模式识别受体,从而诱导多种炎症介质的释放[20-21]。氧化应激状态下,细胞内可分泌IL-1β、IL-6、TNF-α等促炎因子[22-23],还可提高氧化损伤细胞中TNF-α的表达水平[23-24],TNF-α与IL-1β协同作用,进而刺激二级细胞因子IL-6的分泌和表达[23,25],IL-8是趋化因子,可趋化多形核白细胞(PMN)向炎症部位游出,参与局部的免疫反应,与细胞应激之间存在正相关[26]。研究表明,炎症因子的产生可直接造成细胞损伤,IL-1β、TNF-α水平的提高可引起奶牛乳腺上皮细胞间紧密连接通透性增高,抑制上皮细胞间紧密连接蛋白之一闭锁小带蛋白-1(ZO-1)的产生[23,27]。

4 结 论
在H2O2诱导体外MAC-T细胞氧化应激模型基础上,SBP可降低细胞内ROS水平,提高GSH-Px、CAT、T-SOD活性和T-AOC,降低MDA含量,抑制炎症相关基因iNOS、COX-2、MCP-1、TNF-α、IL-6、IL-8及IL-1β的表达,从而缓解H2O2诱导的MAC-T细胞氧化应激和炎症损伤。
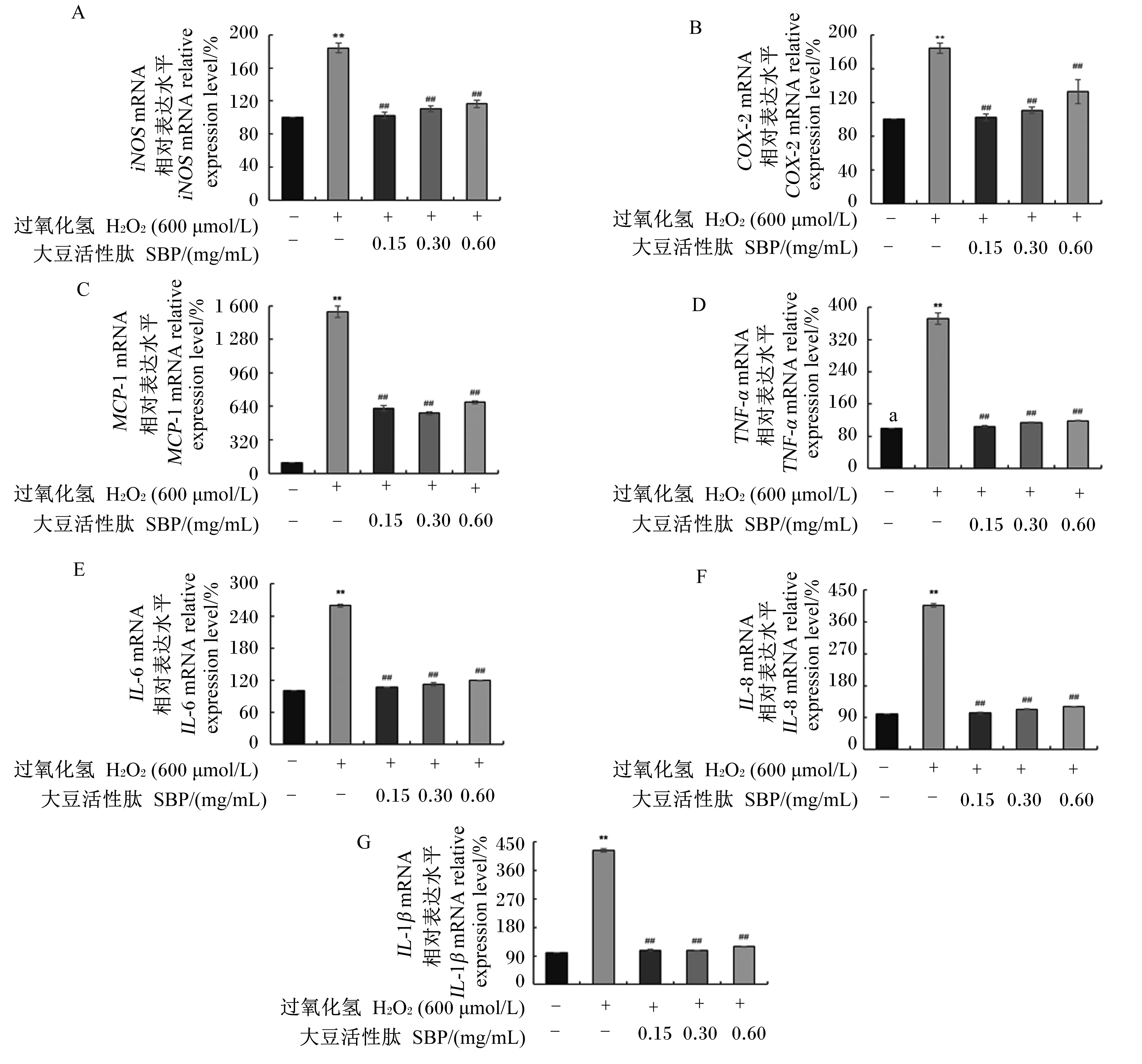
图7 SBP对H2O2诱导的MAC-T细胞内炎症相关基因表达的影响Fig.7 Effects of SBP on expression of genes related to inflammation in MAC-T cells induced by H2O2
