氧化锌对感染猪流行性腹泻病毒的新生阶段仔猪生长性能、肠道屏障功能和抗氧化能力的影响
2022-11-15王思甜郑丽云刘志鹏郭双双侯永清张正帆丁斌鹰
王思甜 郑丽云 齐 雅 刘志鹏 郭双双 侯永清 张正帆 丁斌鹰
(武汉轻工大学动物营养与饲料科学湖北省重点实验室,武汉 430023)
猪流行性腹泻病毒(porcine epidemic diarrhea virus,PEDV)是引起猪流行性腹泻(porcine epidemic diarrhea,PED)的病原,可引起新生仔猪呕吐、腹泻和脱水,感染后死亡率接近100%[1]。目前,我国养猪业正处于从散养到集约化迅速转变的阶段,商品猪运输流通更加频繁,为PEDV的传播和变异制造了更加有利的条件,给我国养殖业带来潜在威胁[1]。高剂量(2 000~3 000 mg/kg)氧化锌(ZnO)可降低断奶14 d内仔猪的腹泻率[2]。高锌主要通过抑菌提高机体抗氧化、抗炎症能力,参与酶和激素合成,加强合成代谢,从而降低腹泻率,促进仔猪生长[3]。由于土壤锌富集和畜产品残留等问题,欧盟决定于2022年全面禁止使用断奶仔猪高锌饲粮,我国农业农村部也规定仔猪断奶后2周饲粮中ZnO形式的锌添加量上限为1 600 mg/kg[3-6]。同时,ZnO对PEDV感染仔猪抗腹泻的作用机制尚不明确。因此,本试验拟通过建立PEDV感染模型,研究ZnO对新生阶段仔猪抗PEDV的影响,为有机锌等ZnO替代物在幼龄仔猪生产中的应用提供数据参考和理论依据。
1 材料与方法
1.1 试验材料
PEDV(YN株)由华中农业大学微生物重点实验室提供。ZnO(含量≥95%)购自南京某生物科技有限公司。
1.2 试验设计
本试验采用完全随机区组设计,将24头平均体重为(2.5±0.2) kg的健康7日龄仔猪(杜×长×大)随机分成4组,分别为对照组、ZnO组、PEDV组和PEDV+ZnO组,每组6个重复,每个重复1头猪。试验期12 d,分为感染前(第1~8天)和感染后(第9~12天)2个阶段。ZnO组和PEDV+ZnO组每日口腔灌服100 mg/kg BW ZnO,另外2组则每日口腔灌服相同体积的液体代乳料。试验第9天07:00,PEDV组和PEDV+ZnO组每头猪灌服1 mL 106TCID50(50%组织培养感染剂量)的PEDV溶液,对照组与ZnO组灌服相同体积磷酸盐缓冲溶液(PBS)。试验用代乳料购于中国牧工商集团有限公司,主要成分为全脂奶粉和大豆磷脂,其营养水平见表1,饲喂时添加0.1‰维生素预混料,该维生素预混料可为每千克代乳料提供维生素A 12 500 IU、维生素D32 800 IU、维生素E 30 IU、维生素K 5 mg、维生素B13 mg、维生素B210 mg、维生素B68 mg、烟酸40 mg,维生素B1240 μg、D-泛酸 15 mg、叶酸1 mg、生物素0.08 mg。

表1 代乳料营养水平Table 1 Nutrient levels of milk replacer %
1.3 饲养管理
本试验在湖北省武汉市农业科学院畜牧兽医研究所进行。试验采用全封闭式猪舍,对照组和ZnO组饲养在一间猪舍,PEDV组与PEDV+ZnO组饲养在另一间猪舍。2间猪舍建筑设计完全一致,试验期舍内温度为(32±2) ℃,相对湿度为60%~70%。试验仔猪分栏饲养于2 m×3 m的漏缝式地板圈内,每天清扫猪舍1次,并用联灭、百盛、百毒杀等消毒液交替喷洒消毒栏舍。试验代乳料用45~55 ℃的温水冲泡,分别在07:30、11:00、15:00、18:30、21:00分5次饲喂,在早、中、晚各增喂1次温水。
1.4 检测指标与方法
1.4.1 生长性能
于试验第1、9和12天的07:30空腹称重,记录每头仔猪体重,每天记录仔猪采食量,并计算平均日增重(average daily gain,ADG)和料重比(feed to gain ratio,F/G),计算公式如下:
ADG=总增重/试验天数;F/G=每头仔猪总采食量/每头仔猪总增重。
1.4.2 腹泻指数
整个试验期间每天观察并记录仔猪健康状况和腹泻发生情况。按照粪便形态进行评分,被分为4个等级:0=正常,1=糊状,2=半液体,3=液体,得分≥2视为腹泻[7]。按如下公式计算腹泻指数:
腹泻指数(%)=(每头仔猪粪便评分之和/观察总天数)×100。
1.4.3 血清生化指标
于试验第12天06:00,所有仔猪均口服10%D-木糖(1 mL/kg BW),1 h后对所有仔猪进行前腔静脉采血。使用全自动生化分析仪(日立HITEC-7100,日本),采用试剂盒(购自富士胶片和光纯耀化学有限公司)测定血清总胆红素(TB)、总蛋白(TP)、白蛋白(ALB)、总胆固醇(TC)、甘油三酯(TG)、肌酐(CREA)、葡萄糖(GLU)、钙(Ca)、磷(P)、高密度脂蛋白(HDL)、低密度脂蛋白(LDL)、直接胆红素(DB)含量和谷丙转氨酶(AST)、谷草转氨酶(ALT)、碱性磷酸酶(ALP)、γ-谷氨酰转移酶(GGT)、乳酸脱氢酶(LDH)活性。
1.4.4 肠道屏障功能指标
所有仔猪采血后用50 mg/kg BW戊巴比妥钠肌肉注射麻醉后屠宰取样,收集肠道样品,参照Vilaseca等[8]的方法对肠道损伤进行评分,分为4个等级:0=没有肉眼可见出血点;1=偶有损伤(肠道有零星有出血点);2=肉眼可见明显损伤(肠道出现溃疡,肠壁变薄变透);3=肠道溃疡、糜烂,肠壁严重变薄变透并充血。评分后取样并贮存于4%多聚甲醛溶液中固定,经脱水、透明和石蜡包埋后进行切片,苏木精-伊红染色后晾干制片。使用光学显微镜(Olympus,日本)观察切片并记录绒毛高度(villous height,VH)、隐窝深度(crypt depth,CD)以及绒毛表面积(villous area,VA),计算绒毛高度/隐窝深度比值(VH/CD)。
血清D-木糖含量和二胺氧化酶(DAO)活性均按照南京建成生物工程研究所试剂盒说明书中提供的方法和步骤进行测定。
1.4.5 血清和肠道抗氧化指标
称取0.16~0.18 g肠道组织,剪碎混匀,按样本重(g)∶生理盐水(mL)=1∶9制备10%的组织匀浆,3 000 r/min离心10 min,取上清,-80 ℃保存用于测定肠道抗氧化指标。按试剂盒(购自南京建成生物工程研究所)提供的方法,使用多功能酶标仪(Spectra Max M5,Molecular Devices,美国)测定血清和肠道中谷胱甘肽过氧化物酶(GSH-Px)、过氧化氢酶(CAT)、总超氧化物歧化酶(T-SOD)活性以及总抗氧化能力(T-AOC)和丙二醛(MDA)、过氧化氢(H2O2)含量。
1.5 数据统计分析
采用SPSS 21.0统计软件对感染前仔猪生长性能数据进行单因素方差分析,对感染后的试验数据进行双因素方差分析(two-way ANOVA),当组间差异显著时,采用Duncan氏法进行多重比较。以P<0.05作为差异显著性的评定标准,0.05≤P<0.10时表示有显著趋势。试验结果用平均值±标准差表示。
2 结 果
2.1 ZnO对新生阶段仔猪生长性能的影响
由表2可见,PEDV感染前,灌服ZnO后仔猪F/G显著降低(P<0.05),ADG有提高的趋势(P=0.057)。由表3可见,仔猪感染PEDV后ADG显著下降(P<0.05),F/G显著升高(P<0.05);灌服ZnO有提高感染后仔猪ADG的趋势(P=0.051),并显著降低F/G(P<0.05);灌服ZnO和感染PEDV对仔猪F/G存在交互效应(P<0.05)。
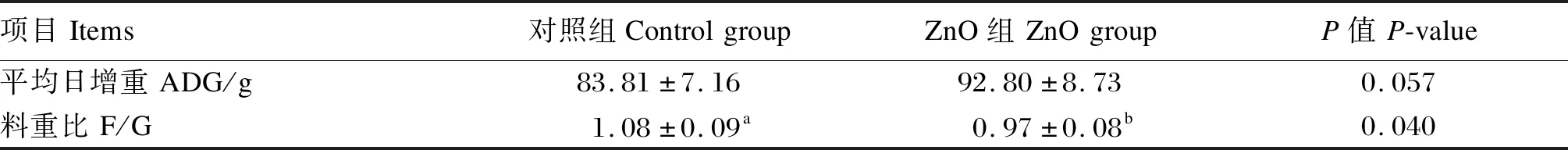
表2 ZnO对PEDV感染前新生阶段仔猪生长性能的影响Table 2 Effects of ZnO on growth performance of neonatal piglets before infected with PEDV (n=6)

表3 ZnO对PEDV感染新生阶段仔猪生长性能的影响Table 3 Effects of ZnO on growth performance of neonatal piglets infected with PEDV (n=6)
2.2 ZnO对PEDV感染新生阶段仔猪腹泻指数的影响
试验全期对照组和ZnO组仔猪均未出现腹泻。由表4可知,仔猪感染PEDV后腹泻指数显著升高(P<0.05),而灌服ZnO显著降低感染PEDV仔猪腹泻指数(P<0.05)。

表4 ZnO对PEDV感染新生阶段仔猪腹泻指数的影响Table 4 Effects of ZnO on diarrhea index of neonatal piglets infected with PEDV (n=6)
2.3 ZnO对PEDV感染新生阶段仔猪血清生化指标的影响
由表5可知,仔猪感染PEDV后血清TC、P、LDL、HDL含量和ALT、ALP、GGT、LDH活性显著下降(P<0.05),血清GLU含量显著升高(P<0.05);灌服ZnO能显著降低仔猪血清ALT活性(P<0.05),显著增加血清GGT活性(P<0.05);灌服ZnO和感染PEDV对仔猪血清LDH活性存在交互作用(P<0.05)。
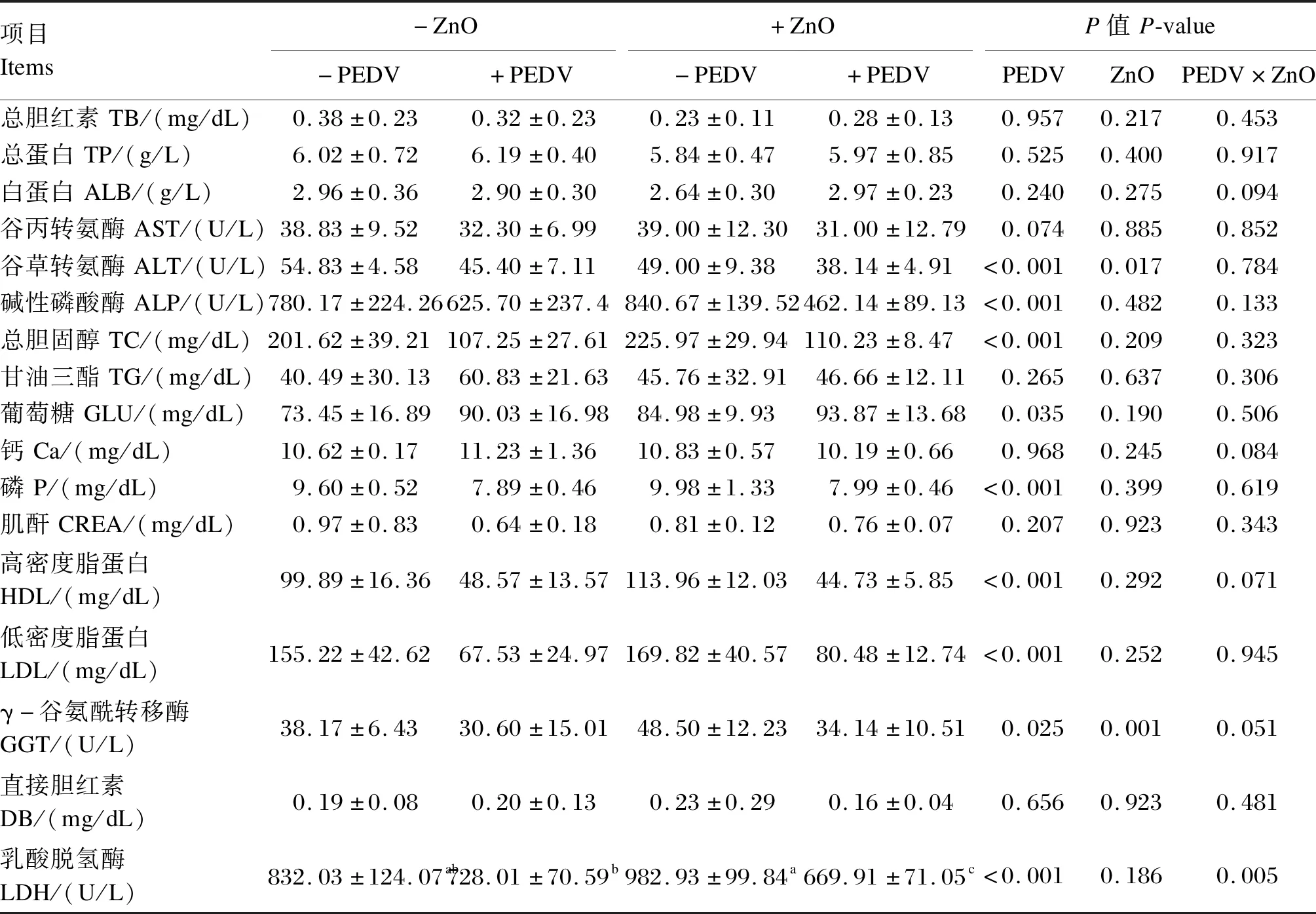
表5 ZnO对PEDV感染新生阶段仔猪血清生化指标的影响Table 5 Effects of ZnO on serum biochemical indexes of neonatal piglets infected with PEDV (n=6)
2.4 ZnO对PEDV感染新生阶段仔猪肠道评分和肠道吸收相关指标的影响
由表6可知,仔猪感染PEDV后十二指肠、空肠、回肠和结肠的肠道评分以及血清DAO活性显著提高(P<0.05),血清D-木糖含量显著降低(P<0.05);灌服ZnO能显著降低仔猪空肠肠道评分和血清DAO活性(P<0.05),显著增加血清D-木糖含量(P<0.05);灌服ZnO和感染PEDV对仔猪空肠肠道评分和血清DAO活性存在交互作用(P<0.05)。

表6 ZnO对PEDV感染新生阶段仔猪肠道评分和肠道吸收相关指标的影响Table 6 Effects of ZnO on intestinal score and intestinal absorption-related indexes of neonatal piglets infected with PEDV (n=6)
2.5 ZnO对PEDV感染新生阶段仔猪肠道形态的影响
由表7可知,仔猪感染PEDV后空肠和十二指肠VH,十二指肠、空肠、回肠VA显著下降(P<0.05),空肠、回肠CD显著下降(P<0.05),结肠CD显著增加(P<0.05),十二指肠和回肠VH/CD显著下降(P<0.05);灌服ZnO显著提高仔猪十二指肠、空肠和回肠VH和CD(P<0.05),显著提高仔猪十二指肠、空肠VA(P<0.05);灌服ZnO和感染PEDV对仔猪空肠CD和VA以及十二指肠VH/CD存在交互作用(P<0.05)。
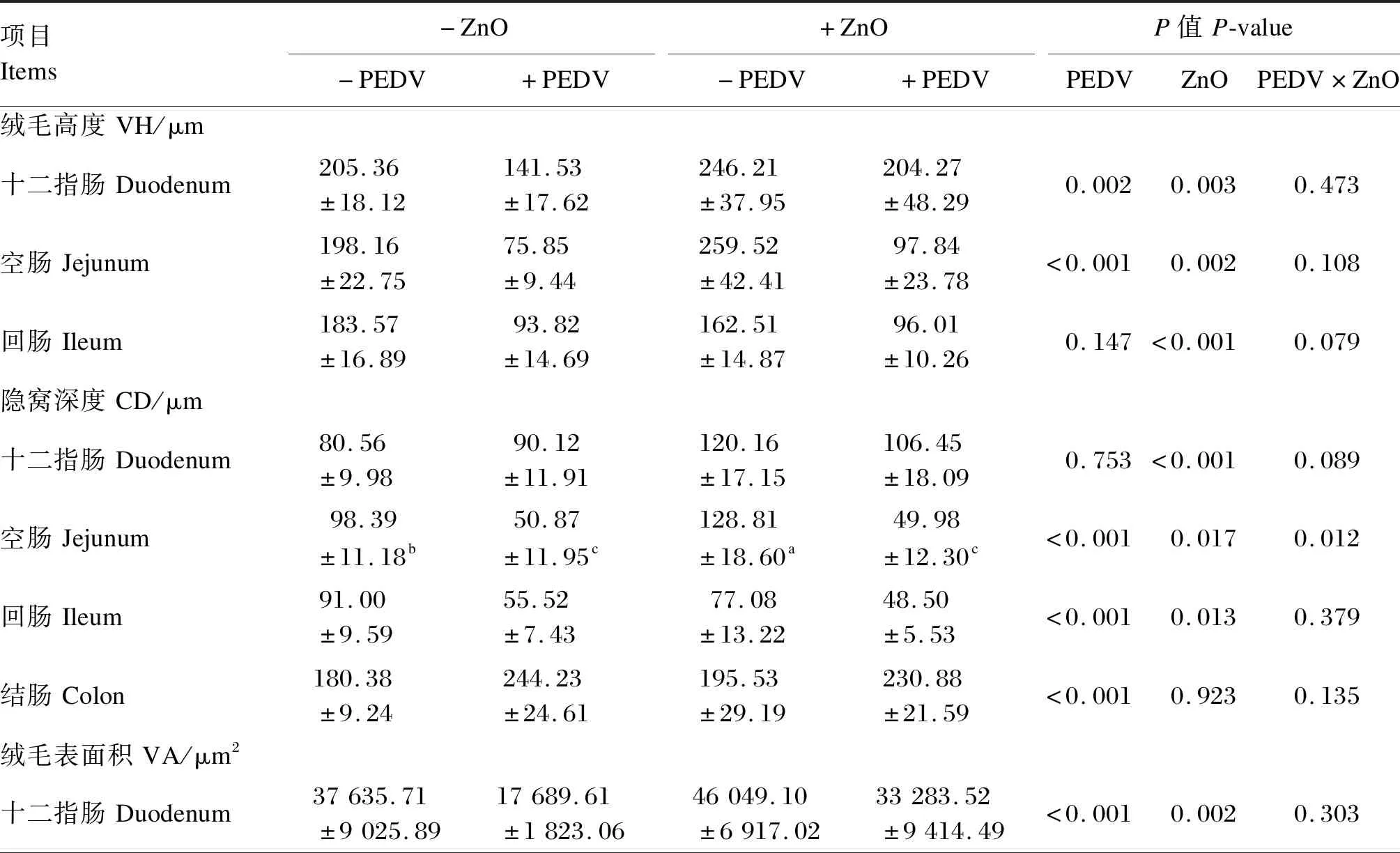
表7 ZnO对PEDV感染新生阶段仔猪肠道形态的影响Table 7 Effects of ZnO on intestinal morphology of neonatal piglets infected with PEDV (n=6)
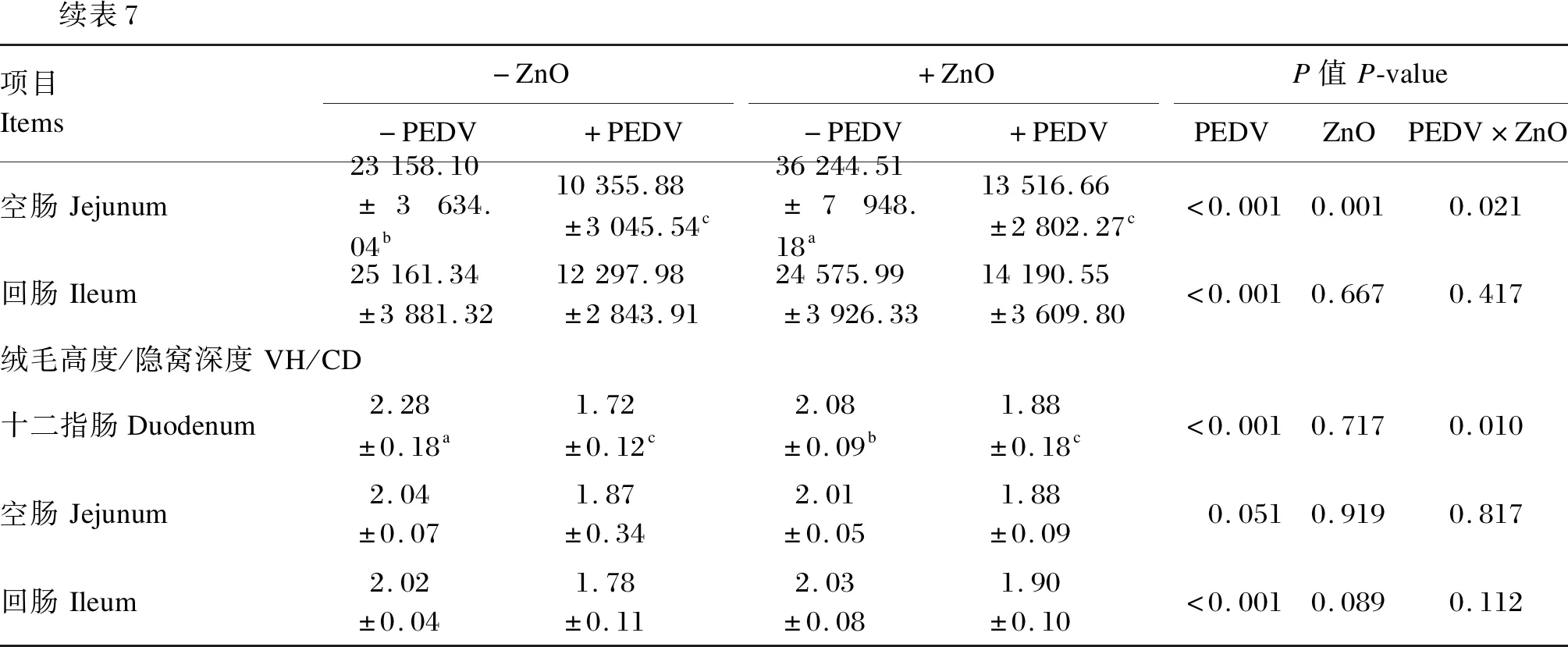
续表7项目Items-ZnO-PEDV+PEDV+ZnO-PEDV+PEDVP值P-valuePEDVZnOPEDV×ZnO空肠Jejunum23158.10±3634.04b10355.88±3045.54c36244.51±7948.18a13516.66±2802.27c<0.0010.0010.021回肠Ileum25161.34±3881.3212297.98±2843.9124575.99±3926.3314190.55±3609.80<0.0010.6670.417绒毛高度/隐窝深度VH/CD十二指肠Duodenum2.28±0.18a1.72±0.12c2.08±0.09b1.88±0.18c<0.0010.7170.010空肠Jejunum2.04±0.071.87±0.342.01±0.051.88±0.090.0510.9190.817回肠Ileum2.02±0.041.78±0.112.03±0.081.90±0.10<0.0010.0890.112
2.6 ZnO对PEDV感染新生阶段仔猪血清和肠道抗氧化指标的影响
由表8可知,仔猪感染PEDV后血清GSH-Px和T-SOD活性显著下降(P<0.05);灌服ZnO能显著提高PEDV感染仔猪血清CAT活性(P<0.05)。灌服ZnO和感染PEDV对仔猪血清CAT活性存在交互作用(P<0.05)。
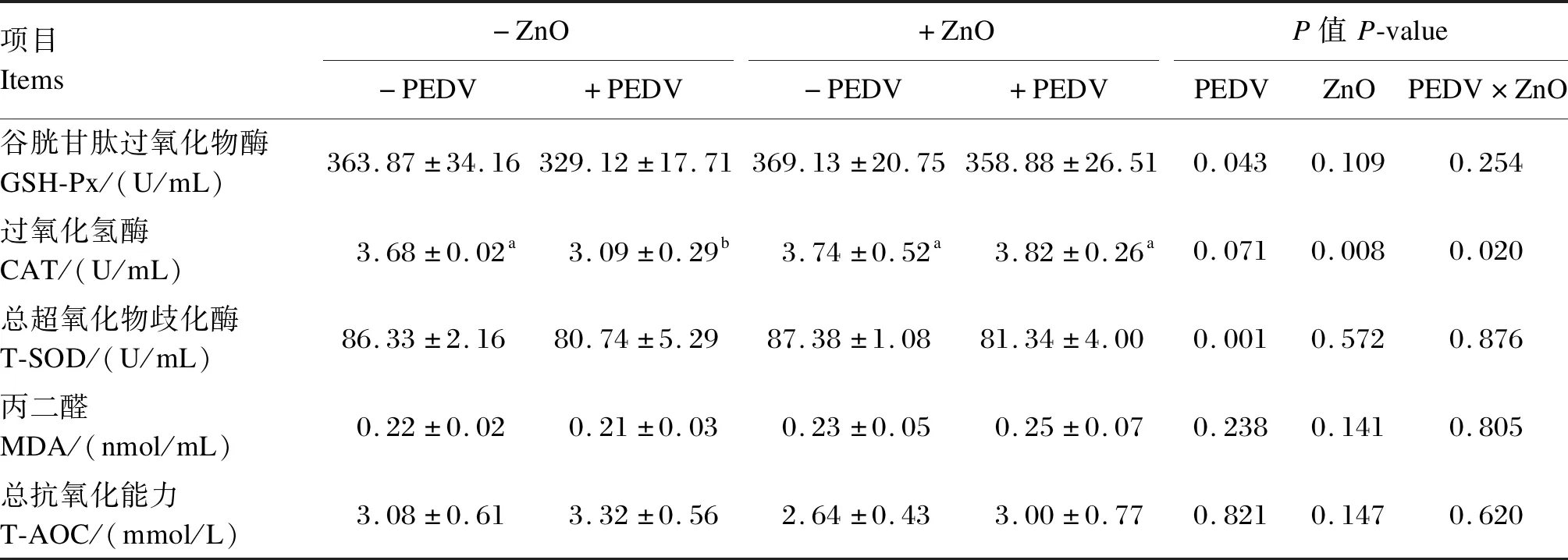
表8 ZnO对PEDV感染新生阶段仔猪血清抗氧化指标的影响Table 8 Effects of ZnO on serum antioxidant indexes of neonatal piglets infected with PEDV (n=6)
由表9可知,仔猪感染PEDV后十二指肠和空肠GSH-Px活性显著升高(P<0.05);灌服ZnO能显著提高PEDV感染仔猪空肠GSH-Px活性(P<0.05)。仔猪感染PEDV后空肠CAT活性显著下降(P<0.05);灌服ZnO能显著提高PEDV感染仔猪空肠CAT和T-SOD活性(P<0.05)。灌服ZnO和感染PEDV对仔猪空肠GSH-Px和T-SOD活性存在交互作用(P<0.05)。灌服ZnO显著降低了PEDV感染仔猪十二指肠MDA含量(P<0.05)。仔猪感染PEDV后空肠T-AOC显著下降(P<0.05)。灌服ZnO和感染PEDV对仔猪十二指肠MDA含量与结肠H2O2含量以及空肠GSH-Px和T-SOD活性、T-AOC存在交互作用(P<0.05)。
3 讨 论
本试验中仔猪感染PEDV后出现呕吐、腹泻和脱水症状,平均日增重显著降低,与PEDV感染症状相符[9]。研究表明,ZnO能保持小肠形态结构完整,促进肠绒毛生长和肠黏膜损伤修复,增加紧密连接蛋白表达,缓解肠道形态和通透性的改变,具有收敛作用,可避免病原附着和腹泻[10]。本试验中,灌服ZnO后感染PEDV仔猪料重比与腹泻评分显著降低,说明ZnO能有效改善PEDV感染引起的生长性能下降。与本试验结果一致,Zhang等[7]研究表明,灌服100 mg/kg BW ZnO可以改善PEDV感染仔猪的生长性能,降低腹泻率。
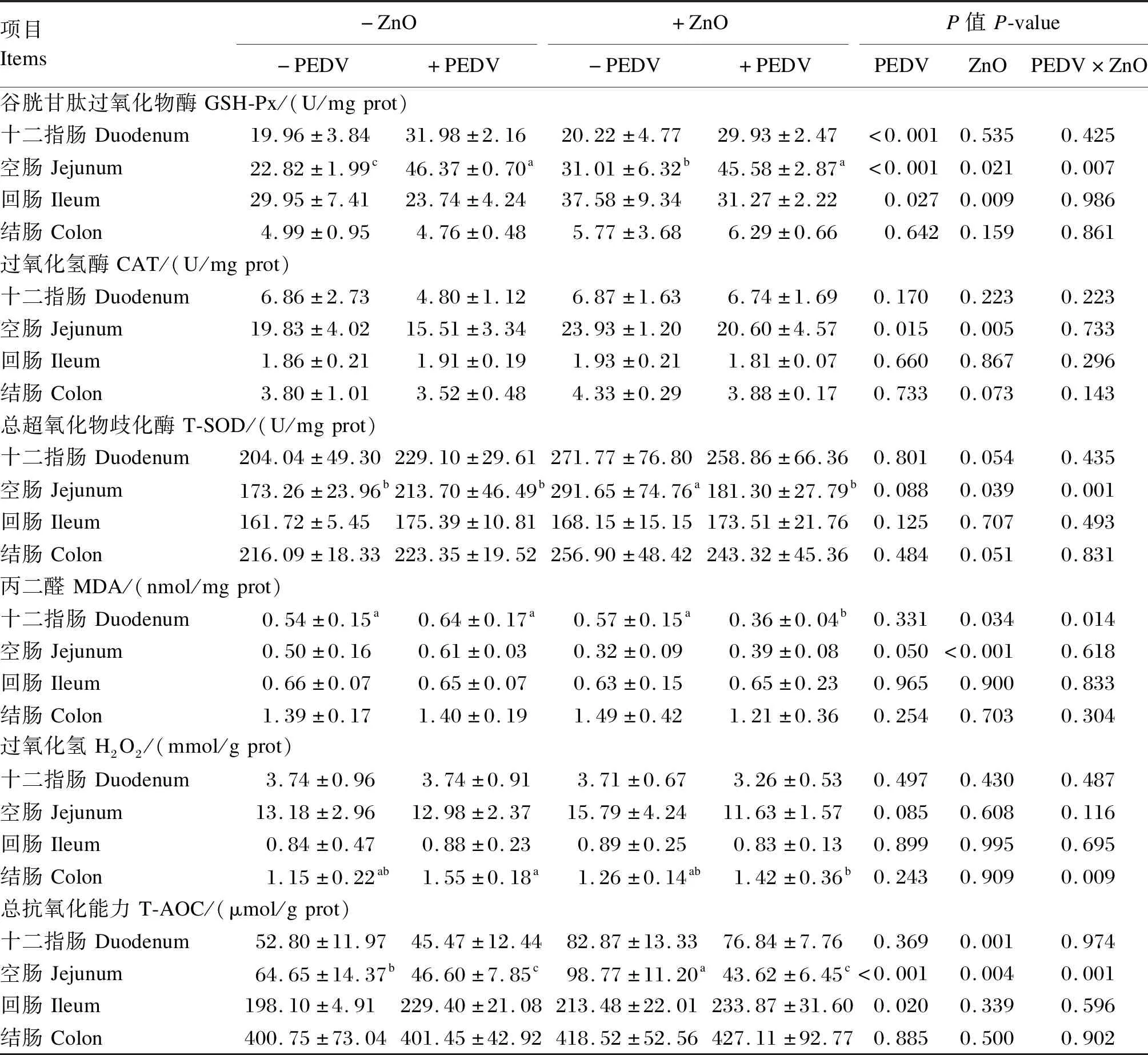
表9 ZnO对PEDV感染新生阶段仔猪肠道抗氧化指标的影响Table 9 Effects of ZnO on intestinal antioxidant indexes of neonatal piglets infected with PEDV (n=6)
动物血清生化指标受饲粮营养水平的影响,可以间接反映机体自身营养水平和健康状况[11]。AST和ALT作为肝脏组织细胞中主要的氨基转移酶,直接影响幼龄畜禽体内蛋白质代谢水平[12]。本试验结果表明,感染PEDV后,仔猪血清中ALT和ALP活性显著下降,说明PEDV感染可能导致仔猪蛋白质代谢水平下降。血清中TC含量可反映机体对脂肪代谢的能力,HDL和LDL是运输胆固醇的载体,对维持机体脂类代谢稳定起重要作用[13]。本研究结果表明,PEDV感染导致仔猪血清HDL、LDL和TC含量下降,说明PEDV感染可能阻碍了营养物质转运。此外,本试验结果还表明,PEDV感染后仔猪血清GLU含量显著升高,LDH活性显著下降,说明PEDV感染使机体的糖代谢能力下降,灌服ZnO并没有缓解PEDV感染导致的糖代谢能力下降。
血清DAO活性和D-木糖含量可作为反映肠道屏障功能损伤的理想指标[14-15]。本试验中,仔猪感染PEDV后,血清中DAO活性显著升高,D-木糖含量显著下降,说明仔猪的肠道黏膜因感染PEDV受到损伤,影响了仔猪的肠道吸收功能。同时,感染PEDV后,仔猪十二指肠、空肠、回肠和结肠的肠道评分显著升高,说明PEDV感染导致仔猪肠道屏障功能损伤,灌服ZnO能有效缓解感染PEDV引起的空肠肠道评分上升。
PEDV感染仔猪会发生腹泻,从而导致小肠黏膜萎缩、绒毛变短、隐窝加深[15-16]。有研究表明,ZnO可显著提高断奶仔猪的VH,降低CD,提高VH/CD[17]。汤俊[18]研究表明,仔猪在感染轮状病毒后十二指肠和回肠CD下降。本试验中,仔猪PEDV感染后,十二指肠和空肠VH显著下降,结肠CD显著升高,十二指肠、空肠和回肠VA以及十二指肠和回肠VH/CD显著下降。灌服ZnO后,感染PEDV仔猪空肠VA显著上升,说明ZnO能有效缓解仔猪感染PEDV引起的肠黏膜萎缩。
机体受到外界刺激后会产生大量氧自由基,从而导致机体受到氧化损伤,动物可经过GSH-Px、CAT和T-SOD等抗氧化酶清除氧自由基[19-24]。MDA含量则用来判断机体脂质过氧化和细胞损伤程度,可作为体内氧化应激的标志[25]。研究发现,细胞外自由基的清除反应及机体体内抗氧化剂之间的相互协作可通过T-AOC的强弱反映[26-27]。本试验结果发现,仔猪感染PEDV后,血清GSH-Px活性显著下降,十二指肠和空肠GSH-Px活性显著上升。仔猪灌服ZnO后,血清CAT活性显著上升,十二指肠MDA含量和结肠H2O2含量显著下降,可能是PEDV感染导致仔猪机体发生自身免疫,从而使GSH-Px活性上升;血清CAT和T-SOD活性显著下降,十二指肠和空肠T-AOC显著下降,空肠MDA含量呈降低趋势,说明PEDV感染可以引发机体氧化应激反应,造成氧化损伤。而灌服ZnO具有缓解感染PEDV引起的回肠GSH-Px活性下降与结肠H2O2含量上升以及空肠T-AOC下降的作用。
4 结 论
灌服100 mg/kg BW ZnO缓解了由感染PEDV导致的新生阶段仔猪生长性能的下降,提高了肠道屏障功能和机体抗氧化能力。
