龙须菜5种生活史阶段藻体间内参基因的筛选❋
2022-11-15张赢月杨金鑫
杨 泽,张赢月,杨金鑫,徐 涤
(中国海洋大学海洋生命学院,海洋生物遗传学与育种教育部重点实验室,山东 青岛 266003)
对具有世代交替生活史的藻类植株不同生活史阶段的特异表达基因分析是藻类研究的一个重要领域[1-2],而实时荧光定量PCR(real-time qPCR)因其灵敏度高、可重复性和动态范围大[3],常用于比较不同样品或不同组织的基因转录水平,以及基因表达的评估[4-6]。但是基因表达分析还依赖于合适的在各样品中稳定表达的内参基因,而人们逐渐认识到没有一个基因可以作为所有物种的内部控制基因[7-10]。此外,对于某些研究来说,选择单一的内部控制基因进行标准化并不完全可靠,在某些条件下,用两种或两种以上内部控制基因进行标准化所获得的结果可能有差异甚至是相互矛盾的[8,11-13]。与藻类特定生活史阶段相关的基因表达分析还涉及到不同倍性藻体的表达差异等问题,因此要求本文作者对研究的物种进行逐一的分析,研究内参基因在不同生活史阶段、不同组织(或细胞)中表达的差异,并确定适当的内参因对于研究特定物种的基因表达至关重要。
龙须菜(Gracilariopsislemaneiformis)是一类重要的经济红藻,主要作为提取琼胶的原料[14],因其蛋白质含量较高,龙须菜也可用于食品、鲍鱼饲料等[15]。龙须菜在中国广泛分布于黄海海域[16],在山东主要分布在潮间带[17],属于红藻门(Rhodophyta)、红藻纲(Rhodophyceae)、江蓠科(Gracilariaceae)、龙须菜属(Gracilariopsis)。龙须菜的生活史具有世代交替现象,共有3个世代,包括二倍体的四分孢子体世代和果孢子体世代,以及单倍体的配子体世代,其中四分孢子体与配子体的形态相同,为大型的枝叶状藻体;而果孢子体囊状,个体微小,生长在雌配子体枝条上[18]。
以往针对大型红藻的内参基因筛选,往往要检测在环境条件变化下的表达稳定性[19],却很少针对不同世代藻体本身。然而对藻类发育和世代交替过程的研究需要探究的不仅仅是环境条件对其影响,藻体自身的基因调控机制更是相关研究的重点。因此本文研究了9个管家基因(18SrRNA、28SrRNA、甘油醛-3-磷酸脱氢酶基因(GAPDH)、肌动蛋白基因(ACT)、翻译延伸因子1(EF1)、别藻蓝蛋白基因(APC)、藻红蛋白基因(PEB)、核酮糖-1,5-二磷酸羧化酶大亚基基因(rbcL)和细胞色素c氧化酶基因(COX))在龙须菜5种枝叶状生活史阶段的藻体中的表达稳定性,用于筛选其不同生活史阶段中稳定表达的内参基因,为今后对龙须菜的繁殖及世代相关基因的研究奠定基础。
1 材料与方法
1.1 实验材料
实验选取5种实验材料:样品1~3分别为自然界采集的野生成熟四分孢子体、雌配子体和雄配子体。成熟的四分孢子体和雌配子体可分别通过藻体表面上的四分孢子囊和囊果来确定,而龙须菜的精子囊平面分布于表皮层,无法从形态上区分[16],只能通过与雌配子体杂交后确认。野生龙须菜于10月份采集自青岛浮山湾(36°0′N,120°2′E),使用灭菌海水对各阶段藻体进行刷洗,然后将其放入添加了 f/2 培养基的灭菌海水中,在温度为23 ℃、光照为25 μmol·m-2·s-1、光周期L/D为12 h/12 h条件下进行暂养,一周后选取状态良好的部位迅速于液氮中速冻,随即暂存于-80 ℃冰箱。样品4和5分别为实验室预先培养的幼孢子体和幼配子体,由野生果孢子体和四分孢子体放散的果孢子及四分孢子萌发后长成的,选取长度约为3~4 cm的小苗,也暂存于-80 ℃冰箱。
1.2 引物设计
本研究选取9个管家基因作为候选内参基因(见表1。其中,GAPDH、APC、rbcL的引物是通过使用Primer Premier 6.0 依据引物设计原则自行设计而得到的,其他6个基因引物是参考文献[19]而得的。

表1 候选内参基因引物相关信息Table1 Primers related information of candidate internal reference genes
1.3 总RNA提取和第一链cDNA合成
样品1~5各称取 0.15 g藻体,使用 RNA 提取试剂盒(TaKaRa)提取总RNA,使用2%琼脂糖凝胶电泳证实总RNA的完整性,并使用NanoDrop测定RNA浓度。使用反转录试剂盒 PrimeScriptTMRT Master Mix(TaKaRa)对所提RNA进行反转录,反应总体系为20 μL,包含10 μL RNA(200 ng/μL)、4 μL 5×PrimerScript RT Master Mix和6 μL RNase Free dH2O。
1.4 标准曲线的绘制
使用各特异性引物,通过聚合酶链反应扩增每个管家基因的片段,使用琼脂糖凝胶回收试剂盒(OMEGA Bio-Tek,Doraville,GA,USA)纯化扩增产物,随后将每个管家基因片段克隆至007载体(TSKINGKE),使用NanoDrop测定线性质粒的浓度,按照下列公式计算管家基因的初始拷贝数[20]:
Copy number=
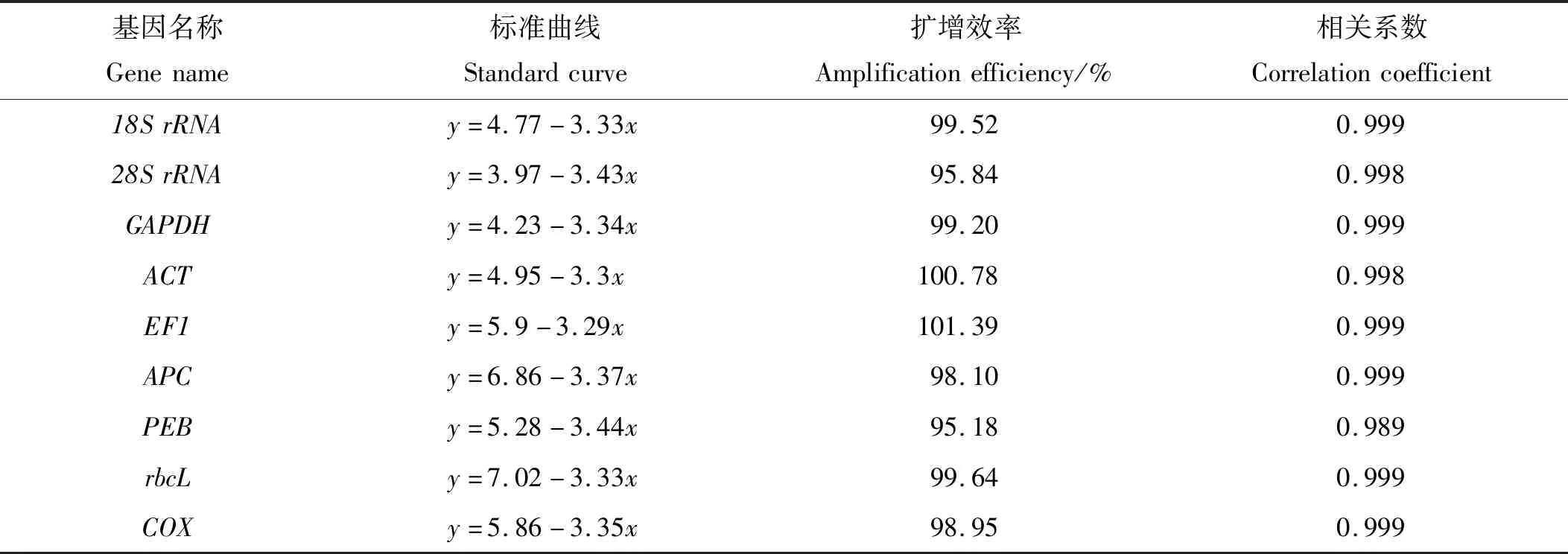
使用TB Green®PremixExTaqTMⅡ 试剂盒在定量PCR仪(BIOER LineGene 9640)上进行qRT-PCR,反应体系为20 μL,反应混合物包含:10 μL SYBR Green Master Mix、1 μL 1∶10系列稀释的线性化质粒模板(共稀释5级)、1 μL正向引物(10 mmol/L)、1 μL反向引物(10 mmol/L)以及7 μL RNase-free的水。qRT-PCR反应程序为:95 ℃预变性30 s;95 ℃变性5 s,60 ℃退火30 s,共40个循环。绘制扩增产物熔解曲线(65~95 ℃),获得Ct值,根据标准品的Ct值与相应基因拷贝数构建标准曲线[21]。
1.5 各样品的实时荧光定量PCR反应
qRT-PCR反应体系与反应程序同上。所有样品以总RNA的量进行归一化,每个样品设置3个平行样,扩增效率(E)和线性相关系数(R2)用于评估引物效率:
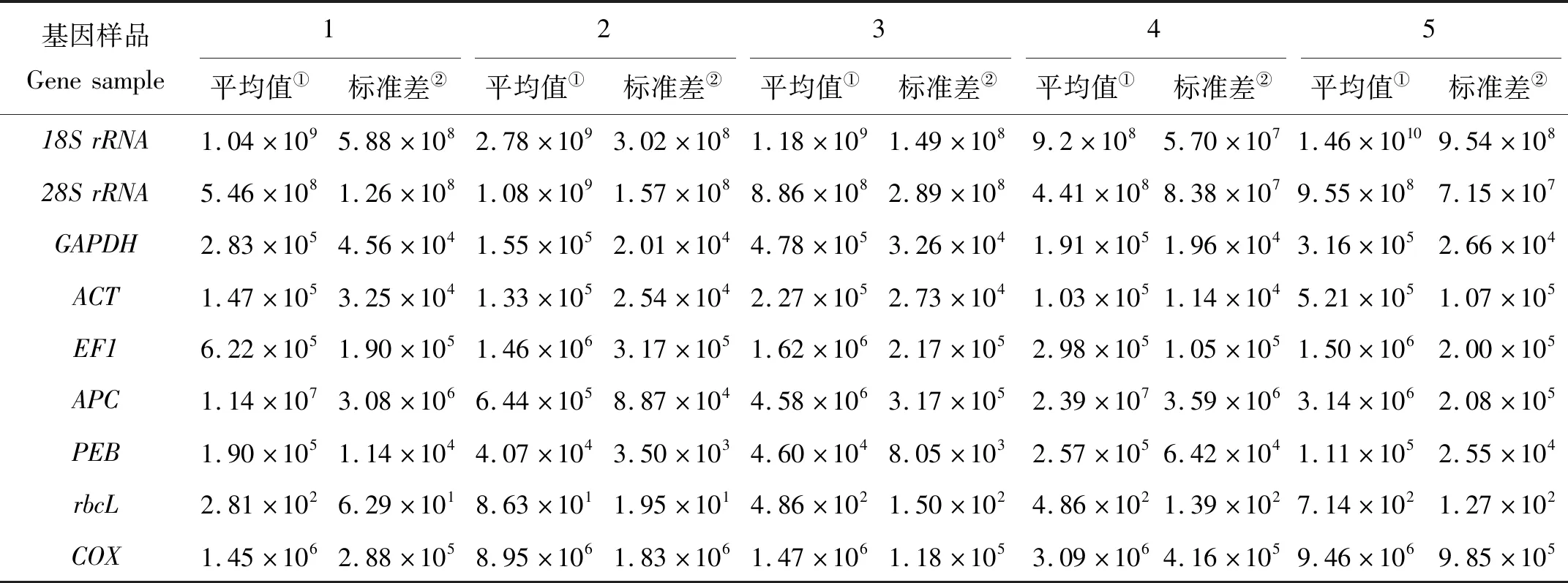
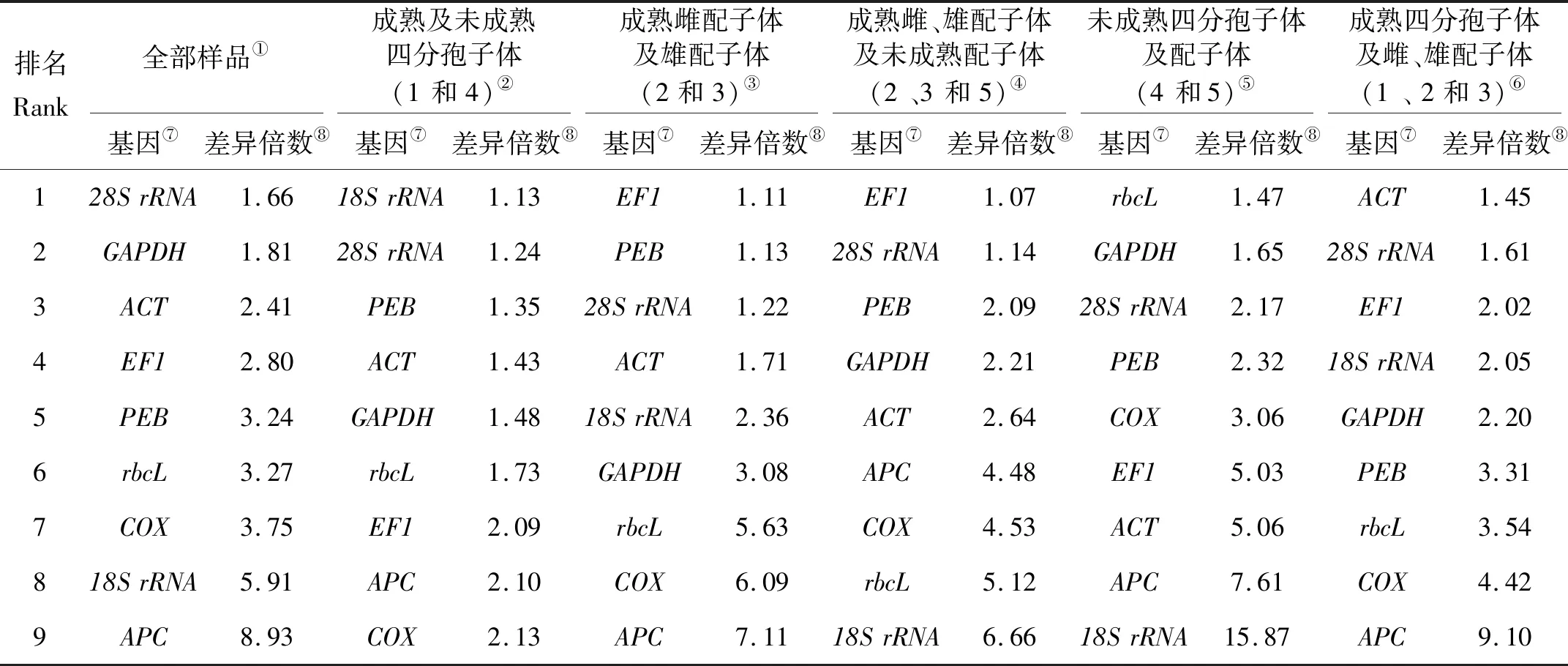
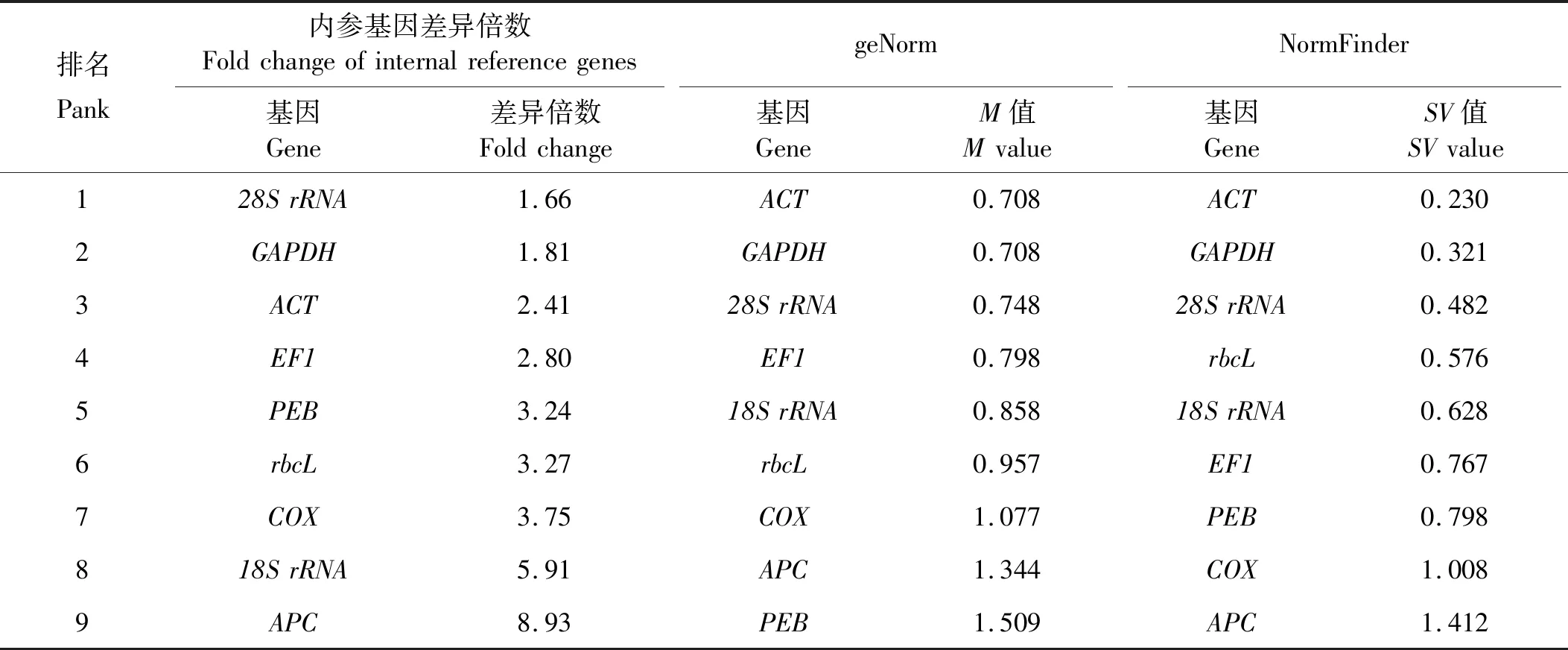
E(%)=(10[-1/slope]-1)×100,0.98 式中:slope代表标准曲线的斜率;R2越接近1,表示线性关系越显著,数据越准确。 (1) 通过Ct值与标准曲线的关系[22],可以得出5种材料的基因拷贝数,通过拷贝数的差异来评价基因的稳定性。 (2) 采用geNorm软件[23]对qRT-PCR的结果进行计算,并得出稳定参数M。 (3) 采用NormFinder软件[24]对qRT-PCR结果进行计算,得出稳定值SV,比较候选内参基因的稳定性。 琼脂糖凝胶电泳分析结果见图1,提取的5个样品的总RNA皆有28S、18S、5S三条带,表明提取的RNA完整性较高。 对9个候选内参基因的PCR产物进行琼脂糖凝胶电泳(见图2),结果表明,每个候选内参基因的PCR扩增产物都为单一条带,片段大小与预期一致;通过对9个候选内参基因进行qRT-PCR,可以发现,熔解曲线皆有单一溶解峰,且扩增效率分布在95.18%~101.39%之间,表明候选内参基因的引物特异性符合要求(见表2)。 表2 候选内参基因标准曲线及扩增效率Table 2 Standard curve and amplification efficiency of candidate internal reference genes 通过对龙须菜不同生活史阶段候选内参基因循环阈值(Ct值)分析(见图3)发现,9个候选内参基因的Ct平均值范围为6.18~30.77。其中:18SrRNA的转录水平最高,其Ct值为4.14~7.20;rbcL的转录水平最低,其Ct值为29.12~33.52。值得注意的是,所有候选内参基因中,GAPDH的Ct值变化范围最小(17.66~19.57),相差1.91个循环;APC的Ct值变化范围最大(15.31~20.86),相差5.55个循环。 2.3.1 候选内参基因差异倍数分析 先根据标准曲线获得各样品中内参基因的拷贝数(见表3),然后通过比较基因拷贝数两两之间的差异对龙须菜不同生活史阶段中的这些候选内参基因的稳定性进行了多组合分析。在每个分析组中,如果只有2个样品则直接进行比较;如果分析组中样品数多于2个则先进行两两比较后取平均值。 表3 不同样本候选内参基因拷贝数Table 3 Copy number of candidate internal reference genes in different samples copy·μg-1 最终的排序列于表4,结果显示,在全部5个样品中,28S的差异倍数最小(1.66倍),其次是PEB(1.81倍),再次是ACT(2.41倍);在成熟及未成熟四分孢子体(1和4)的比较中,18SrRNA的差异倍数最小(1.13倍),其次是28SrRNA(1.24倍),再次是PEB(1.35倍);在成熟雌配子体和雄配子体(2 和3)的比较中,EF1的差异倍数最小(1.11倍);在成熟雌、雄配子体及未成熟配子体(2 、3 和5)的比较中,EF1的差异倍数最小(1.07倍);在未成熟四分孢子体及配子体(4 和5)的比较中,rbcL的差异倍数最小(1.47倍),其次是GAPDH(1.65倍)、28SrRNA(2.17倍);在成熟四分孢子体及雌、雄配子体(1 、2 和3)的比较中,ACT的差异倍数最小(1.45倍),其次是28SrRNA的差异倍数(1.61倍),再次是EF1的差异倍数(2.02倍)。 表4 候选内参基因在不同实验设置下拷贝数差异倍数比较Table 4 Comparison of copy number difference multiples of candidate internal reference genes under different experimental settings 2.3.2 两种软件分析全部样本候选内参基因结果 2.3.2.1 geNorm软件分析结果 利用Vandesompele等[5]编写的geNorm软件,通过Ct值筛选合适的内参基因(见表5),根据M值对候选内参基因进行排序(M越小,稳定性越好,反之,稳定性越差),同时根据差异性(Varied across,V)确定最适内参基因数目,若Vn/Vn+1<0.15,则最适内参基因数目为n个,反之则为n+1个。结果表明:在全部样本中,除PEB(M=1.509)外,其他候选内参基因的稳定参数M值均小于临界值1.5,ACT和GAPDH的M值最小(0.708),稳定性最好;PEB的M值最大(1.509),稳定性最差;在比较配对差异性时发现,Vn、Vn+1均大于0.15,因此不能靠阈值(0.15)来决定最适内参基因个数,评估目的基因在5种材料之间的表达时,选取2~3个稳定性强的内参基因即可。 2.3.2.2 NormFinder软件分析结果 根据计算出的SV值对候选内参基因进行排序(SV值越小,稳定性越高,反之,稳定性越低),结果表明:在龙须菜全部样本之间的比较中,ACT的SV值最小,稳定性最好,其次是GAPDH的SV值,再次是28SrRNA的SV值(见表5)。 表5 候选内参基因表达稳定性综合排名Table 5 Comprehensive ranking of expression stability of candidate internal reference genes 为了准确分析不同生活史阶段和不同组织中的基因表达,必须筛选出合适的内参基因[25-26],本实验基于基因组和转录组数据,对9个具有不同功能的候选内参基因,通过拷贝数差异倍数分析法并采用geNorm、NormFinder等分析软件对荧光定量PCR的数据进行处理,筛选出适合龙须菜不同世代的定量PCR内参基因。此外,有研究者认为应使用两个或者多个内参基因,以确保实验的准确性[23,27-28],因此对于涉及多个生活史阶段及倍性差异的龙须菜,必须谨慎筛选合适的内参基因。 在之前的研究中,18SrRNA、GAPDH和ACT基因常被选为高等植物和高等动物的内参基因[11,29-32]。以往在藻类研究中这些内参基因也在不同的条件下被使用,例如在衣藻中发现GAPDH可用于冷冻驯化时的基因标准化[33],18SrRNA被选为长石莼不同光强条件下的最佳内参基因[34]。其他内参基因,如EF1基因,已被提议适用于在特定条件下的RT-PCR实验中的基因标准化[35]。在同样涉及多个生活史阶段的条斑紫菜的研究中,发现GAPDH适合用作条斑紫菜不同生活史阶段基因表达研究的内参基因[36],这为研究龙须菜不同生活史阶段的内参基因筛选提供了基础。而在龙须菜中,研究多关注在对环境胁迫的响应上,Ding等[19]筛选出了适合不同温度的内参基因。然而针对江蓠等物种不同世代中特异表达基因的研究[37-38]需要对内参基因的选择进行全面检测评估,以确保实验结果的准确性。 本研究通过对候选内参基因在不同样品中的拷贝数及拷贝数差异倍数的分析,发现二倍体成熟四分孢子体和未成熟四分孢子体(1 vs 4)组内候选内参基因间的拷贝数差异倍数范围最小(1.13~2.13);其次是单倍体成熟雌配子体和雄配子体(2 vs 3)组内侯选内参基因间的拷贝数差异倍数范围(1.11~7.11);再次是成熟雌、雄配子体和未成熟配子体(2 vs 3 vs 5)组内候选内参基因间的拷贝数差异倍数范围(1.07~6.66)。更值得注意的是,成熟四分孢子体和成熟雌、雄配子体(1 vs 2 vs 3)组内候选内参基因间的拷贝数差异倍数较大(1.45~9.10);同时在比较未成熟四分孢子体和配子体(4 vs 5)组内候选内参基因间的拷贝数差异倍数时,发现其差别最大(1.47~15.87)。因而本文作者认为,这些管家基因在不同倍性的藻体间表达差异最大,其次是雌、雄配子体间的表达差异,而成熟四分孢子体和未成熟四分孢子体之间候选内参基因的差异最小。 此外,本研究还使用了geNorm和Normfinder两种常用内参基因筛选软件对全部样品进行了分析,发现结果与使用拷贝数的分析结果总体一致,在研究包含二倍体及单倍体等各阶段生活史样品时,28SrRNA、GAPDH和ACT都被认为是合适的内参基因,因此在今后相近物种的内参基因筛选时可以直接使用软件分析的方法。 因此,本研究作者认为,当仅有二倍体四分孢子体为研究对象时,候选内参基因的稳定性总体较好,推荐18SrRNA、28SrRNA为最适内参基因;当仅有单倍体雌、雄配子体作为研究对象时,推荐EF1、28SrRNA为最优内参基因;综合雌配子体和雄配子体及所有混合样本的分析结果,推荐28SrRNA和ACT为最适内参基因。1.6 结果分析
2 结果与分析
2.1 总RNA提取和候选内参基因引物特异性分析结果
2.2 候选内参基因循环阈值分析结果
2.3 候选内参基因稳定性分析
3 讨论
